浓香型白酒窖内不同空间位置原酒风味物质初步分析
王 轩,张 鲲*,秦 辉,蔡小波,孔 翔,刘林培,何 旭,陈 勇,甘健君,曾茂闯
(1.泸州老窖股份有限公司,四川 泸州 646000;2.农业农村部可再生能源开发与利用重点实验室,四川 成都 610041)
浓香型白酒是以泥窖为发酵容器,经续糟配料、多菌密闭共酵模式生产出的蒸馏酒[1]。原酒作为酒醅发酵结束后提取浓缩得到的最终产物,其成分主要为乙醇、水以及含量在2%左右的风味物质,虽然这些风味物质含量占比较少,但是对酒的风格具有重要影响[2]。原酒的品质、风味、出酒率与酒醅中酿酒微生物多样性密切相关。酒醅中的微生物来源主要是大曲、生产环境以及窖池,由于窖池是一个密闭的生态环境,研究表明窖底泥中微生物多样性与窖壁泥存在明显差异,发酵过程中不同醅层的微生态环境存在一定差异,在微生物区系的演变过程中产生代谢物质差异,导致不同醅层所产原酒的酒质不同[3-4]。郑佳等[5]研究发现,窖泥中香气物质含量与其所处窖池空间位置有关,如上层、中层、下层与窖底的窖泥香气成分组成存在明显的差异,己酸乙酯、己酸、丁酸、乙酸等物质随窖池深度增加而增加,也从侧面反映出不同空间位置原酒风味物质存在差异。
浓香型白酒的典型特征风味化合物包括己酸、乙酸、丁酸和乳酸及其相应的乙酯,其中己酸乙酯和己酸对其典型风味贡献最大[6]。段明松等[7]的研究表明,下层原酒中风味物质的含量最高,其中己酸乙酯、正己醇、异戊醇、正丁醇和己酸等主要风味物质含量依次高于中层、上层原酒。沈才萍等[8]的研究显示,不同空间位置发酵糟醅产酒产质并不相同,上层产酒率高但质量较差,中层产酒率低质量较好,下层产酒率高且质量好。尹倩倩等[9]的研究显示,上、下层原酒主要风味物质含量存在差异,利用正交偏最小二乘判别分析(orthogonalpartialleastsquares-discriminationanalysis,OPLS-DA)模型确定己酸乙酯、乳酸乙酯和正丁醇等15种物质为上下层原酒主要差异风味物质,通过相关性分析确定氧气为造成上下层原酒风味差异的关键因子。马世源等[10]运用PLS-DA结合气味活性值(odor activity value,OAV)分析显示,己酸乙酯、丁酸乙酯、辛酸乙酯、3-甲基丁酸乙酯、己酸丁酯为上、下醅层原酒共有的关键特征风味物质。以上研究表明,不同空间位置原酒之间存在一定差异,由于窖池空间的特殊性,其深度往往超过2 m,仅对上、下两层原酒的风味物质进行分析还不能完全体现窖池空间的差异性,因此还需要深入挖掘不同空间位置原酒,如上、中、下层原酒的之间的典型风味物质以及差异性分析,为后续深入研究提供理论依据。
本研究采用气相色谱-质谱(gas chromatography-mass spectrometer,GC-MS)联用技术对上、中、下层原酒风味物质进行检测,利用层次聚类分析(hierarchical clustering analysis,HCA)、主成分分析(principal component analysis,PCA)、正交偏最小二乘判别分析等多元统计方法对不同空间位置原酒之间的风味物质构成特点和差异进行分析,为揭示浓香型白酒不同空间位置发酵特点提供数据支撑及控制原酒品质提供理论依据。
1 材料与方法
1.1 材料与试剂
酒样取自泸州某酒厂,选取9口老窖池(窖龄40年左右,封窖采用不锈钢盖),待发酵期结束后,由经验丰富的摘酒工进行分段摘酒。氢氧化钠、无水乙醇、浓硫酸等(均为分析纯):成都市科龙化工试剂厂;乙酸正戊酯、叔戊醇、2-乙基正丁酸等标准品(色谱纯):上海安谱有限公司。
1.2 仪器与设备
STO210pH计:奥豪斯仪器(上海)有限公司;DL-1000W电子万用炉:北京市永光明电器制造有限公司;7890A-5975B Agilent气相色谱-质谱联用仪:美国安捷伦公司。
1.3 方法
1.3.1 摘酒工艺
一段酒:从第一滴酒馏出开始,摘酒量为3 kg;二段酒:从二段酒的第一滴酒开始到酒花从“豌豆花”转为“口水花”时,为二段酒,混匀取样;三段酒:从第三段的第一滴酒开始到酒花从“口水花”转为“断花”时,为第三段酒。四段酒:从第四段的第一滴酒开始到酒花从“断花”到表面油珠铺满截止,为第四段酒。分别取上层糟源的2段酒样共9个,编号为(A-S~I-S)、中层糟源的2段酒样共9个,编号为(A-Z~I-Z)、下层糟源的2段酒样共9个,编号为(A-X~I-X),进行理化分析和色谱分析,分别测定上层、中层、下层9个样本的平均值,分别以编号S-2、Z-2、X-2表示。
1.3.2 理化指标检测
酒样总酸、总酯测定:参考GB/T 10345—2022《白酒分析方法》。
1.3.3 挥发性风味物质的定性与定量分析
参考T/CBJ 002—2016《固态法浓香型白酒原酒》采用气相色谱法测定挥发性风味物质。
1.3.4 数据处理
为探究不同醅层原酒风味物质的差异,利用Metabo-Analyst进行HCA;利用Origin(2018)进行PCA;采用SIMCA(14.1)进行OPLS-DA,分别建立模型,观察组间分离情况,并找寻组间差异物质。利用SPSS 20.0对数据进行方差分析,显著性界值P<0.05,从而判断数据差异。
2 结果与分析
2.1 原酒理化指标分析
通过对上、中、下层原酒的总酸及总酯含量进行检测,结果见图1。由图1可知,上层、中层、下层原酒总酸、总酯含量逐层递增,下层原酒总酸含量为(1.56±0.28)g/L,与上层、中层原酒存在显著差异(P<0.05)。下层原酒总酯含量分别(4.27±0.64)g/L,与上层、中层原酒存在显著差异(P<0.05)。总酯变化规律与沈才萍等[8]的研究结果较为一致,可能原因是中、下层糟醅较早进入厌氧发酵,且黄水逐渐渗透,酸醇酯化反应,因此总酯含量显著递增(P<0.05)。文献中指出上层糟醅与封窖泥接触,发酵前期酵母和霉菌占优,利于糖化,淀粉糖化产物主要转化为酒精和产酸,因此总酸含量较高。但本次结果总酸变化却存在一定差异,可能原因是本次取样窖池封窖装置为不锈钢盖,与封窖泥存在一定差异。

图1 酒样总酸和总酯含量的测定结果Fig.1 Determination results of total acid and ester contents of liquor samples
2.2 原酒风味物质分析
通过对上层、中层、下层酒样共27个原酒样品中风味物质进行检测,共检测出42种风味物质,其中酯类15种,醇类10种,酸类8种,其他类9种,检测到的物质使用内标法计算含量后绘制热图,以展示不同空间位置原酒中风味物质的差异,结果见图2。将各类挥发性风味物质含量进行分析,结果见图3。
由图2可知,酒样样本被分为2个大类,上层与中层原酒聚为一类,下层原酒聚为一类,除少数样本未能形成较好的区分,其余样本均有较好的分类。由图2与图3可知,上层、中层、下层原酒各类风味物质构成比较相似,且均是酯类物质含量最高。酯类物质是浓香型白酒中重要的呈香物质,具有花果香,其种类和含量差异赋予浓香型白酒风味的特征性及多样性。酯类物质由酰基辅酶A和醇乙酰转移酶的共同作用下进行生物合成,或者由酸类、醇类物质在酯化酶、脂肪酶等酶类物质协同催化作用下合成[11]。上层、中层、下层原酒酯类物质含量逐层递增。下层原酒中己酸乙酯、丁酸乙酯、戊酸乙酯、乙酸乙酯含量分别为2565.52 mg/L、153.87 mg/L、42.45 mg/L、2 214.26 mg/L,是中层原酒的1.21倍、2.11倍、1.64倍、1.37倍;是上层原酒的2.59倍、2.89倍、2.11倍、1.26倍。由于窖壁上、中、下层和窖底因微生物群落存在差异,如上层窖壁泥不会接触到黄水,而黄水线以下的窖泥长期浸泡在黄水中,从而导致不同位置窖泥的微生物群落存在一定差异[12]。张朝正等[13]发现相同窖龄池底泥的微生物群落多样性高于池壁泥,从而促进下层糟醅中丁酸乙酯和己酸乙酯的生成。
白酒中的醇类香气物质以高级醇为主,高级醇对酒的风格以及饮用的舒适度起到重要影响,适量的高级醇可提高酒的厚重感并增加酒的协调性[14]。醇类物质为发酵过程中氨基酸脱氨或糖脱羧反应的结果,同时也是酯类物质生成的前体物质[15]。下层原酒中正己醇、正丁醇、正丙醇分别为186.96 mg/L、688.50 mg/L、318.15 mg/L,是中层原酒的2.05倍、1.96倍、1.33倍;是上层原酒的3.19倍、3.13倍、1.49倍。而上层原酒中3-甲基丁醇(异戊醇)为317.15 mg/L,是中层、下层原酒的1.10倍、1.19倍。有研究表明,白酒中高级醇的合成与酵母、梭菌等的物质代谢有关,如浓香型白酒发酵过程形成正丁醇的主要微生物是贝氏梭菌(Clostridium beijerinckii),该丁醇产生菌通过糖代谢合成途径(Harris途径)合成,且该菌在窖壁泥中的含量决定了窖池中正丁醇生成量[16];少孢哈萨克斯坦酵母(Kazachstania)与浓香型白酒中正丙醇的合成有关[17]。白酒发酵过程中,上层糟醅的产酒率要更高一些,同时3-甲基丁醇(异戊醇)和异丁醇的生成与乙醇发酵呈正相关关系,以酿酒酵母(Saccharomyces cerevisiae)为代表的酵母菌可以通过氨基酸合成代谢途径(Harris途径)和氨基酸分解代谢途径(Ehrlich途径)合成异戊醇[18-19],这可能是上层原酒中3-甲基丁醇(异戊醇)比中下层原酒高的原因。
白酒中的有机酸是重要的呈香呈味物质,适量的有机酸会使酒体更加协调,酸含量偏低,酒味寡淡,余味较短;酸含量高则酒体较粗糙[20]。酸类物质主要是微生物利用淀粉、蛋白质等物质通过一系列生化反应生成,它不仅可以助香、维持酯类物质合成平衡、改善白酒风味,同时还具有提升白酒健康成分的作用[10]。研究显示,在发酵结束时下层酒醅中的有机酸含量均比上、中层酒醅高[9,21]。下层原酒中己酸、丁酸、乙酸的含量分别为166.16 mg/L、127.06 mg/L、872.14 mg/L,是中层原酒的1.87倍、2.07倍、1.23倍;是上层原酒的2.56倍、3.60倍、1.34倍。WANG C D等[22]报道乳酸杆菌属的相对丰度随窖池深度增加而减小,梭菌属随窖池深度而增加。产甲烷古菌与梭状芽孢杆菌科微生物之间的协同关系和种间电子传递,可以促进梭菌科微生物的生长。研究表明,梭菌科微生物能将有机质转化为酸类物质,如丁酸和己酸[23]。同时由于黄水在发酵过程中不断自然下渗,也导致下层糟醅中酸类等物质的含量高于上层、中层。
其他类物质含量也随窖池深度增加而增加。乙缩醛具有奶酪香气,对白酒风味有积极的贡献作用;乙醛具有辛辣、醚样气味,稀释后具有果香、咖啡香、酒香、青香。在各醅层中含量呈递增的趋势。3-羟基-2-丁酮呈水果香、霉腐味和木香,在各醅层中含量分别为9.89 mg/L、14.03 mg/L、17.55 mg/L。它可由双乙酰还原得到,同时也有学者推测认为3-羟基-2-丁酮可以作为酒体风味物质的前体物质,与其他代谢物共同作用生成特殊特征风味物质,如可能生成四甲基吡嗪[24]。
2.3 主成分分析结果
通过PCA可初步了解样品组间和组内之间的相似性或差异度大小,不同空间位置原酒挥发性成分PCA结果见图4。
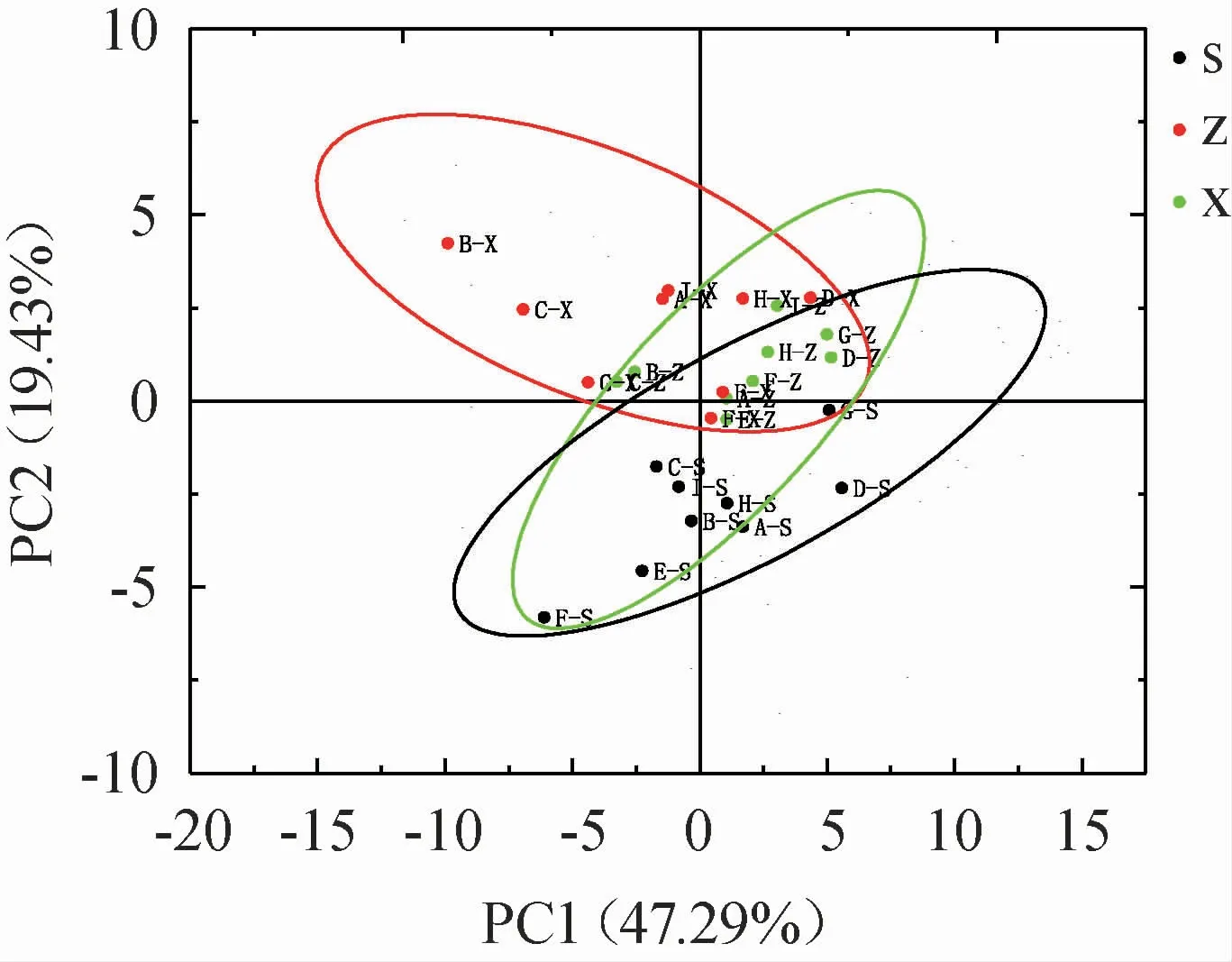
图4 不同空间位置原酒挥发性风味成分主成分得分图Fig.4 Principal component scores of volatile flavor components in original liquor at different spatial positions
由图4可知,上层原酒主要分布在横坐标以下,与中层、下层原酒样本组间分离趋势明显,这说明虽然三种不同空间位置原酒的风味物质种类以及数量较为一致,但含量方面存在明显差异。同时,从组内差异上来看,下层部分酒样与中层部分酒样位置也比较接近,结果与聚类分析较为一致。可能由于本次窖池的封窖方式采用的是不锈钢盖,在微生物的多样性以及含量上与传统封窖泥存在较大差异,并且中、下层酒醅接触氧气的机会最少,厌氧功能微生物代谢最强烈,并且黄水的不断沉积,导致中、下层原酒质量与上层原酒质量明显不同。由图2聚类热图与图4不同空间位置酒样PCA显示有部分样本较为接近,出现这一原因可能是,虽然9口窖池所采用的原辅料、生产工艺均是一致的,但是由于样本来自9口不同的窖池,可能受每个窖池酿酒性能的不同而导致出现这一情况。
2.4 不同醅层原酒挥发性成分正交偏最小二乘分析
2.4.1 上层原酒与中层原酒挥发性成分正交偏最小二乘分析为进一步探讨不同醅层原酒之间的差异化合物,将上层原酒与中层原酒风味物质数据进行OPLS-DA,结果见图5。判别模型中拟合优度R2和预测优度Q2分别表示在随机化Y变量模型下对数据的解释程度和对模型的预测能力,通过计算,本实验模型Y轴累积解释率R2Y=0.896,Q2=0.637,说明该模型拟合效果较好。
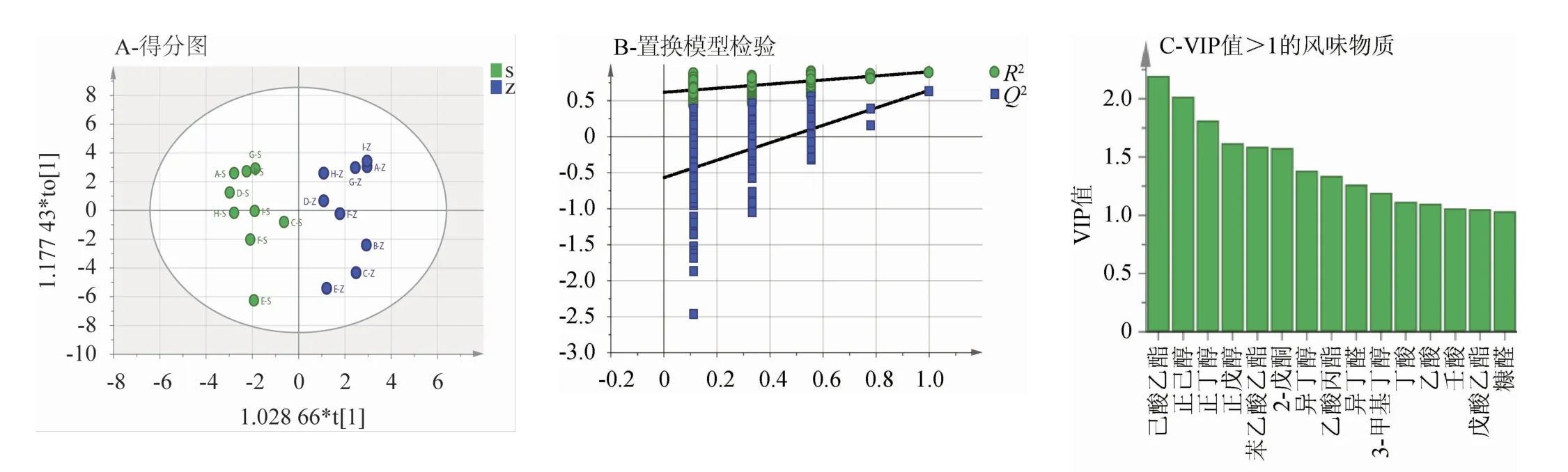
图5 上层与中层原酒挥发性风味成分OPLS-DA结果Fig.5 OPLS-DA results of volatile flavor components in the upper and middle layers of the original liquor
由图5A可知,上层原酒与中层原酒沿横坐标有明显区分,上层原酒分布在置信区间左侧,中层原酒分布在置信区间右侧,说明上层与中层原酒之间风味物质存在明显差异。同时,为验证该模型是否过度拟合数据,进行置换检验(n=200);由图5B可知,R2=0.623,Q2=-0.538,Q2<0表明此模型没有出现过拟合现象,模型预测能力良好[26]。变量重要性投影(variable importance in project,VIP)值可用于衡量各代谢物积累差异对各组样本分类判别的影响强度和解释能力,VIP≥1为常见的差异代谢物筛选标准[27];由图5C可知,共有15种风味物质VIP值>1,分别是己酸乙酯(2.20)、正己醇(2.02)、正丁醇(1.81)、正戊醇(1.62)、苯乙酸乙酯(1.59)、2-戊酮(1.58)、异丁醇(1.38)、乙酸丙酯(1.34)、异丁醛(1.26)、3-甲基丁醇(1.19)、丁酸(1.12)、乙酸(1.10)、壬酸(1.06)、戊酸乙酯(1.05)、糠醛(1.04)。
2.4.2 上层原酒与下层原酒挥发性成分正交偏最小二乘分析
将上层原酒与下层原酒风味物质数据进行OPLS-DA,结果见图6。判别模型中Y轴累积解释率R2Y=0.934,预测优度Q2=0.777,说明该模型拟合效果较好。
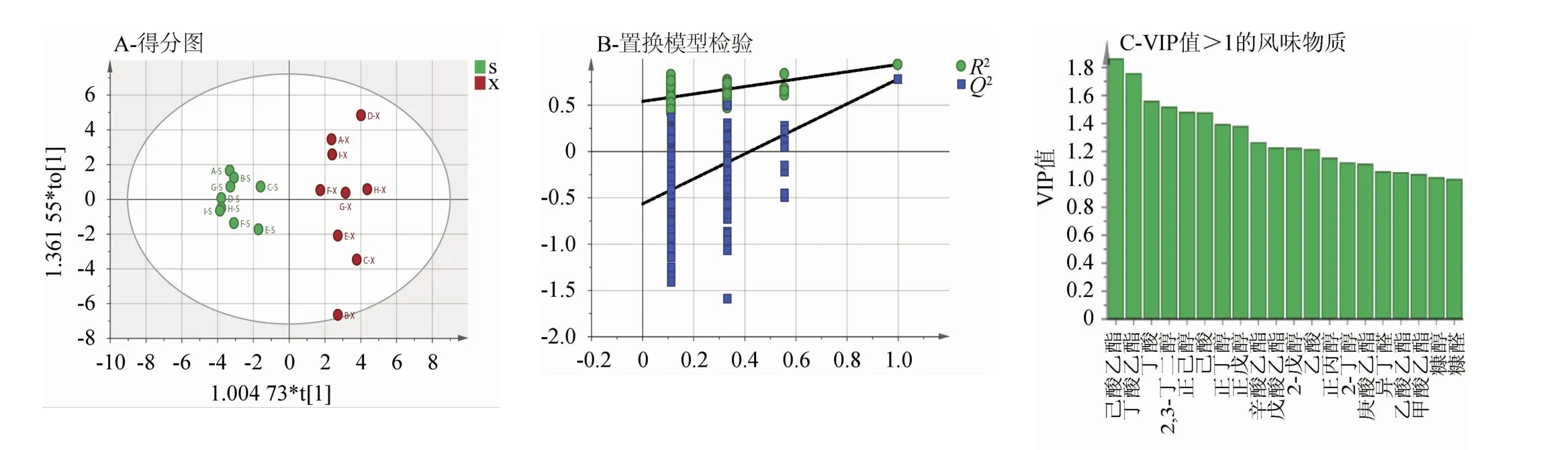
图6 上层与下层原酒挥发性成分OPLS-DA结果Fig.6 OPLS-DA result of volatile components in the upper and lower layers of the original liquor
由图6A可知,上层原酒与下层原酒沿横坐标有明显区分,上层原酒分布在置信区间左侧,下层原酒分布在置信区间右侧,说明上层与下层原酒之间风味物质存在明显差异。由图6B可知,拟合优度R2=0.539,Q2=-0.541,Q2<0表明此模型没有出现过拟合现象,模型预测能力良好。由图6C可知,共有20种风味物质VIP值>1,分别是己酸乙酯(1.87)、丁酸乙酯(1.76)、丁酸(1.56)、2,3-丁二醇(1.52)、正己醇(1.49)、己酸(1.48)、正丁醇(1.40)、正戊醇(1.38)、辛酸乙酯(1.27)、戊酸乙酯(1.23)、2-戊醇(1.23)、乙酸(1.22)、正丙醇(1.15)、2-丁醇(1.12)、庚酸乙酯(1.11)、异丁醛(1.06)、乙酸乙酯(1.05)、甲酸乙酯(1.04)、糠醇(1.02)、糠醛(1.01)。
2.4.3 中层原酒与下层原酒挥发性成分正交偏最小二乘分析将中层原酒与下层原酒风味物质数据进行OPLS-DA,结果见图7。判别模型中Y轴累积解释率R2Y=0.887,预测优度Q2=0.661,说明该模型拟合效果较好。
由图7A可知,中层原酒与下层原酒沿横坐标有明显区分,中层原酒分布在置信区间左侧,下层原酒分布在置信区间右侧,说明中层与下层原酒之间风味物质存在明显差异。由图7B可知,拟合优度R2=0.562,Q2=-0.578,Q2<0表明此模型没有出现过拟合现象,模型预测能力良好。由图7C可知,共有18种风味物质VIP值>1,分别是丁酸乙酯(1.73)、己酸(1.52)、2,3-丁二醇(1.51)、正己醇(1.47)、2-戊醇(1.44)、正丙醇(1.41)、庚酸乙酯(1.40)、己酸乙酯(1.32)、丁酸(1.31)、正丁醇(1.31)、乙醛(1.30)、乙酸乙酯(1.28)、壬酸(1.26)、辛酸乙酯(1.20)、月桂酸乙酯(1.18)、2-丁醇(1.16)、乙酸(1.10)、戊酸乙酯(1.08)。
2.5 不同空间位置原酒差异化合物分析
将不同空间位置原酒之间的差异物质作维恩分析,结果见图8。由图8可知,共得到28种具有代表性的差异风味物质,上层与中层共有15种差异风味物质;上层与下层共有20种差异风味物质;中层与下层共有18种差异风味物质;上、中、下层共有6种差异风味物质,分别为己酸乙酯、戊酸乙酯、正己醇、正丁醇、丁酸、乙酸。这些差异风味物质共同造成了不同空间位置原酒之间风格与口感特点的差异。

图8 不同空间位置原酒差异挥发性风味成分维恩分析Fig.8 Venn analysis of difference volatile flavor components in original liquor at different spatial positions
3 结论
本研究对不同空间位置原酒理化指标及风味物质进行检测,应用GC-MS结合多元统计分析方法对各原酒之间的风味物质进行分析。结果显示,不同空间位置原酒之间总酸、总酯含量随着窖池深度不断增加,三者存在显著差异(P<0.05)。PCA结果显示,上层原酒与中、下层原酒组间分离趋势明显。OPLS-DA与Venn分析显示,不同空间位置原酒中共得到28种具有代表性的差异风味物质,其中己酸乙酯、戊酸乙酯、正己醇、正丁醇、丁酸、乙酸为上、中、下层原酒共有的6种差异风味物质,并且含量随窖池深度逐层递增,而3-甲基丁醇则呈相反趋势。由于浓香型原酒的风味受诸多因素的影响,比如生产的原辅料、酿造工艺、微生物等。因此,后续还需要对不同空间位置的糟醅、窖泥、原酒进行关联分析,探寻三者之间的联系,为提高浓香型原酒的品质提供更多参考依据。

