紫草阳和汤外治联合激素治疗肿块期肉芽肿性乳腺炎的临床疗效及对细胞焦亡蛋白的影响
穆玉晶,汪唐顺,冯 雪,孙 萍,高 爽,王玉坤,左禧萌,朱彦彦,马 燕,史晓光
(北京中医药大学东直门医院普外科,北京 100007)
肉芽肿性小叶性乳腺炎(granulomatous lobular mastitis,GLM)是一种以乳腺小叶为中心、非干酪样坏死性肉芽肿为主要病理特征的慢性炎症性疾病[1]。临床表现为乳房局部疼痛性肿块,进展迅速,脓成后形成窦道,可伴见下肢结节性红斑等症状。其发病过程常经历肿块期、成脓期、溃破期、窦道期四期,病程长,迁延难愈[2]。据报道GLM 发病与高泌乳素血症、感染及外伤等相关[3]。近年来其发病率猛增,给我国女性健康及生活质量带来严重影响。目前GLM 治疗方式多种,但治疗手段尚缺乏统一规范。如激素治疗可以暂时性缩小肿块范围,缓解红肿疼痛症状,却无法根治该病且伴有库欣综合征等多种并发症,且在GLM 形成脓肿时会加重病情;而手术切除则存在乳房美观度缺失、术后无法哺乳等局限性,故仍需寻找更合理有效的治疗方式。中医药具有副作用小、降低乳房损毁范围等优点[4],故从现有中医药宝库中寻求合适药物治疗GLM 具有巨大的临床潜力。
其中,中医外治法历史悠久,相关研究报道中药外用在病灶局部可以达到减轻感染、控制炎症、消除水肿、促进愈合等作用[5]。《医学源流》也有“外科之法,最重外治”之说[6]。GLM 中医病机认为其肿块可由于先天不足,阳虚湿困致气滞血瘀,加之外邪侵袭致寒痰凝滞、气血瘀阻凝结成块而发病[7]。紫草阳和汤是在“阳和汤”基础上加减而成,具有温化痰湿,通畅气血,达到散结通乳之效,扶正祛邪,标本兼治。导师基于该理论运用紫草阳和汤外敷治疗肿块期GLM,后配合手术治疗,降低了患者乳房形毁率,且并发症少,疗效确切,具有较高临床研究价值。本研究运用紫草阳和汤联合地塞米松软膏外敷对40 例GLM 肿块期患者进行临床疗效观察及相关机制探究,旨在明确紫草阳和汤外敷对GLM 术前缩瘤降期等相关临床效果和机制。现报道如下。
1 资料与方法
1.1 研究对象及分组
按照纳排标准选择东直门医院2022 年4 月~2023 年4 月诊断为肿块期GLM 的女性住院患者;照随机数字表法分组,对照组和观察组各20 例。本研究已通过伦理委员会审核批准,且入组对象均已签署知情同意书。
1.2 病例选择标准
1.2.1 诊断标准 (1)西医诊断标准:依据《非产褥期乳腺炎的诊断和治疗指南(2021 年)》、《肉芽肿性小叶性乳腺炎诊治湖南专家共识(2021 年)》等建立本病参考要点,具体如下:(1)多为育龄期经产女性。(2)短期内出现疼痛性肿块,进展迅速,脓成不畅,易侵皮肤,后形成窦道,易反复发作,可伴见下肢红斑、发热等乳腺外表现。(3)超声可见低无回声病灶,可表现为边界不清、形态不规则。4)病理表现:以乳腺小叶为中心的非干酪样坏死性肉芽肿形成,伴有炎症细胞浸润,可见微脓肿和脂肪坏死。
(2)中医诊断标准:中医分期与分型标准参照2017 年版《中医病症诊断疗效标准》[8]中粉刺性乳痈章节并结合东直门医院乳腺外科临床经验制定。具体如下:
肿块期:乳房肿块,质地较硬,边界不清,直径一般<5 cm,伴或不伴疼痛,伴或不伴腋窝淋巴结肿大,无脓肿形成,不合并其他全身性表现。
阳虚寒凝型:(1)主证:①肿块漫肿,触诊疼痛或有压痛;②肿块质韧或硬,形态不规则,边界模糊欠清,表面粗糙不光滑,活动度差;③患处皮肤不红或微红,局部肤温正常或稍高;(2)次证:①口中不渴;②平素怕冷;③四肢不温;④乳头凹陷;⑤舌淡苔白,脉沉细或迟细。辨证标准:具3项主症(或2项主症+2项次症)者。
1.2.2 纳 入 标 准 (1)年 龄18~55 岁;(2)符 合GLM 诊断标准者;(3)入组前无激素和(或)中药口服及外敷等治疗;(4)患者知情同意并签署知情同意书。
1.2.3 排除标准 (1)合并恶性肿瘤、其他炎症性及内分泌疾病;(2)同时具有明显心肺肝肾、神经及血液系统功能障碍者(3)妊娠期、哺乳期及备孕期妇女;(4)易过敏体质或对治疗药物或其成分过敏者;(5)同时参与其他临床药物试验者。
1.2.4 病例脱落标准及中止标准 (1)要求撤回知情同意,无法继续进行实验者;(2)患者依从性差,用药未达规定剂量的80%或超规定剂量的120%者。(3)要求退出本试验者;(4)试验过程发生严重安全性问题者;(5)试验方案存在重大失误导致药物效应难以评价。
1.3 治疗方案
1.3.1 治疗药物 治疗药物:地塞米松软膏(国药准字H44024170,华润三九医药有限公司)。紫草阳和汤(颗粒制剂):紫草10 g,生地10 g,熟地10 g,鹿角胶10 g,炮姜 10 g,浙贝母15 g,皂角刺15 g,白芥子10 g,路路通15 g,夏枯草15 g,生甘草6 g,麻黄3 g,肉桂3 g。该方药为由北京康仁堂药业有限公司制备。
1.3.2 检测试剂及仪器 实验试剂:caspase-1、GSDMD、IL-18、IL-1β、NLRP3、GAPDH 兔 一 抗(SA00001-2,proteintech, 中国)、10% SDS-PAGE凝胶试剂盒(雅酶,中国)、5×上样缓冲液(索莱宝,中国)等。
实验仪器:手握式超声波细胞裂解仪(Hielscher, 德国)、酶联免疫检测仪(ThermoFisher, 美国)、化学发光成像仪(上海天能科技有限公司,中国)。
1.3.3 治疗方法 观察组:地塞米松软膏基础上加用紫草阳和汤外敷于乳腺患处,边界大于肿块范围1 cm,厚度1 cm;每日2 次,每次3 h;对照组:应用地塞米松软膏外敷,均匀涂抹于乳腺患处,边界大于肿块范围1 cm,厚度1 cm,外层覆盖纱布;每日2次,每次3 h;两组在上述辅助治疗4 周后根据病灶范围序贯手术治疗,手术方式以乳房象限切除术为主。
1.4 观察指标及评价标准
观察两组治疗前后肿块体积、切除组织量占比、临床获益率、客观缓解率、肿块成脓率、乳房疼痛程度、不良反应(恶心、呕吐、皮疹等)发生率及治疗后细胞焦亡相关指标表达水平。
1.4.1 肿块体积与切除组织占比 乳房体积及肿块体积由乳腺超声测量获得,超声测量乳腺组织每个切面面积,切面间隔1 cm,每切面面积与1 cm 相乘得每一层体积,各层体积之和为乳房体积[9];肿块体积(cm3)=(长度×宽度×厚度)/2,取3 次平均值[10];切除组织量由盛生理盐水的烧杯测量;切除组织量占比(%)=切除组织量(cm3)/乳房体积(cm3)×100%[11]。
1.4.2 临床获益率与客观缓解率 参考改良的RECIST1.1[12]标准对客观缓解率与临床获益率进行疗效评价。
1.4.3 乳房疼痛与肿块成脓率 根据VAS 评分标准判定乳房疼痛程度,总分为10 分,患者疼痛程度越严重评分越高;以乳腺超声下可见肿块内液性暗区为成脓标准,肿块成脓率(%)=肿块成脓患者(人)/该组患者总数(人)×100%。
1.4.4 组织病理学及免疫组织化学检测 福尔马林固定组织,酒精脱水后石蜡包埋,5 μm 切片后脱蜡复水,采用苏木精-伊红染色法(Hematoxylin -eosinstaining, HE)染色及ER、PR 免疫组织化学染色,使用Prism.8 软件定量分析ER、PR 相关表达。
1.4.5 细胞焦亡相关蛋白检测 细胞焦亡相关蛋白检测可参考赵泽等[4]实验检测过程。
1.5 统计学处理
采用SPSS25.0 软件进行统计分析。计量资料采用t检验,计数资料采用χ2检验,P<0.05 表示差异有统计学意义。
2 结果
2.1 两组患者基线资料比较
经4 周治疗后,40 例患者均接受手术治疗并完成随访,观察组20 例,对照组20 例。本研究纳入患者年龄在23~55(35±7)岁,中位年龄33 岁。肿块平均直径(4.1±1.9) cm。病程1.3~36 个月,中位病程4 个月,平均病程5.2 个月。既往哺乳期乳腺炎病史2 例(5%),桥本氏甲状腺病及甲状腺功能减退病史4 例(10%)。其中未孕患者2 例(5%),已育患者28 例(95%)。随机平均分为两组,观察组和对照组两组各20 例。两组患者从年龄、病程及肿块体积等方面比较,未见明显差异(P>0.05),具体见表1。
表1 两组患者一般资料表(n=20,±s)Tab 1 General data of the two groups of patients(n=20,±s)
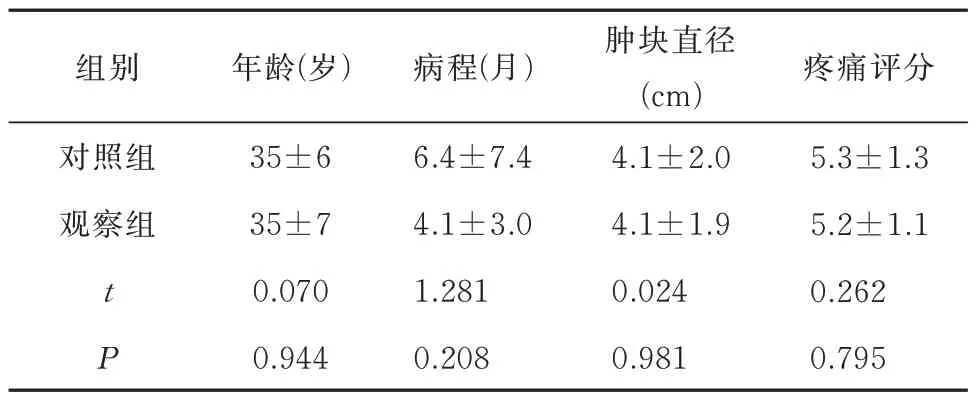
表1 两组患者一般资料表(n=20,±s)Tab 1 General data of the two groups of patients(n=20,±s)
组别年龄(岁)病程(月)疼痛评分对照组观察组t P 35±6 35±7 0.070 0.944 6.4±7.4 4.1±3.0 1.281 0.208肿块直径(cm)4.1±2.0 4.1±1.9 0.024 0.981 5.3±1.3 5.2±1.1 0.262 0.795
2.2 两组患者肿块体积变化与组织切除占比
两组患者在治疗4 周后,乳房肿块体积均有缩小,且观察组患者病灶肿块缩小前后体积差值明显大于对照组(P>0.05)。但两组间切除组织量占比未见明显差异(P<0.05)。结果表明,紫草阳和汤配合地塞米松软膏外敷能有效缩小GLM 肿块体积,但尚不能说明可以降低患者切除组织量占比,具体见表2。
表2 两组患者乳房肿块体积变化效果比较(n=20,±s)Tab 2 Comparison of the effect of breast mass volume change between the two groups(n=20,±s)

表2 两组患者乳房肿块体积变化效果比较(n=20,±s)Tab 2 Comparison of the effect of breast mass volume change between the two groups(n=20,±s)
注:与对照组比较,#P<0.05。
切除组织量占比(%)10.1±6.6 9.4±7.2组别切除组织量(cm3)乳房体积(cm3)对照组观察组治疗前肿块体积(cm3)32.3±48.2 42.8±36.1治疗后肿块体积(cm3)15.5±28.8 9.9±10.2治疗前后肿块体积差(cm3)16.7±21.5#32.9±27.4 32.2±30.6 28.7±23.2 295.5±50.0 293.4±22.5
2.3 两组患者治疗前后临床获益率与客观缓解率
采取不同治疗方案对两组患者分别进行4 周治疗后均获得较高的临床获益率及客观缓解率,其中在客观缓解率方面,观察组较对照组有显著优势,两组间差异有统计学意义(P<0.05)。但两组间临床获益率未见统计学差异(P>0.05)。两组患者乳房肿块的临床获益率和客观缓解率具体见表3。
表3 两组患者治疗4 周后临床疗效评估比较(n=20,±s)Tab 3 Comparison of clinical efficacy evaluation between the two groups after 4 weeks of treatment(n=20,±s)
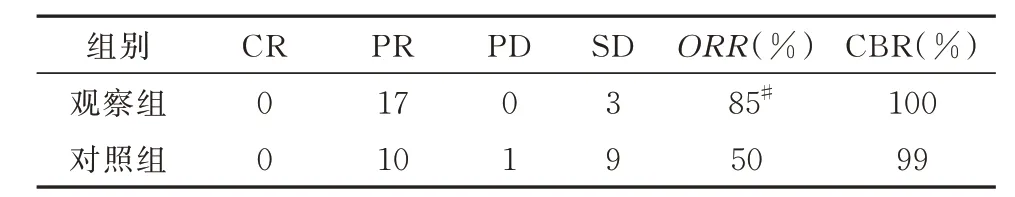
表3 两组患者治疗4 周后临床疗效评估比较(n=20,±s)Tab 3 Comparison of clinical efficacy evaluation between the two groups after 4 weeks of treatment(n=20,±s)
注:与对照组比较,#P<0.05。
组别CBR(%)CR PD SD PR ORR(%)观察组对照组100 99 0 0 17 10 0 1 3 9 85#50
2.4 两组患者成脓率与疼痛情况
两组在治疗前疼痛评分对比,观察组为(5.3±1.3),对照组为(5.2±1.1),治疗28 d 后,观察组疼痛评分为(0.5±0.5),对照组评分为(0.7±0.6),4 周治疗后两组患者疼痛程度没有明显差异(P>0.05),但在治疗进行至第2~3 周时,观察组患者局部疼痛程度明显低于对照组(P<0.05),具体见表4;此外,观察组有4 人成脓,成脓率为20%,对照组有6 人成脓,成脓率为30%,但两组差异未见统计学意义(P>0.05)。结果提示,紫草阳和汤外敷联合地塞米松软膏在治疗中期能有效减轻肿块期GLM 皮肤局部疼痛程度,但尚不能认为可以缓解肿块期向成脓期进展。
表4 两组患者治疗前后疼痛程度与成脓情况(n=20,±s)Tab 4 Pain degree and pus formation before and after treatment in two groups(n=20,±s)

表4 两组患者治疗前后疼痛程度与成脓情况(n=20,±s)Tab 4 Pain degree and pus formation before and after treatment in two groups(n=20,±s)
注:与对照组比较,#P<0.05。
组别对照组观察组治疗前治疗1 周治疗2 周治疗3 周治疗4 周成脓5.3±1.3 4.1±1.0 2.8±1.1#1.9±0.7#0.7±0.6 1.5±0.6 5.2±1.1 4.0±0.8 2.1±0.9 0.5±0.5数 4 6成脓率(%)20 30
2.5 不良反应发生率
治疗期间观察组发生1 例皮疹,不良反应发生率5%;对照组发生1 例腹泻、1 例皮疹,不良反应发生率10%,差异无统计学意义(P>0.05)。
2.6 两组患者乳腺组织病理组织学比较
2.6.1 两组患者乳腺组织HE 染色形态学观察 对治疗后的两组患者乳腺组织进行HE 染色形态学观察,可以看到两组患者乳腺组织中乳腺导管结构和乳腺小叶结构清晰可见,周围可见脓肿,伴见脂质空泡,脓肿内主要成分为多核巨细胞,两组均可见不同程度嗜酸性粒细胞、淋巴细胞等炎症细胞浸润;观察组可见脓肿边界清晰,范围较小(图1A,C),脓肿外较对照组炎症细胞浸润较少(图1B,D)。
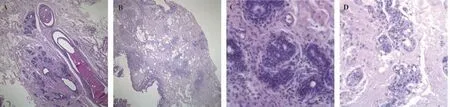
图1 两组患者治疗后乳腺组织病理形态图(HE,×40)Fig 1 Breast histopathologic morphologies of the two groups after treatment (HE,×40)
2.6.2 两组患者乳腺组织免疫组化比较 与对照组相比,观察组患者乳腺组织中caspase-1、GSDMD蛋白表达水平明显降低,棕黄色阳性染色面积更少,且两组间caspase-1 及GSDMD 蛋白表达差异均具有统计学意义(P<0.05),见图2、3。
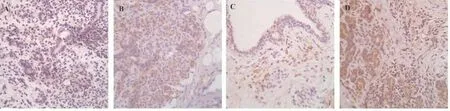
图2 两组患者治疗后乳腺病灶组织caspase-1、GSDMD 免疫组化图像(HE, ×400)Fig 2 Immunohistochemical images of caspase-1 and GSDMD in breast tissue of patients in two groups after treatment(HE, ×400)
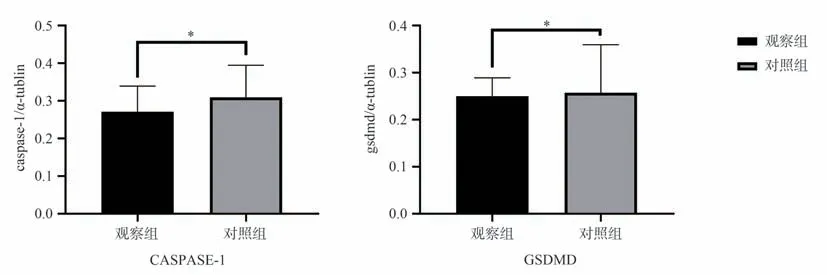
图3 两组患者乳腺caspase-1、GSDMD 表达比较(×400)Fig 3 Comparison of breast caspase-1 and GSDMD expression between the two groups (×400)
2.7 两组患者细胞焦亡相关蛋白比较
两组患者的IL-1β、IL-18 组间表达可见明显差异(P<0.05);此外,较对照组而言,观察组患者的GSDMD、caspase-1、NLRP3 表达也有明显降低,差异有统计学意义(P<0.05)。结果见表5、图4。
表5 两组患者乳腺组织细胞焦亡表达情况(n=40,±s)Tab 5 Expression of scorched cell death in breast tissue of two groups of patients (n=40,±s)

表5 两组患者乳腺组织细胞焦亡表达情况(n=40,±s)Tab 5 Expression of scorched cell death in breast tissue of two groups of patients (n=40,±s)
注:与对照组比较,#P<0.05。
组别NLRP3 IL-18 caspase-1 GSDMD IL-1β观察组对照组0.768±0.810#0.260±0.328#0.241±0.170#0.378±0.355#0.538±0.501#1.207±1.149 1.545 ±1.421 0.781±1.015 1.075±0.800 0.992±0.780
3 讨论
近年来,肉芽肿性小叶性乳腺炎的发病率明显上升[13]。迄今为止该疾病的发病机制仍未明晰[14,15]。病程长、复发率高等问题也使该病成为临床关注的焦点和挑战[16]。目前本病治疗手段较多,但尚未制定系统的治疗标准。常见治疗方法包括手术治疗、激素治疗及抗生素治疗等[17],其中手术是首选治疗方法[18],但手术治疗会对乳腺外形造成破坏,影响美观度及乳腺功能;通过类固醇激素治疗GLM 是由Donn 等[18]在1994 年首次提出,该治疗方式可以缩小肿块并使其局限,可有效缩短治疗周期。当前,国内亦有多数声音支持激素配合手术治疗,该方式不但可以缩小切除病灶范围从而维持较满意的乳房外观,还可减少复发[19]。但激素在GLM 进展至脓肿期时或可加重病情,且长时间应用可能会引起皮疹、库欣综合征及高血糖等不良反应,故其应用受到时间剂量等限制[20]。对于单纯性肿块期GLM,我科采用激素结合中医外治法综合治疗,以期在术前缩小肿块范围并减少激素带来的不良反应。中医强调整体与局部辨证相结合,内外结合,标本兼治,中医外治法多种多样,迄今为止,已在临床中积累了丰富的经验。赵莉萍等[21]多根据GLM 病程在脓成后采用切开外治法引邪外出,并用提脓祛腐之药煨之,后配合区段切除术。马巧玲治疗GLM 以青敷膏外敷、刮匙搔刮窦道等中医外治法为主,并兼以中药内服,大大提高了该病治愈率[22];林毅创立了“提脓祛腐”综合疗法,其中,中医外治法包括火针洞式烙口术、提脓药捻引流术及四子散热敷等多种方法[23];刘胜依据GLM 不同阶段(脓成期、溃后期、瘢痕期)的临床特点采用不同的中医外治治疗,脓成期用火针以热引热,开门逐寇;溃后期腐肉不脱、肉芽高凸多用火针温通经络,祛腐生肌[24]。而近代医家张山雷在《疡科纲要》云“疡科辩证,首重阴阳”,亦认为阴阳无谬,治焉有差,将乳腺炎性疾病归属于中医疡科,急性乳腺炎属于阳证,慢性者属于阴证[25]。导师理论认为GLM 肿块皮色不变,皮温不高,属阴证,阴证疮疡应采用温通和阳之法,忌苦寒过重,故多采用紫草阳和汤加减治疗GLM。
本研究中观察组GLM 患者在地塞米松软膏外用的基础上联合中药方剂紫草阳和汤外敷。紫草阳和汤方以阳和汤为基础方,该方始见于《外科证治全生集》,清代名家王洪绪专为阴证创立此方,方中有鹿角胶、肉桂、炮姜用以温阳,白茶子温化寒痰即消瘤,孰地以滋阴避免温热药伤阴之弊。原方以熟地一两配麻黄五分,既不发汗又能化瘤痕肿块,而紫草阳和汤又在此方基础上加紫草等凉血解毒之剂,可以起到温阳祛除阴凝寒痰,畅通气血,散结通乳之效,从而有效抑制GLM 肿块期进展。现代药理研究证实,阳和汤具有激素样作用,并可减轻炎性反应、改善免疫功能、抗菌并调节性腺功能[26,27]。而紫草提取物则被证实可以调整巨噬细胞吞噬功能、抑制脂多糖诱导的炎症及自身免疫,降低泌乳素,后期通过抑制纤维母细胞防止纤维化及瘢痕形成[28]。本研究中观察组治疗后病灶范围缩小差值明显大于对照组,且总体客观缓解率达85%,这考虑与中西医结合治疗发挥的协同作用有关,合理运用激素联合紫草阳和汤外敷治疗可缩小肿块范围。值得注意的是,两组间在组织切除量占比方面未见明显统计学差异,考虑其原因发现两组皆采用乳腺区段切除术,术中会在切除病灶范围的基础上探查病变导管及小病灶并做切除,故与超声检测的病灶范围存在一定差异;GLM 典型临床症状为乳房出现肿块,伴红肿、疼痛,局部皮色变红,皮温升高,或局部皮肤破溃。本研究结果显示,观察组治疗第二、三周时乳房肿块疼痛评分明显较对照组低,提示中医紫草阳和汤外敷相较单纯激素治疗,在减轻GLM 肿块期的疼痛症状上具有明显优势,在成脓率方面,两组间未见统计学差异,虽不能有效证实联合用药可以抑制病情向成脓期进展,但已有研究证实中医药外治对于该病脓液渗出量有明显降低作用[10]。同时,在研究后期,糖皮质激素的不良反应逐渐显现,如患者出现局部皮疹,故在使用地塞米松治疗期间应严密观察,及时处理相关不良反应。
本实验结果显示紫草阳和汤外敷联合地塞米松治疗能降低GLM 患者组织中的IL-18 及IL-1β 水平,使病灶组织炎症局限化,具有明显抗炎作用。Caspase-1/GSDMD 信号通路作为细胞焦亡的经典信号通路,其主要过程为上调的NLRP3 与斑点样蛋白(ASC)结合进而活化Caspase-1 前体,活化后的Caspase-1 通过剪切GSDMD 形成含有Gasde rmin D 氮端活性域的肽段,使细胞膜穿孔水解,最终导致细胞内容物大量释放形成细胞焦亡[29,30];此外,活 化 的Caspase-1 也 会 介 导IL-1β 及IL-18 成 熟并使之释放到胞外,募集炎症细胞聚集,促使炎症反应扩大[31]。上述过程在临床中则可表现为迅速扩散的炎症反应,这也符合GLM 肿块突发并短期破溃的临床特点。Zuo 等[32]发现GLM 病变组织的焦亡通路中Caspase-1、GSDMD 和IL-18 等水平明显增高,证实细胞焦亡在GLM 病理中的作用。本研究在此基础上发现,联合治疗组中的Caspase-1、NLRP3、GSDMD、IL-18 及IL-1β 等细胞焦亡经典通路指标均不同程度下降,这说明地塞米松软膏联合紫草阳和汤外敷治疗GLM 的作用机制可能是通过下调NLRP3 表达及Caspase-1 的活化,抑制GSDMD 表达及IL-1β、IL-18 等炎性因子的释放,证明地塞米松软膏联合紫草阳和汤外敷在一定程度上可抑制肿块期GLM 组织内细胞焦亡从而起到治疗肿块期GLM 的作用。
本研究旨在观察比较紫草阳和汤外敷联合激素治疗与单独激素治疗的临床疗效及实验机制,探讨联合用药的临床应用价值,为肿块期GLM 提供最佳治疗方案。综上所述,应用紫草阳和汤外敷联合激素治疗肿块型GLM 安全有效,可以提高肿块期GLM 的临床疗效,值得临床推广应用。同时,本研究尚存在以下不足:(1)NLRP3/Caspase-1 /GSDMD/IL-1β 通路是细胞焦亡的经典途径,而紫草阳和汤外敷联合激素治疗GLM 的机制与细胞焦亡的非经典途径是否相关还需要进一步实验验证。(2)本研究中未观察紫草阳和汤外敷联合地塞米松软膏对肿块期GLM 的远期疗效如复发率及完全缓解率等,因本课题研究周期相对较短,故未来研究将延长治疗周期做进一步观察。
作者贡献度说明:
穆玉晶;研究设计,进行数提取与数据据分及撰写;汪唐顺:进行数提取与数据据分及撰写,审校;孙萍,高爽,王玉坤:进行病例收集;左禧萌:进行病例组织留取;朱彦彦:审校;马燕,史晓光:进行数整理;冯雪:研究设计。
所有作者声明不存在利益冲突关系。

