miR-129-5p 靶向HMGB1 对胰腺癌细胞凋亡的作用研究
王语阳,苏拾香,覃宗帅,岑兰英,黄秀权,黄桂香,徐 键,覃月秋
(1.右江民族医学院附属医院消化内科,广西 百色 533000;2.右江民族医学院研究生院,广西 百色 533000)
胰腺癌(pancreatic cancer,PC)是消化系统常见的恶性肿瘤,早期诊断困难,病死率高[1]。研究表明,细胞凋亡与胰腺癌发生、发展、预后等密切相关,但相关机制尚不清楚[1]。高迁移率族蛋白B1(high mobility group protein B1,HMGB1)是一个高度保守的核蛋白,属于非组蛋白染色质相关蛋白。它于1973 年从小鼠胸腺染色质中首次提取,并因其在凝胶电泳中的高流动性而得名。研究发现HMGB1 在胰腺癌组织中表达水平升高,且已被证实通过增加细胞自噬、抑制细胞凋亡和调节线粒体功能参与胰腺癌的发生和发展[2-4]。通过抑制HMGB1 蛋白表达,可以促进Bax 蛋白的表达,抑制Bcl-2 蛋 白 表 达,从 而 促 进 胰 腺 癌 细 胞 的 凋 亡[5,6]。miR-129-5p 属于一个保守的microRNA 家族,是与细胞增殖、凋亡、侵袭、迁移和耐药性等多种生物学过程的相关的小分子RNA[7-10],研究发现在胰腺癌组织中miR-129-5p 表达下调,且与细胞增殖、凋亡、迁移、预后相关[11,12]。生物信息学分析及文献报道表明,miR-129-5p 与HMGB1 具有靶向调控关系[13],但其对胰腺癌细胞凋亡的影响尚不明确,为此,本文拟探讨miR-129-5p 调控HMGB1 表达对胰腺癌细胞凋亡的作用,为寻找新的胰腺癌治疗靶点提供理论依据。
1 材料和方法
1.1 材料
1.1.1 细胞株 人胰腺癌细胞株SW1990 购自澳睿赛生物技术(上海)有限公司。
1.1.2 主要试剂 特级胎牛血清购自武汉普诺赛生命科技有限公司,DMEM、PBS、Bcl-2、10×SDSPAGE 电泳缓冲液、10×Tris-Glycine 转膜缓冲液、PAGE 凝胶快速制备试剂盒购自武汉赛维尔生物科技有限公司,Hoechst 染色试剂盒、QuickBlock Western 快速封闭液、彩虹Marker 购自上海碧云天生物技术有限公司,RIPA 裂解液购自英文特生物技术(北京)有限公司,胰蛋白酶-EDTA 消化液、青链霉素混合液、20×TBST、PMSF、蛋白磷酸化酶抑制剂购自北京索莱宝科技有限公司,HMGB1、Caspase 3、β-actin、山羊抗兔免疫球蛋白(H+L)HRP、山羊抗小鼠IgG(H+L)HRP 购自江苏亲科生物研究中心有限公司,质粒购自上海吉玛制药技术有限公司,Lipofectamine3000 转染试剂、Trizol 购自上海赛默飞世尔科技(中国)有限公司,PVDF 膜购自美国Millpore 公司,opti-MEM 培养基购自Gibco 公司。超敏ECL 化学发光试剂盒购自莫纳(苏州)生物科技有限公司,miRNA 逆转录试剂盒、SYBR Master Mix 购自南京诺唯赞生物科技股份有限公司。qRT-PCR 引物购自广州易锦生物技术有限公司。
1.2 方法
1.2.1 细胞培养和转染 将胰腺癌SW1990 细胞培养于DMEM 完全培养基(内含10%胎牛血清及双抗)中,将其置于37 ℃、5% CO2细胞培养箱,当细胞汇合度达80%~90%时进行后续实验。
将处于对数生长期的SW1990 细胞按2×105个/孔接种于6 孔板中。细胞转染按照脂质体Lipofectamine3000 试剂说明书进行,以未处理的胰腺癌SW1990 细胞作为对照组(Control 组),用脂质体转染法将mimics-NC(空载体)、miR-129-5p mimics、inhibitor-NC(空载体)、miR-129-5p inhibitor 分别转染SW1990 细胞作为mimics-NC 组、miR-129-5p 过表达组(miR-129-5p mimics 组)、inhibitor-NC 组、miR-129-5p 低表达组(miR-129-5p inhibitor 组)。将各组待转染脂质体和Lipofectamine3000 分别用OPTI-MEM 无血清培养基稀释后静置10 min,再将两者混匀静置10 min,加入各孔细胞中,在各孔中加入1.7 mL OPTI-MEM 无血培养基继续培养8 h 后,更换为完全培养基培养用于后续实验。
1.2.2 miR-129-5p 靶基因预测 通过在线靶基因预测网站Target genes(http://www.targetscan.org/vert_71/)预测miR-129-5p 与HMGB1 的结合位点。
1.2.3 双荧光素酶报告基因检测实验 构建LT-h-HMGB1-3UTR-wt、LT-h-HMGB1-3UTR-mut 质粒(汉恒上海),通过Lipofectamine3000 转染试剂分别将LT-h-HMGB1-3UTR-wt 和LT-h-HMGB1-3UTR-mut 分别与miR-129-5p mimics 和miR-129-5p-NC 共转染至293T 细胞,转染48 h 后检测各组细胞的荧光素酶活性,各组实验重复3 次。
1.2.4 qRT-PCR 检测 将各组细胞根据不同目的基因转染24 h 后,用Trizol 提取各组细胞总RNA,使用诺唯赞miRNA 逆转录试剂盒合成cDNA,其中miR-129-5p 的内参为U6,RT-qPCR 的反应条件为:预变性95 ℃ 300 s,变性95 ℃ 15 s,退火/延伸60 ℃30 s,40 个循环。结果使用2-ΔΔCt法分析,各组实验重复3 次。引物见表1。

表1 RT-qPCR 引物序列Tab 1 RT-qPCR primer sequences
1.2.5 Western blot 实验 取转染48 h 后各组SW1990 细胞,用预冷的PBS 洗涤3 次,加人100 μL RIPA Lysis Buffer(含PMSF、蛋白磷酸化酶抑制剂),置于冰上充分裂解后置于高速低温离心机中12 000 r/min 离心20 min,取上清液置于新的EP 管中,按BCA 法检测蛋白浓度。用12.5% SDSPAGE 聚丙烯酰胺凝胶电泳进行蛋白分离,浓缩胶80 V,30 min,分离胶120 V,90 min,置于冰上250 mA 恒 流转膜1 h 转至0.45 μm PVDF 膜 上,Quick-Block Western 封闭液封闭1 h。TBST 洗膜3 次后,分别加入稀释后的兔抗人HMGB1 抗体(1∶1 000)、兔抗人Caspase3 抗体(1∶1 000)、鼠抗人Bcl-2 抗体(1∶1 000)、兔抗人β-actin 抗体(1∶5 000),4 ℃孵育过夜,再用稀释后羊抗兔IgG-HRP(1∶6 000)、羊抗鼠IgG-HRP(1∶6 000)二抗室温孵育2 h。按照ECL显影试剂盒说明,用美国伯乐公司凝胶扫描分析系统检测和成像,用Image J 软件进行灰度值分析。目的蛋白相对表达水平=目的蛋白灰度值/β-actin 灰度值。各组实验重复3 次。
1.2.6 Hoechst 染色 将对数期SW1990 细胞以2×105个细胞/孔种于6 孔板中,置于37 ℃,5% CO2细胞培养箱中培养过夜。吸尽培养液,PBS 洗3 遍,加入0.5 mL 固定液,固定10 min。去固定液,置于摇床上用PBS 洗两遍,吸尽液体。置于摇床上加入0.5 mL Hoechst 33258 染色液,避光孵育5 min。弃染色液,用PBS 洗两遍,吸尽液体。用荧光显微镜下观察细胞凋亡并拍照记录,各组实验重复3 次。
1.3 统计学处理
采用 SPSS23.0 统计软件,计量数据用均数±标准差表示,细胞转染后多组计量资料间的比较采用单因素方差分析及LSD-t检验。以P<0.05 表示差异有统计学意义。
2 结果
2.1 miR-129-5p 与HMGB1 存在靶向互作的关系
靶基因预测网站Target genes 结果显示,miR-129-5p 与HMGB1 的3'-UTR 结构域有结合区域,见图1。

图1 miR-129-5p 与HMGB1-3' UTR 靶位点结合示意图Fig 1 The binding diagram of miR-129-5p and HMGB1-3'UTR target site
2.2 双荧光素酶报告基因检测实验验证miR-129-5p 与HMGB1 的 靶向关系
转染野生型HMGB1 基因表达载体WTHMGB1 后,与NC mimics 对照组相比,miR-129-5p-3' UTR-WT 的luciferase 的 表 达 显 著 下 调(t=29.39,P<0.001),而转染突变型HMGB1 基因表达载体MUT-HMGB1 后,与NC mimics 对照组相比,miR-129-5p-3' UTR-MUT 的luciferase 的 表 达差异不显著(t=0.61,P=0.57>0.05)。可见,miR-129-5p 可以靶向调控HMGB1 的表达,见图2。
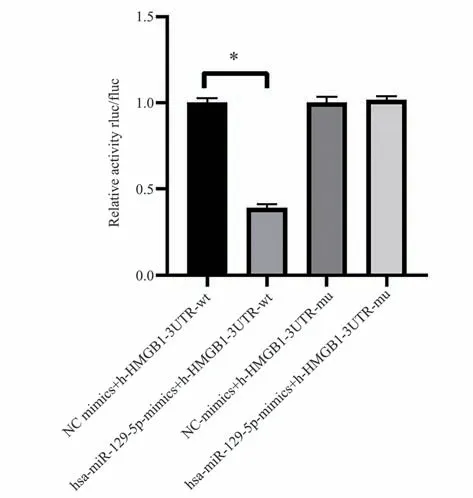
图2 双荧光素酶实验验证miR-129-5p 靶向结合HMGB1Fig 2 Double-luciferase experiment to verify the targeted binding of mir-129-5p to HMGB1
2.3 各组细胞中miR-129-5p 的表达水平
qRT-PCR 结果显示(表2),miR-129-5p mimics组miR-129-5p 表达水平较mimics-NC 组、Control 组表达水平显著上调(均P<0.001),miR-129-5p inhibitor 组miR-129-5p 表达水平较inhibitor-NC 组、Control 组表达水平显著下调(均P<0.05)。Mimics-NC 组、Control 组、inhibitor-NC 组miR-129-5p mRNA 表达水平差异无统计学意义(均P>0.05),见图3。
表2 qRT-PCR 检测各组细胞miR- 129-5p 的相对表达量(±s)Tab 2 The relative expression of miR-129-5p in each group detected by qRT-PCR(±s)
注:a:与Control 组相比,P<0.05;b:与Control 组相比,P<0.001;c:与mimics-NC 组相比,P<0.001;d:与inhibitor-NC 组相比,P<0.05。
miR-129-5p 1.66±0.14bc 0.96±0.04 0.99±0.22 1.02±0.24 0.65±0.02ad组别miR-129-5p mimics 组mimics-NC 组Control 组inhibitor-NC 组miR-129-5p inhibitor 组
2.4 过表达及抑制miR-129-5p 表达对HMGB1、Bcl-2、Caspase 3 表达的影响
Western blot 结果显示(表3),与mimics-NC 组及Control 组相比较,miR-129-5p mimics 组HMGB1蛋白的相对表达水平明显降低(均P<0.01),Bcl-2蛋白的相对表达水平明显降低(均P<0.05);与inhibitor-NC 组及Control 组相比较,miR-129-5p inhibitor 组HMGB1 蛋白的相对表达水平明显升高(均P<0.05),Bcl-2 蛋白的相对表达水平明显升高(均P<0.05);miR-129-5p mimics 组Caspase 3 蛋白的相对表达水平明显高于mimics-NC 组(P<0.01)及Control 组(P<0.05);miR-129-5p inhibitor 组Caspase 3 蛋白的相对表达水平明显低于inhibitor-NC组(P<0.01)及Control 组(P<0.001)。mimics-NC组、Control 组、inhibitor-NC 组HMGB1、Bcl-2、Caspase 3 蛋白差异无统计学意义(均P>0.05),结果提示:过表达miR-129-5p 可以抑制HMGB1 蛋白的表达,促进SW1990 细胞凋亡,抑制miR-129-5p 可以使HMGB1 蛋白表达增加,抑制SW1990 细胞凋亡,见图4。
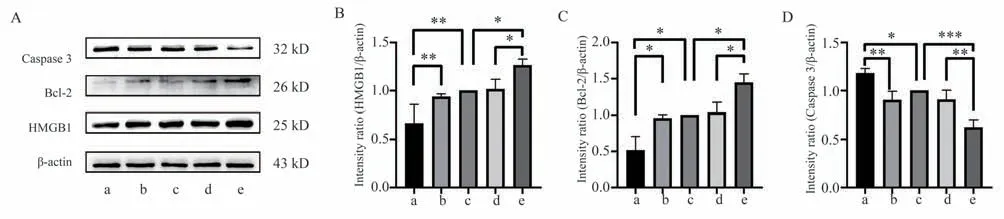
图4 各组对胰腺癌SW1990 细胞HMGB1 蛋白及凋亡相关蛋白表达的影响Fig 4 The effects of each group on the expression of HMGB1 protein and apoptosis-related protein in pancreatic cancer SW1990 cells
表3 各组对胰腺癌SW1990 细胞HMGB1 蛋白及凋亡相关蛋白表达的影响(±s)Tab 3 The effects of each group on the expression of HMGB1 protein and apoptosis-related protein in pancreatic cancer SW1990 cells(±s)
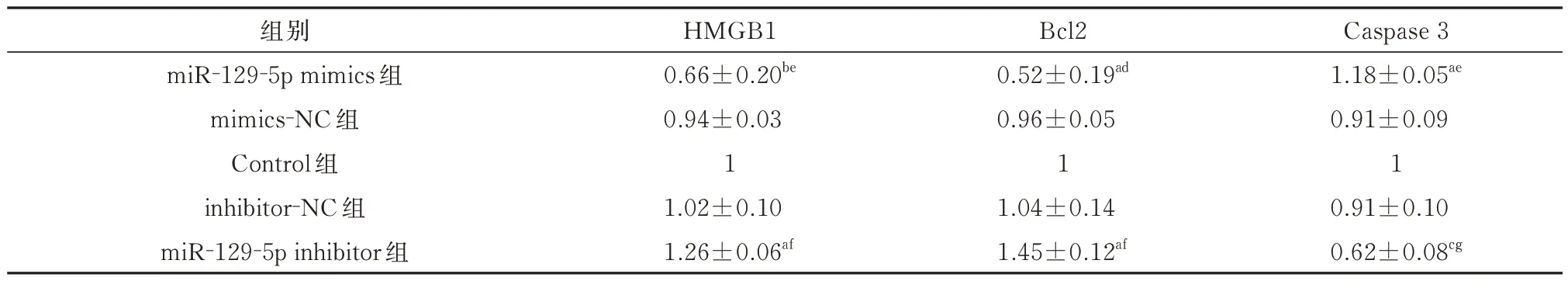
表3 各组对胰腺癌SW1990 细胞HMGB1 蛋白及凋亡相关蛋白表达的影响(±s)Tab 3 The effects of each group on the expression of HMGB1 protein and apoptosis-related protein in pancreatic cancer SW1990 cells(±s)
注:a:与Control 组相比,P<0.05;b:与Control 组相比,P<0.01;c:与Control 组相比,P<0.001;d:与mimics-NC 组相比,P<0.05;e:与mimics-NC 组相比,P<0.01;f:与inhibitor-NC 组相比,P<0.05;g:与inhibitor-NC 组相比,P<0.01。
Caspase 3 1.18±0.05ae 0.91±0.09 1 0.91±0.10 0.62±0.08cg组别miR-129-5p mimics 组mimics-NC 组Control 组inhibitor-NC 组miR-129-5p inhibitor 组HMGB1 0.66±0.20be 0.94±0.03 1 1.02±0.10 1.26±0.06af Bcl2 0.52±0.19ad 0.96±0.05 1 1.04±0.14 1.45±0.12af
2.5 miR-129-5p 靶 向HMGB1 对SW1990 细 胞 凋亡的影响
Hoechst 33258 染色结果显示,与mimics-NC组、Control 组 相 比,miR-129-5p mimics 组SW1990细胞数目明显减少,凋亡细胞数、细胞核破碎及染色质聚集程度增加,呈现较强蓝色荧光,见图5A;与inhibitor-NC 组、Control 组相比,miR-129-5p inhibitor 组,SW1990 细胞数目明显增加,凋亡细胞减少,细胞核饱满,胞浆丰富,呈均匀的淡蓝色荧光,见图5E;mimics-NC 组、Control 组、inhibitor-NC 组细胞核饱满,胞浆丰富,呈均匀的淡蓝色荧光,组间荧光无明显差异,见图5B~D。
3 讨论
PC 病死率高,是与癌症相关的死亡的第七大病因[14]。PC 的高病死率与其早期诊断困难和高转移率有关。近年来,PC 发病率不断上升,虽然其5 年总生存率从20 世纪70 年代的3%上升到2020 年的9%,但在所有癌症中,PC 患者预后最差[14]。我国国家癌症中心的统计数据显示,PC 的发病率已经上升至第9位,死亡率位列第6位[15]。PC 发病机制的研究,对提高疾病的早期诊断率,降低病死率具有重要意义。近年研究发现HMGB1 在PC 的发生、发展中起着重要的作用[6]。
HMGB 蛋白家族成员长度小于30 kDa,包括HMGB1、2、3、4。它们可以以结构依赖的方式与DNA 结 合,而 不 受 特 定 序 列 的 影 响[16]。其 中,HMGB1 通路参与增殖、炎症反应、凋亡、肿瘤耐药等多种生理过程[2,6,16-18]。HMGB1 是一个高度保守的核蛋白,属于非组蛋白染色质相关蛋白。研究发现HMGB1 在结直肠癌、肝癌、乳腺癌或黑素瘤等大多数类型的肿瘤中表达上调,并与细胞增殖、凋亡等生物学行为相关[19,20]。其中细胞凋亡与PC 的发生、发展密切相关。研究发现,凋亡是一种进化保守的调控细胞死亡形式,通常涉及半胱氨酸-天冬氨酸 蛋白 酶 家 族caspases[14]。Caspases 家族 在 凋 亡过程中扮演着十分重要的角色,而Caspase 3 作为凋亡执行蛋白在细胞凋亡过程中作用尤为突出。此外,Bcl-2 基因家族在PC 抑制细胞凋亡也中起着重要的作用[21]。研究表明HMGB1 在PC 组织中表达水平上调,且已被证实参与调控PC 细胞的增殖、凋亡[4]。抑制HMGB1 的表达可以促进Caspase 3、Bax 的表达,抑制Bcl-2 的表达,从而促进PC 细胞凋亡[22,23]。本研究发现,与Control 组、mimics-NC 组比较,转染miR-129-5p mimics 后,PC 细胞SW1990 的HMGB1蛋白表达水平显著降低,Caspase 3 蛋白的表达水平显著增高,Bcl-2 蛋白表达水平明显下降,细胞凋亡水平增加,这与前人的研究结果一致。
miRNA 与PC 的病理过程的关系,是近年来在国内外研究中的一个热点。许多研究证明,miRNA对PC 的增殖、凋亡、自噬等许多分子生物学过程都存在调控作用[24,25],但机制尚未阐明。miR-129-5p属于microRNA 家族的一员,研究发现,在结肠癌、乳腺癌、肺癌等多种肿瘤组织中miR-129-5p 均为低表达,过表达miR-129-5p 可以抑制细胞增殖、促进细胞凋亡、抑制细胞侵袭、迁移和降低肿瘤细胞耐药性[7-10]。在PC 中,已证实miR-129-5p 的表达下调并与细胞增殖、凋亡等多种生物学过程相关[11,12,26-28]。本研究发现,与Control 组、mimics-NC组比较,过表达miR-129-5p 后,Caspase 3 蛋白表达水平显著增高,Bcl-2 蛋白表达水平明显下降,细胞凋亡增加,与Control 组、inhibitor-NC 组比较,抑制miR-129-5p 后,Caspase 3 蛋白表达水平显著下降,Bcl-2 蛋白表达水平明显增高,细胞凋亡减少,这与前人的研究相一致。
目前PC 细胞凋亡的调控机制尚不完全清楚,研究发现miR-129-5p、HMGB1 均参与了PC 细胞凋亡[4,11],但两者 关 系 尚 不明确。有研究报 道,miR-129-5p 可以靶向结合HMGB1,下调HMGB1 的表达,促进乳腺癌的凋亡、抑制骨肉瘤细胞的增殖[22,29]。本 文通 过 生 物信 息 学 发 现miR-129-5p 和HMGB1 存在互补结合位点,进一步通过双荧光素酶报告基因检测发现,miR-129-5p 可以靶向调控HMGB1 的表达。
为明确miR-129-5p 能否通过HMGB1 调控细胞凋亡,本研究通过miR-129-5p mimics、miR-129-5p inhibitor 分别上调和下调miR-129-5p 的表达,发现上调miR-129-5p 表达后,HMGB1 及Bcl-2 蛋白表达减少,Caspase 3 蛋白表达增加,Hoechst 染色显示凋亡细胞数增加,呈现较强蓝色荧光;下调miR-129-5p 表 达 后,HMGB1 及Bcl-2 蛋 白 表达增加,Caspase 3 蛋白表达减少,Hoechst 染色显示凋亡细胞减少,呈均匀的淡蓝色荧光。结果提示miR-129-5p 可以靶向HMGB1 调控凋亡相关基因Caspase 3 和Bcl-2 的表达进而调控细胞凋亡。
综上所述,miR-129-5p 通过抑制HMGB1 的表达促进PC 细胞凋亡,而下调miR-129-5p 表达促进HMGB1 的表达,进而对SW1990 细胞的凋亡起到抑制作用。因此,miR-129-5p 可能是PC 细胞凋亡的重要调控因子,为探索miR-129-5p 的抗肿瘤作用机制提供了新思路。

