miR-3680-3p在肾透明细胞癌组织中的表达及与术后复发转移的关系
苟 东, 王 全, 刘 蓉, 何星成, 龙家才
(巴中市中心医院泌尿外科, 四川 巴中 636000)
肾细胞癌属于泌尿系统恶性肿瘤,发生率占成人全部恶性肿瘤的3%~5%,肾透明细胞癌(kidney renal clear cell carcinoma,KIRC)占肾细胞癌的70%,是最常见的肾细胞癌类型之一[1-2]。有研究统计,约30%的肾癌患者在初次诊疗时已发生恶性转移,经手术治疗后仍有20%~40%的复发转移风险,预后较差[3]。因此寻找能有效判断肿瘤预后的生物标志物,对改善患者预后有重要意义。研究发现,肿瘤基因组学和微环境之间的相互作用在癌症的发生发展中有重要作用[3],KIRC的转移和侵袭受到miRNAs的影响[4]。微小核糖核酸-3680-3p(miR-3680-3p)是新近发现的miRANs,被证实在人肾癌组织中低表达,在体外细胞学水平上证实低表达状态的miR-3680-3p能影响人肾癌细胞的生物学行为[5]。本研究通过初步筛选和鉴定KIRC组织中miR-3680-3p是否为其差异表达miRNA,进一步分析miR-3680-3p在KIRC组织中的表达水平及与临床病理特征及术后复发转移的关系,以期为临床KIRC的诊疗提供参考。
1 资料与方法
1.1 临床资料纳入2015年8月至2018年8月在巴中市中心医院实施手术治疗的KIRC患者。纳入标准:(1)患者年龄≥18岁;(2)KIRC诊断参照《中国肾癌诊治指南:2015版》中对肾细胞癌的诊断标准[6],且经病理检查确定为KIRC;(3)术前未接受放化疗、生物免疫等治疗;(4)患者术后可配合长期随访。排除标准:(1)伴有其他原发性恶性肿瘤者;(2)合并全身急慢性炎症反应及免疫疾病者;(3)妊娠期、哺乳期女性。最终选择符合纳入和排除标准的KIRC患者212例。纳入研究者对本次研究内容均知情同意并签署同意书。本研究经医院伦理委员会审核批准(1932)。
1.2 方法
1.2.1 差异mRNA筛选 随机选取3例患者的肾癌组织及癌旁组织标本冰上研磨后,加入TRIzol和氯仿,3 000 r/min低温离心10 min,获取上清液,以生物分光光度计检测RNA样本浓度。经离心过滤器分离miRNA,HiSeq测序获取干净序列,使用Gene Pix 4000B基因芯片分析仪(美国AXON公司)及配套数据软件筛选差异表达miRNA。与癌旁组织比较,癌组织中miRNA表达量≥1.5倍定义为上调,否则为下调。
1.2.2 实时荧光定量PCR(Quantitative Real-time PCR,qRT-PCR)进行差异表达miRAN验证 构建20 μL qRT-PCR反应体系加入PCR仪,扩增,进行预变性、变性、退火和延伸(条件:95℃/3 min,95℃/5 s,60℃/30 s、72℃/30 s),共40个循环,以U6为内参,引物序列:上游:5′-CTTCGGAGCACATATACTAA-3′,下游:5′-CGCTTCACGAATTTGCGTGA-3′,2-△△Ct法计算差异表达miRNA的相对表达量。
1.2.3 复发转移判断[7]出院后随访至2022年8月,前6个月需每隔3个月随访1次,之后6个月随访1次,每次随访进行血碱性磷酸酶检查,若出现碱性磷酸酶异常或骨痛症状,则进一步行影像学检查判断是否发生转移、复发,统计患者的无进展生存结果及总生存结果。将发生转移、复发或死亡患者纳入发生组,其余则纳入未发生组。
1.2.4 临床病理特征收集 收集患者的资料,包括性别、年龄、体质指数(body mass index,BMI),是否吸烟、饮酒,是否合并高血压、糖尿病,根据MRI或CT检查明确病灶直径及部位,根据手术及病理结果明确TNM分期、Fuhrman分级、有无肾被膜浸润、囊性肾癌、肿瘤坏死、有无淋巴结转移,记录手术方式。
1.3 观察指标(1)对比癌组织与癌旁组织的miR-3680-3p水平;(2)统计随访结果,以癌组织miR-3680-3p表达水平的中位数为分界分为高表达组和低表达组,比较两组的miR-3680-3p水平;(3)分析miR-3680-3p表达与病理学参数的关系;(4)Kaplan-Meier(K-M)生存分析miR-3680-3p低表达组和高表达组的无进展生存期和总生存期差异;(5)Cox比例风险回归分析影响KIRC患者复发转移的因素。

2 结果
2.1 KIRC组织中的差异miRNA表达分析对miRNA表达谱进行处理和分析,得到8个具有代表性的差异表达miRNA,其中3个表达上调,5个表达下调,下调表达miRNA中miR-3680-3p最为明显,见表1。

表1 KIRC组织中8个差异表达miRNA
2.2 癌组织与癌旁组织miR-3680-3p水平比较癌组织miR-3680-3p表达量为(1.25±0.34),低于癌旁组织的(3.20±0.80),差异有统计学意义(t=23.096,P=0.000)。
2.3 miR-3680-3p表达量与不同病理学参数的关系以miR-3680-3p表达的中位数1.25为分界,将患者分为低表达组(n=106)和高表达组(n=106),miR-3680-3p低表达组患者的年龄≥60岁、囊性肾癌、肾被膜浸润及手术根治性切除占比、发病部位与高表达组患者比较,差异无统计学意义(P>0.05),miR-3680-3p高表达组患者的肿瘤直径(>10 cm)、肿瘤坏死、TNM分期(Ⅲ~Ⅳ期)、Fuhrman分级(3~4级)占比、有淋巴转移占比低于低表达组,差异有统计学意义(P<0.05),见表2。

表2 miR-3680-3p与不同病理学参数的关系
2.4 miR-3680-3p表达不同患者的预后结果患者随访24~60个月,K-M分析显示,低表达组和高表达组的无进展生存期分别为45.36(43.65~53.65)个月、50.25(47.63~60.03)个月,总生存期时间分别为53.2(50.48~55.58)个月、59.57(58.83~60.31)个月,两组无进展生存期和总生存期的K-M曲线比较,差异有统计学意义(LogRankχ2=4.676、5.794,P=0.031、0.016),见图1。
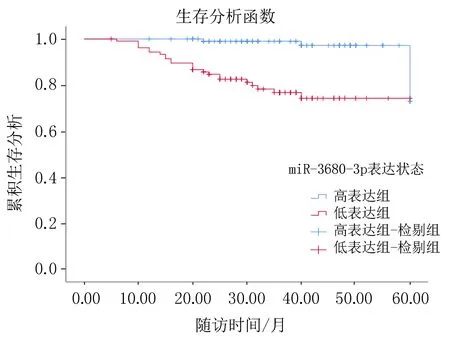
无进展生存K-M曲线 总生存曲线
2.5 影响KIRC患者复发转移的Cox比例风险回归分析将发生术后复发转移设置为因变量(发生=1,未发生=0),将患者的一般资料作为自变量,数据录入SPSS26.0软件进行多因素Cox比例风险回归分析,结果显示,TNM分期(Ⅲ~Ⅳ期)、Fuhrman分级(3~4级)及miR-3680-3p低表达是影响患者术后复发转移的独立风险因素(P<0.05),见表3。

表3 影响KIRC患者复发转移的Cox比例风险回归分析结果
3 讨论
肾癌患者在发病早期并无特异性的症状,且临床症状复杂、多变。出现血尿、腹部包块及腰痛等典型的三联征时多数已达到中晚期,预后较差[8]。肾癌对放化疗不敏感,手术是其最佳治疗方案,但手术过程中不可避免会对肿瘤造成挤压,可能造成癌细胞进入外周血,使术后的复发及转移风险大大增加[9]。临床中常用血清肿瘤标志物对预后进行预测,但准确度较低,临床中缺乏科学有效的早期预测指标,因此需寻求有效的生物学标志物以辅助判断,制定个性化的治疗方案。
本研究显示,经基因芯片技术及qRT-PCR筛选出KIRC组织中miR-3680-3p有显著的差异表达,并验证了癌组织中的miR-3680-3p表达量低于癌旁组织。miR-3680-3p高表达组患者的肿瘤直径(>10 cm)、肿瘤坏死、TNM分期(Ⅲ~Ⅳ期)、Fuhrman分级(3~4级)占比、有淋巴转移占比低于低表达组,说明miR-3680-3p在KIRC中表达量下降,且其表达水平与病理分级有一定的关系。miR-3680-3p作为小分子单链RNA,能够在转录水平发挥基因调节作用,与基因mRNA的3′非编码区结合,影响靶基因mRNA的降解及翻译,在细胞的生长、凋亡、增殖、迁移中发挥调控作用[10-11]。在癌症的发生发展过程中,癌细胞的增殖、迁移等会影响肿瘤的生长、分期、分级等情况,因此可推测miR-3680-3p能够影响KIRC的发展。Shi等[12]研究发现,miR-3680-3p为环状RNA-蛋白激酶C的海绵分子,能上调蛋白激酶B,刺激食管鳞状细胞癌的迁移和增殖。由此可知,miR-3680-3p的低表达与KIRC的发生发展有关,其机制尚待进一步研究明确。
miRNA在癌症中的过表达和低表达均可影响肿瘤的迁移和侵袭能力,是导致患者预后不佳的重要因素。因此,异常表达的miRNA具有作为癌症诊断、预后预测的生物学标志物和治疗靶点的研究价值[13-14]。本研究通过K-M分析显示,miR-3680-3p高表达组和低表达组的无进展生存和总生存时间存在差异,Cox比例风险回归分析证实miR-3680-3p低表达为影响患者术后复发转移的独立风险因素,说明miR-3680-3p可作为KIRC患者的预后预测生物标志物。miR-3680-3p是新近发现的mRNA,其定位的染色体尚不明确。但王斌等[5]通过生物信息学软件发现其在人肾癌组织中异常表达,且为调控血管细胞生长因子C的靶基因,体外细胞实验验证了过表达的miR-3680-3p能够抑制人肾癌细胞的迁移和增殖。故可推测miR-3680-3p的低表达可能通过上调蛋白激酶B,抑制人肾癌细胞的凋亡,促进其增殖和迁移,导致KIRC的复发。因此临床可考虑将miR-3680-3p作为KIRC预后预测的生物标志物或靶向治疗研究方向。
综上所述,KIRC组织中miR-3680-3p表达量下降,且miR-3680-3p低表达为影响患者术后复发转移的独立危险因素,可作为KIRC预后预测生物标志物。但肿瘤患者预后受遗传、环境等多因素影响,机制较为复杂,后续仍需进行体外转录实验,进一步明确miR-3680-3p对肾癌细胞的调控机制。

