高细胞亚型甲状腺乳头状癌临床病理分析与蛋白质组学研究
王维娜, 陈海霞, 张 焕, 杨 波, 蒲红伟
(新疆医科大学1附属肿瘤医院病理科, 2第一附属医院学科建设科, 乌鲁木齐 830011)
甲状腺乳头状癌(Papillary thyroid carcinoma,PTC)有14个组织学亚型,其中最常见的是经典型(Classical PTC,CPTC),PTC总体预后良好,但是临床中存在一些PTC 亚型比经典型更具侵袭性,其中高细胞亚型(Tall cell subtype PTC,TC-PTC)是最常见的侵袭变异型,易侵犯甲状腺被膜外结缔组织及骨骼肌、易出现局部复发、淋巴结转移甚至远处转移[1]。2022年甲状腺癌诊疗指南中提出:高侵袭性PTC亚型(如高细胞、柱状细胞、弥漫硬化型等)具有中度复发风险,术后考虑放射性碘治疗。TC-PTC在HE形态上有时与CPTC难以鉴别,特别是形态不典型或者占比较少的时候,极易漏诊,为了提高TC-PTC诊断率,让患者获得精准治疗,降低复发和转移风险,本研究利用非标记定量技术(label-free)联合质谱分析,首次评估高细胞亚型PTC与经典型PTC及良性甲状腺结节(Benign thyroid nodules,BTN)蛋白质组谱,初步筛选TC-PTC潜在生物标志物,为进一步开展蛋白功能验证及完善侵袭性PTC亚型背后的分子机制提供科学依据。
1 材料与方法
1.1 临床样本收集自2021年1月至2021年6月期间,因甲状腺结节在新疆医科大学附属肿瘤医院乳腺甲状腺外科初次就诊并手术,有术后常规病理资料的石蜡标本67例,TC-PTC17例,CPTC50例,其中17例TC-PTC、15例CPTC及另收集15例良性甲状腺结节(Benign thyroid nodules,BTN)留取术中新鲜标本,-80℃冻存,进行质谱分析。
纳入标准:(1)每例入组病例均由两名高年资病理科医师明确诊断。根据WHO(2022)甲状腺肿瘤新分类作为诊断标准,CPTC定义为:具有纤维血管轴心的乳头,衬覆PTC细胞学特征,即细胞核增大拉长拥挤、核膜不规则、核沟、核内包涵体及毛玻璃样核。TC-PTC 定义为肿瘤细胞高度是宽度的3倍,且高细胞占比超过30%,胞浆丰富嗜酸且具有PTC典型的细胞核特征,拉长的滤泡或具有双轨征的乳头,见图1;(2)入院前未行手术、碘治疗的初治患者;(3)完整的临床病理资料;(4)无其他脏器系统恶性肿瘤病史。排除标准:(1)除高细胞亚型及经典型之外的PTC其他组织学亚型;(2)高细胞占比小于30%的PTC;(3)两名病理科医师诊断意见不一致;(4)临床或病理资料不完整,复发癌和远处转移至甲状腺的恶性肿瘤。本研究经过新疆医科大学附属肿瘤医院伦理委员会批准(伦理审批号:2021BC004),并取得患者知情同意。
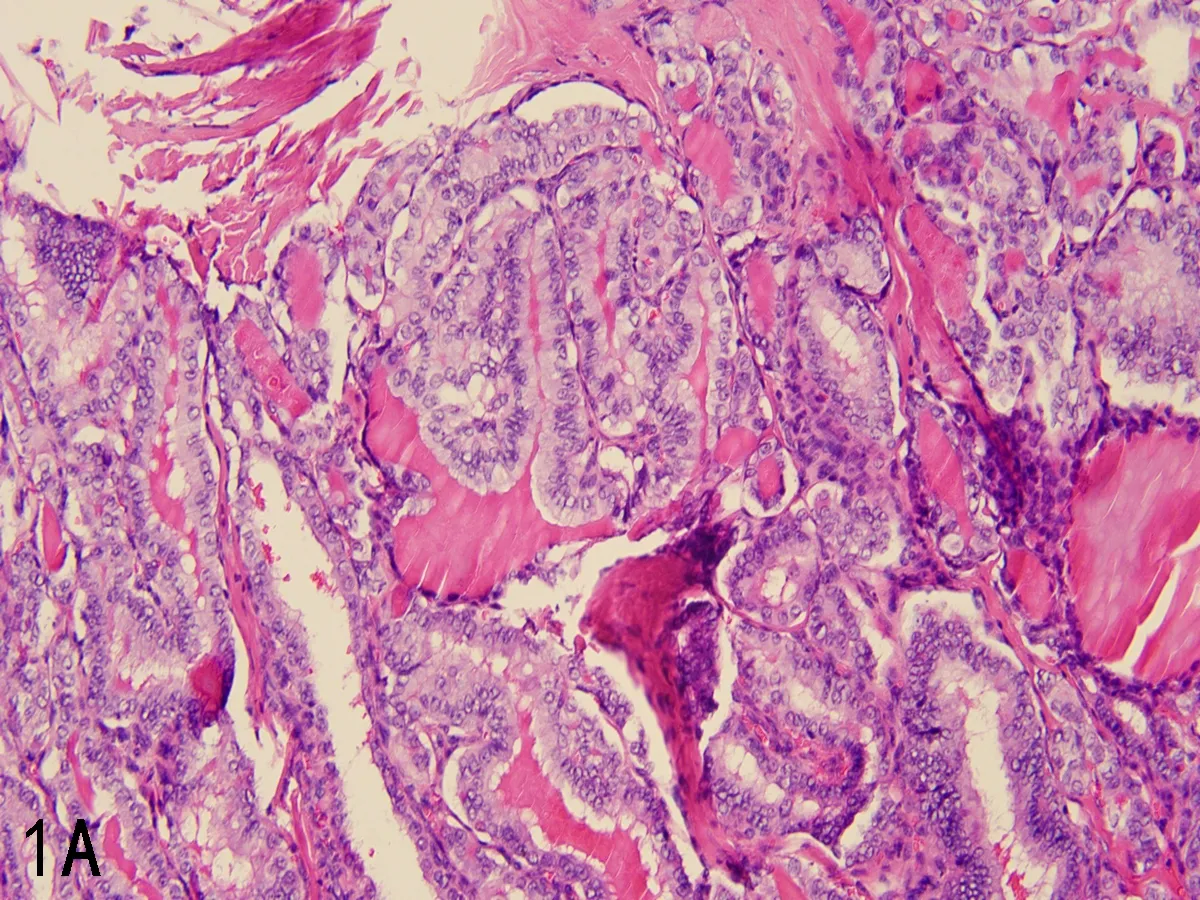
注: 1A, 高细胞亚型甲状腺乳头状癌(HE,×200); 1B, 经典型甲状腺乳头状癌(HE,×200); 1C, 良性甲状腺结节(HE,×100); 1D, 淋巴结转移灶显示肿瘤细胞的高细胞形态(HE,×200)。
1.2 实验方法将47例-80℃冻存甲状腺组织进行质谱分析,17例TC-PTC为A组,15例CPTC为B组,15例BTN为C组,每组3个重复。(1)提取蛋白质及肽段酶解:每组取0.1 g样本,加液氮研磨成粉,加入适量蛋白裂解液,对样品进行简单的超声波处理,于4℃,12 000 g,离心15 min。用Bradford法测定上清液中总蛋白含量。采用超滤辅助样品制备(Filter aided sample preparation,FASP)酶解法制备蛋白质溶液样品。(2)非标记定量质谱分析:通过液相色谱与串联质谱法(LC-MS/MS)进行。(3)蛋白质鉴定及定量分析:利用Proteome Discoverer2.2软件搜库进行蛋白鉴定,根据 FDR<0.01的标准对数据进行筛选,以差异倍数(Foldchange)≥1.3倍,且P<0.05为标准进行显著差异蛋白筛选。对筛选的差异表达蛋白应用火山图展示结果。(4)差异表达蛋白功能分析:使用interproscan软件进行GO功能注释,KEGG数据库对鉴定的蛋白质进行通路分析。利用String DB软件预测蛋白质-蛋白质(PPI)相互作用。应用柱形图和PPI互作图展示结果。
1.3 统计学分析采用SPSS27.0软件对数据进行统计学分析。组间差异性比较采用χ2检验和Fisher确切概率法。以P<0.05为差异有统计学意义。
2 结果
2.1 TC-PTC组与CPTC组临床病理特征对比67例PTC患者年龄20~67岁(中位年龄44岁),男性19例,女性48例。TC-PTC组与CPTC组在患者年龄、性别及是否伴淋巴细胞性甲状腺炎等方面差异无统计学意义(P>0.05)。TC-PTC组更易侵犯甲状腺被膜及被膜外结缔组织(其中2例伴被膜外带状肌群侵犯),1例TC-PTC伴脉管癌栓,更易出现多灶病变及淋巴结转移,但差异无统计学意义(P>0.05)。TC-PTC组肿瘤最大径大于CPTC组,差异有统计学意义(P<0.05)。见表1。

表1 TC-PTC组与CPTC组患者临床病理特征对比/例(%)
2.2 差异蛋白鉴定结果利用label-free结合质谱技术对TC-PTC(A组)、CPTC(B组)及BTN(C组)3组进行相对定量分析,共鉴定出4 739个蛋白质,肽段数量34 294个。TC-PTC组、CPTC组与BTN组相比,差异蛋白数量分别是1 054个和862个,而TC-PTC组与CPTC组间差异蛋白数量为69个,见图2火山图。

注: 黑色代表差异不显著的蛋白, 红色代表上调蛋白, 绿色代表下调蛋白。
2.3 差异蛋白GO富集分析88.3%的TC-PTC/BTN上调差异蛋白质具有结合特性,包括磷脂结合、核酸结合、有机环状化合物结合等,主要参与翻译、细胞氮化合物代谢、非同源末端连接(NHEJ)修复通路等,从细胞组分来看,主要构成核糖核蛋白复合体。见图3。TC-PTC/CPTC组中16个上调差异蛋白参与肌动蛋白细胞骨架组成、铵离子转运、核苷酸分解代谢等过程,涉及磷脂结合、核酸结合、磷脂化合物结合等结合功能。

图3 A/C组上调差异蛋白GO功能富集
2.4 差异蛋白质KEGG富集分析通过KEGG注释在TC-PTC组与BTN组中分析了310个差异蛋白,影响体内13条代谢通路(P<0.05),其中核糖体生物合成、蛋白酶复合体、剪接体组成、磷酸戊糖途径、RNA转运等通路影响位点较多,富集的显著差异蛋白包括:核糖体蛋白、蛋白酶体亚基、剪接体复合物等(PHF5A、U2SURP、剪接因子3b蛋白复合物SNRPD1)、核孔复合体蛋白等,见图4。基于KEGG注释的TC-PTC组与CPTC组的9个上调差异蛋白在烟酸和烟酰胺代谢、剪接体组成、轴突导向等过程显著富集。富集到胞外5′-核苷酸酶(CD73/NT5E),烟酰酸磷酸核糖基转移酶(NAPRT)、剪接体复合物、神经纤毛蛋白(NRP1)等。

图4 蛋白酶复合体
2.5 差异蛋白的互作调控网络利用String在线软件分析TC-PTC组、CPTC组及BTN组差异表达蛋白质相互作用的调控网络(图5)。TC-PTC/BTN组间互作蛋白质数量最多,其中上调蛋白以蛋白酶体各亚基和核糖体蛋白大小亚基互作关系为主。TC-PTC/CPTC的上调和下调差异蛋白中,与蛋白质B2RBH2(CD73)互作的蛋白质数量最多有7个,其中与Q6XQN6(NAPRT)互作关系最密切。

注: 桔色节点代表上调蛋白; 绿色节点代表下调蛋白。
2.6 组间筛选的差异蛋白交叉分析将TC-PTC/BTN、TC-PTC/CPTC、TC-PTC/BTN三组间上调差异蛋白合并保留,差异倍数均在1.3倍以上,P<0.05。通过韦恩图观察到每组特有或共同的差异表达蛋白数量(图6)。TC-PTC组、CPTC组与BTN组间共同表达上调蛋白459个,TC-PTC组与CPTC组间上调差异蛋白数较少,共36个。与CPTC组及BTN组相比,TC-PTC组显著高表达的蛋白14个,分别是:RARRES2、DPY19L1、CD73、SNRPA1、NUP62、PHF5A、U2SURP、NAPRT及TC-PTC组特有6个蛋白:NRP1、MTM1、COG1、SRP19、PRR15、CDC2L5。通过分析差异蛋白生物学功能、富集的生化代谢途径及查阅文献,我们挑选出CD73、SNRPA1、NRP1及NAPRT这4个感兴趣的蛋白作为探索目标。

图6 TC-PTC(A组)、CPTC(B组)及BTN(C组)
3 讨论
本研究发现,与CPTC组患者相比,TC-PTC组患者的病变体积偏大(P<0.05),更易出现多灶病变、易侵犯甲状腺被膜及发生淋巴结转移,但差异无统计学意义(P>0.05),这一结论与Bongers等[2]的研究结果一致,提示TC-PTC临床生物学行为更具有侵袭性,这一组织学类型的PTC需要引起关注。本研究利用Label-free与LC-MS/MS相结合,鉴定高细胞亚型PTC、经典型PTC和良性甲状腺结节组织中变化的蛋白质。TC-PTC组与BTN对照组间差异蛋白最多,有1 054个,TC-PTC组与CPTC组间差异蛋白仅有69个,高细胞亚型和经典型PTC之间的差异蛋白数量少,可能归结于两类PTC亚型有相似的组织学特征,都属于分化型甲状腺癌,但TC-PTC恶性程度更高,精确的组织学分型有利于患者精准治疗。本研究利用GO及KEGG通路分析发现,TC-PTC差异蛋白主要富集于核糖体生物合成、蛋白酶复合体组成、剪接体组成、磷酸戊糖途径等代谢通路。泛素-蛋白酶体系统是细胞内调节蛋白降解的最主要方式,影响细胞内多级信号串联,促进细胞增殖,目前已成为抗癌治疗的重要靶点[3]。本研究也发现多种26S蛋白酶体调节亚基在TC-PTC组及CPTC组表达增高,提示蛋白酶体系统可能在甲状腺滤泡上皮恶性转化中起关键作用。磷酸戊糖途径(PPP)提供了恶性肿瘤快速增殖所需要的大量核苷酸和脂质,关键酶葡萄糖-6-磷酸脱氢酶(G6PD)促进肿瘤细胞对葡萄糖的摄取,参与多种信号通路[4]。本研究也证实了G6PD和PPP非氧化阶段的转酮醇酶等在两类PTC亚型中活性均增高,提示磷酸戊糖代谢参与了甲状腺滤泡上皮恶性发展进程。
RNA剪接失调与癌症发展与治疗密切相关,已成为肿瘤生物学及遗传学研究热点[5]。本研究TC-PTC组富集到U2 snRNP剪接复合物的重要亚单位(SNRPA1、PHF5A)和剪接体相关蛋白(U2SURP)的高表达,说明RNA剪接事件可能影响TC-PTC的发生。本研究结合TC-PTC显著上调差异蛋白的生物学功能及参与的代谢途径和信号通路,进一步结合文献复习,筛选出4个可能与TC-PTC发生进展相关的蛋白,分别是:CD73、SNRPA1、NRP1、NAPRT。
胞外核苷酸酶(NT5E/CD73)主要是将细胞外磷酸腺苷(AMP)去磷酸化成腺苷,它还是一种介导癌症侵袭和转移的黏附信号分子,肿瘤细胞和间质细胞过表达CD73促进肿瘤进展[6-8]。研究者发现甲状腺乳头状癌细胞具有更高的AMP分解能力和CD73表达水平,利于细胞外腺苷在肿瘤微环境中的积聚,促进PTC细胞的增殖和迁移,CD73已成为甲状腺乳头状癌(PTC)潜在预后和治疗标志物[9-10]。本研究发现CD73在三组中均有表达,在TC-PTC组表达量最高,BTN组表达最低。我们在核苷酸代谢及烟酸和烟酰胺代谢中均捕获到此蛋白,CD73在TC-PTC/CPTC组间差异蛋白中是核心分子,与之互作的蛋白数量最多,推测CD73可能是TC-PTC的潜在生物标志物。小核糖体核蛋白A1(SNRPA1)是主要剪接体成分U2 sn RNP的重要剪接因子,参与特异性剪接体的组装、获取、维持[11]。研究者构建了干扰SNRPA1的慢病毒载体,shSNRPA1组明显抑制胃癌细胞的生长增殖[12]。本研究在TC-PTC组中发现三种重要剪接因子上调表达,其中SNRPA1在TC-PTC组表达量最高,推测SNRPA1可能参与TC-PTC RNA剪接事件发生。烟酸磷酸核糖基转移酶(NAPRT)通过上调烟酰胺腺嘌呤二核苷酸(NAD)水平促进结肠癌、胰腺癌及前列腺癌细胞糖酵解和增殖活性[13],本研究发现TC-PTC中NAPRT蛋白含量高于CPTC和BTN,推测NAPRT表达与PTC生物学行为相关,这一结论有待在基因和蛋白水平进一步验证。神经纤毛蛋白-1(NRP1)为Ⅰ型跨膜糖蛋白,充当细胞表面受体中心,通过多个信号级联反应促进肿瘤细胞生长、血管形成和转移[14-15]。本研究中NRP1仅在TC-PTC中表达,其他两组均未检测到,推测NRP1可能成为TC-PTC潜在生物标志物。
综上所述,本研究提供了高细胞亚型PTC、经典型PTC及良性甲状腺结节蛋白质组学的初步信息,筛选出4个在TC-PTC中高表达且可能具有临床意义的兴趣蛋白,下一步尚需扩大样本量开展蛋白功能验证,探讨这4个差异蛋白作为高细胞亚型甲状腺乳头状癌特异性肿瘤标志物的可能性,为高侵袭性亚型甲状腺乳头状癌发生进展机制的研究提供理论依据。

