PGRN缺失对猪血凝性脑脊髓炎病毒脑内感染小鼠的影响
柳雨竹, 王炳量,陈雨竹,甄 理,王真真,王改丽,李 姿,石俊超,兰云刚*,宋德光*
(1.吉林大学 动物医学学院,吉林 长春 130062;2.河北省乡村振兴促进中心,河北 石家庄 050000; 3.吉林省畜牧兽医科学研究院,吉林 长春 130062)
猪血凝性脑脊髓炎(porcine hemagglutinating encephalomyelitis, PHE)是由猪血凝性脑脊髓炎病毒(porcine hemagglutinating encephalomyelitis virus, PHEV)感染而引起仔猪的一种急性、高度接触性传染病[1]。PHEV是冠状病毒科、β冠状病毒属成员[2],主要侵害3周龄以内的仔猪,病死率可达100%;根据临床表现分为呕吐衰减型、脑脊髓炎型、以及流感型。近年来由于PHEV的不断变异,其感染引起的仔猪发病率与病死率逐年增加,然而针对PHE尚无有效的防制措施。
最新研究发现,β冠状病毒通过富集在晚期内体/溶酶体中,利用溶酶体释放病毒粒子[3]。靶向溶酶体功能的关键功能蛋白可能是抑制冠状病毒感染和传播的有效方法。溶酶体蛋白颗粒蛋白前体(progranulin,PGRN)是一种由granulin(GRN)基因编码,富含半胱氨酸并具有促进生长、营养神经、抗炎等多种作用的分泌型糖蛋白[4]。PGRN在肿瘤细胞、成纤维细胞、神经元、小胶质细胞、血管内皮细胞和外周血中性粒细胞等中均有表达。研究证实,PGRN表达或转运异常能改变溶酶体形态、水解酶活性,调控溶酶体膜组分含量等扰乱溶酶体正常功能,继而干扰细胞分解代谢、信号传导及质膜修复等多种生理过程,参与多种神经系统疾病的发生发展[5]。PHEV感染宿主后会导致大脑皮质区神经退行性病变相关蛋白TDP-43 等的产生和沉积,引发神经元轴突生长发育不良、神经元丧失、髓鞘变性等变化,表明PHEV感染诱发神经退行性病变[6],此外,前期研究发现PHEV感染显著下调神经细胞PGRN的表达[6]。
然而PGRN在PHEV复制及其致神经损伤过程中的作用并不清楚。据此,本研究以PHEV脑内感染PGRN敲除鼠及其对照小鼠为研究对象,探究PGRN缺失对PHEV脑内感染小鼠的影响,研究结果将不仅有助于揭示PGRN在PHE发病过程中的作用,而且为抗PHEV药物研究提供理论依据。
1 材料与方法
1.1 细胞和病毒PHEV株PHEV-CC14 (MF08-3115)[7],小鼠成神经母细胞瘤细胞(N2a细胞)均由本实验室保存。
1.2 实验动物PGRN敲除小鼠由中国农业大学流感病毒试验室刘金华教授、宁夏大学魏凡华教授惠赠;试验使用4周龄野生型、敲除型小鼠均由本实验室培育。2组小鼠在脑内接种PHEV,在接种后5 d 麻醉处死,冰上取出脑组织通过液氮速冻后存放于-80℃冰箱用于后续试验。
1.3 主要试剂DMEM培养基和胎牛血清均购自Gibco公司;胰蛋白酶购自Sigma公司;5×SDS-PAGE Loading Buffer、RAPI蛋白裂解液(P0013B),抗荧光淬灭封片液均购自碧云天生物技术有限公司;三色预染蛋白Marker、无蛋白快速封闭液(1×)均购自于上海雅酶生物医药科技有限公司;2×SYBR Green Master Mixture购自于Bimake公司;GAPDH抗体、TDP-43抗体、Anti-rabbit IgG(H+L)、Anti-mouse IgG(H+L)、FITC-mouse IgG(H+L) 488荧光二抗均购自于Proteintech公司;M-MLV反转录酶、RRI、10 mmol/L dNTP、RNAiso Plus Total RNA 提取试剂均购自于TaKaRa公司;PVDF膜(孔径为0.45,0.22 μm)购自Merck Millipore公司;β-Amyloid抗体购于Santa公司;重组Anti-Alpha-synuclein抗体购于Abcam公司;10% PAGE高分辨彩色(红色)凝胶超快速配制试剂盒、12% PAGE高分辨彩色(绿色)凝胶超快速配制试剂盒均购于武汉塞维尔生物科技有限公司;ECL化学发光底物购于Biosharp公司;PHEV多抗由本实验室制备并保存。
1.4 Western blot检测将采集的小鼠脑组织放于离心管中置于冰上,加入适量的含有PMSF的RIPA裂解液,用酒精消毒后,眼科手术剪碎组织,使用手持均浆器进行均浆,裂解30 min。将样品以12 000 r/min 4℃离心10 min去除组织碎片,最后加入上样缓冲液,开水煮沸10 min。取样品加入预制的PAGE凝胶中,200 V恒压30 min进行电泳分离;电转印将蛋白印至PVDF膜上,使用快速封闭液封闭10 min后,加入β-Amyloid、TDP-43、α-SYN、PHEV抗体于4℃孵育过夜;TBST清洗5 min/次,用HRP标记的二抗孵育1 h,充分清洗后ECL显影并采集图像,使用Image J 对条带的灰度值进行分析。
1.5 荧光定量PCR检测采集的小鼠脑组织根据RNAiso Plus Total RNA提取试剂说明书提取细胞总RNA,测定浓度后反转录为cDNA。使用Line Gene9600 Plus荧光定量PCR检测仪进行荧光定量PCR反应。反应体系如下:2×SYBR Green Master Mix 10 μL,cDNA模板2 μL,上、下游引物各1 μL,蒸馏水补充至20 μL。所有数据均由Gene 9660软件分析。
1.6 引物合成在GenBank中查找PHEV、GAPDH、IL-1β、TNF-α、CCL4、CCL5、CXCL10、IFN-α、IFN-β、IL-10、IL-12p40等基因序列,使用Primer Premier 5.0软件设计相应的引物,将引物序列发送至吉林省库美生物科技有限公司合成(表1)。

表1 荧光定量PCR反应引物信息
1.7 石蜡切片制作小鼠脑组织取出后放在10%中性福尔马林溶液中固定24 h以上,之后放入不同浓度的酒精中脱水,二甲苯透明后,浸蜡和包埋,最后切片。
1.8 间接免疫荧光将上述切片进行脱蜡复水等步骤后,选用柠檬酸钠(pH=6.0)溶液进行抗原修复,37℃ 10%脱脂奶粉封闭1 h后,孵育一抗过夜,后用PBS冲洗表面残余抗体,室温孵育荧光二抗1 h,PBS冲洗,滴加抗荧光淬灭液(含Hoechst)封片。荧光显微镜观察,选择不同波段激发光,采集图像。

2 结果
2.1 PHEV脑内感染小鼠后的体质量和存活时间变化选取4周龄、眼观体表健康的野生型小鼠(PGRN+/+)和PGRN敲除小鼠(PGRN-/-),在小鼠两眼连接线的中点向上2~4 cm的部位,进行脑内接种PHEV。记录接毒后1~5 d的体质量变化(图1 A),同时统计5 d内2组小鼠的存活率(图1 B),结果表明,PGRN敲除后体质量下降趋势缓慢并且延长了小鼠的存活时间。

图1 2组脑内接种小鼠的体质量变化(A)和生存曲线(B)
2.2 PHEV脑内感染小鼠后病毒含量的变化对4周龄的野生型小鼠(PGRN+/+) 和 PGRN敲除小鼠(PGRN-/-)进行脑内接种PHEV,收集发病的小鼠脑组织进行Western blot、荧光定量PCR和间接免疫荧光检测,结果如图2所示,与野生型小鼠相比,PGRN敲除小鼠脑内的病毒含量显著降低。
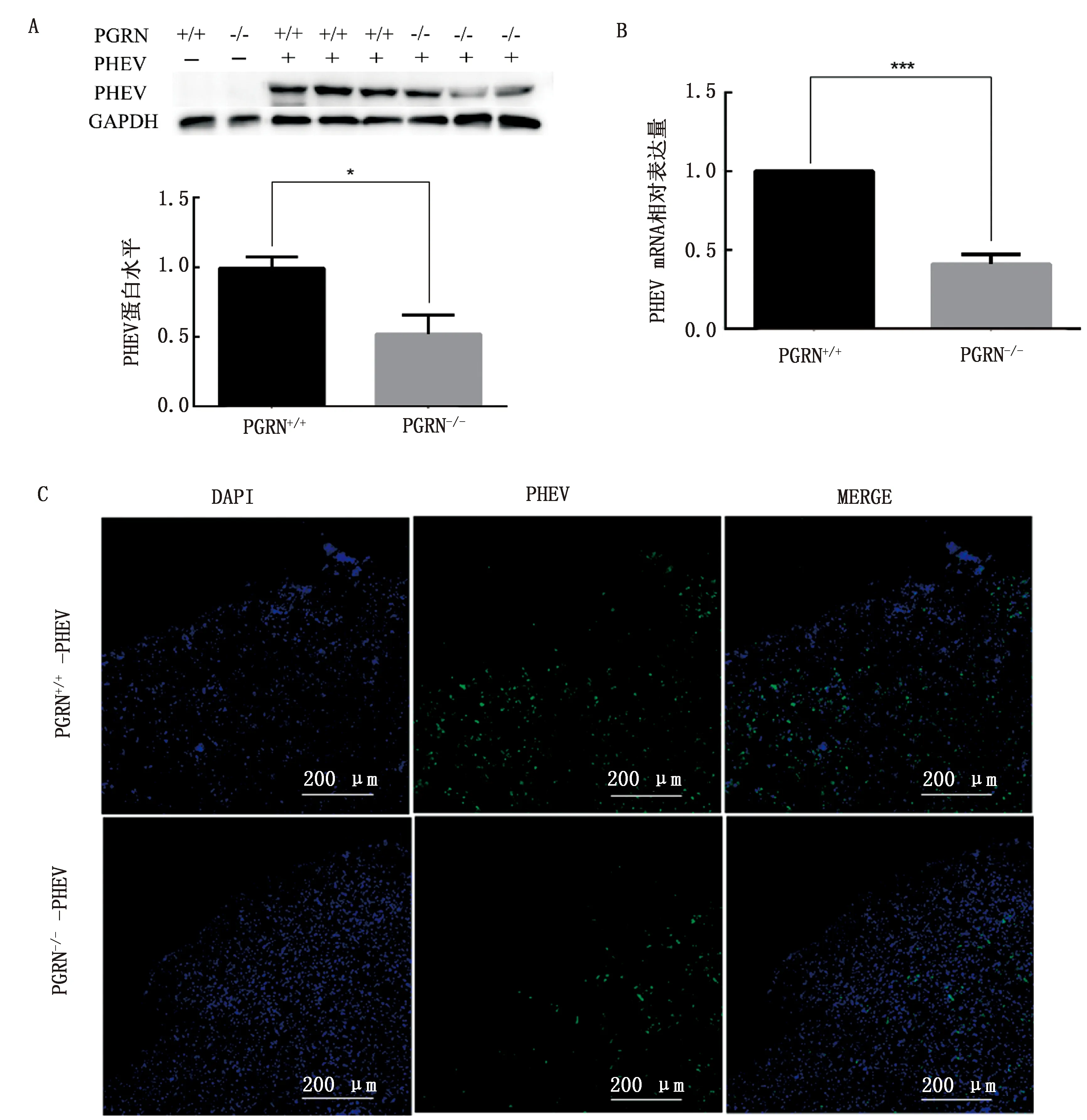
A.脑内接种后脑组织内蛋白水平检测图;B.脑内接种后脑组织荧光定量PCR;C.脑内接种后2组小鼠大脑皮层内病毒含量荧光图。***.P<0.001
2.3 PHEV脑内感染小鼠后相关细胞因子的变化在接毒后4~5 d,2组小鼠出现明显的神经症状,采集2组小鼠的脑组织,取全脑应用荧光定量PCR方法检测细胞因子的变化,发现干扰素和抗肿瘤细胞因子含量明显升高,趋化因子含量降低,结果如图3所示。
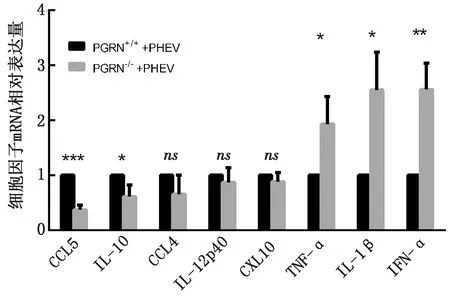
注:*.P<0.05;**.P<0.01
2.4 PHEV脑内感染小鼠后神经退行性病变相关蛋白的变化收集2组发病后的小鼠脑组织,应用Western blot检测,发现PGRN敲除鼠脑内TDP-43蛋白的表达水平显著升高,而α-SYN、β-Amyloid蛋白的表达水平无显著性差异,结果如图4所示。
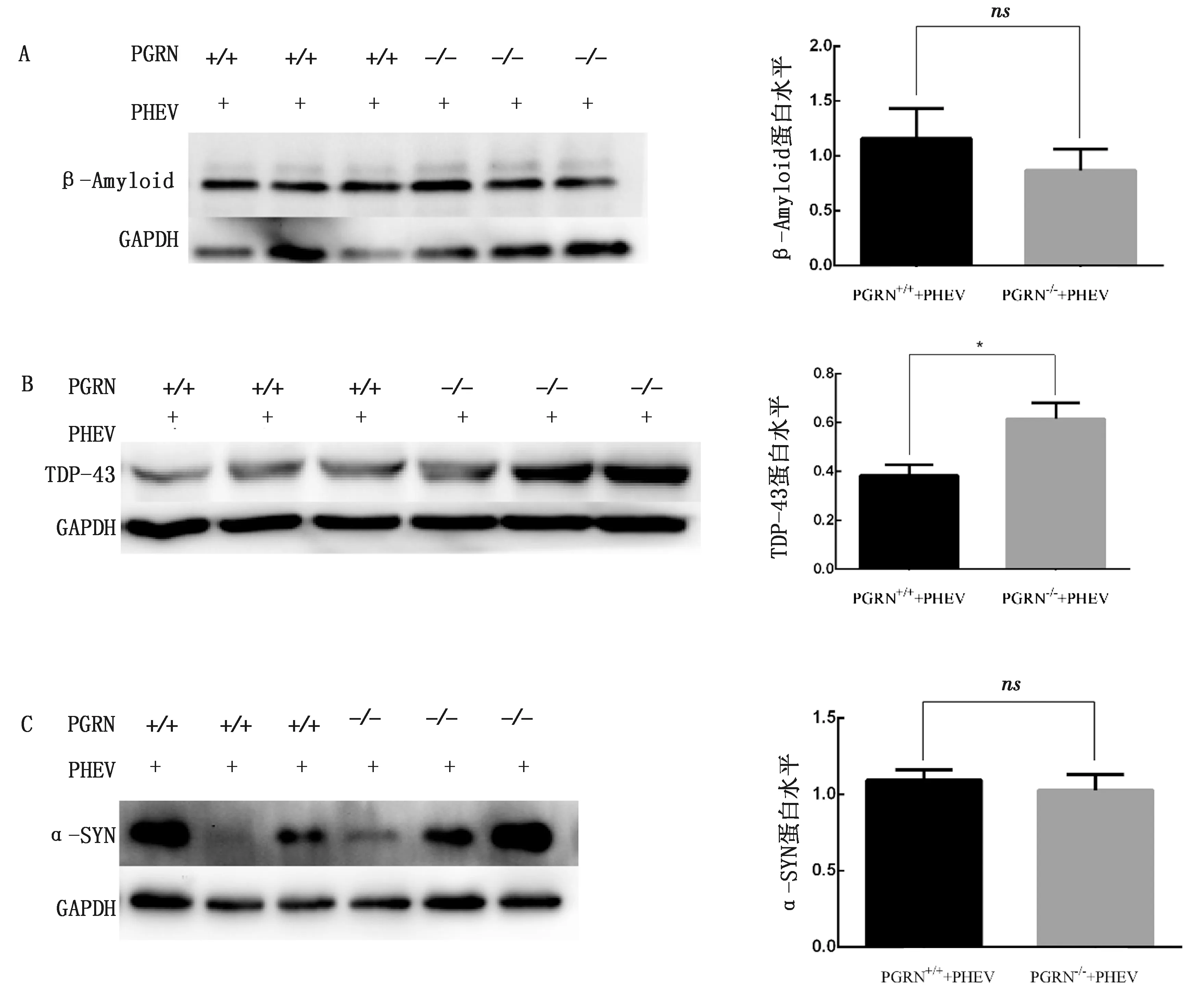
A.β-Amyloid 蛋白图;B.TDP-43 蛋白图;C.α-SYN蛋白图。ns.P>0.05;*.P<0.05
3 讨论
PHE是由PHEV感染引起的一种急性接触性传染病,在全世界范围内广泛流行,主要感染仔猪,临床上可分为神经型和呕吐型[8]。2015年,美国密歇根州暴发了以流感样症状为主的、感染成年猪的新型PHEV病毒株[9],韩国也报道了在腹泻的新生仔猪中发现了1株新型PHEV[10],表明PHEV是在不断进化的,并且存在变异的风险。因此,深入研究PHEV致病机制和防控手段刻不容缓。
溶酶体作为机体内一种十分重要的细胞器,通过消化细胞内错误折叠的蛋白维持机体的稳态。最新研究发现,β-冠状病毒利用溶酶体进行复制并导致溶酶体功能障碍,但不清楚哪些溶酶体功能相关蛋白在这个过程中发挥关键作用。前期研究发现,β-冠状病毒属成员PHEV感染能显著下调溶酶体功能蛋白PGRN表达,暗示该蛋白在PHEV复制过程中发挥重要作用[7]。而本研究首先对PGRN基因缺失小鼠脑内接种PHEV,通过体质量变化和生存率的统计,发现与对照组野生型小鼠相比,敲除PGRN后感染PHEV小鼠的存活时间延长,推断敲除PGRN后PHEV的感染和复制受到抑制。随后利用Western blot、荧光定量PCR、间接免疫荧光方法对小鼠脑内病毒含量进行检测,发现敲除PGRN小鼠脑组织内的病毒含量显著降低,暗示PGRN在PHEV体内复制过程中发挥重要作用。那么PHEV是否通过下调PGRN并影响溶酶体功能,进而利于病毒的复制和传播,还有待于进一步研究。
此外,PGRN在胚胎发育早期分布于整个新皮层,在脑部主要由小胶质细胞和神经元细胞表达[11]。PGRN广泛参与机体的炎症反应、损伤修复、生长发育等多项病理及生理活动。在炎症反应中,PGRN可以促进抗炎细胞因子IL-10、IL-1β等的分泌[12]。此外,PGRN与TNF呈拮抗关系,竞争性的结合TNF因子受体,拮抗TNF介导的炎症反应[13]。已发现PGRN缺失增强了神经炎症反应,在敲除PGRN后,随着年龄增加,小鼠在18周龄时会出现小胶质细胞和星形胶质细胞被激活的现象[14]。
为了明确PGRN缺失对感染小鼠炎症反应的影响,本研究利用荧光定量PCR方法对小鼠的脑细胞因子进行了检测。结果表明,当敲除PGRN后,干扰素含量显著升高,增强了对病毒的清除作用。当PGRN缺失后,TNF-α的含量显著升高,增强了促炎反应,加速了病毒的清除,而趋化因子表达量的降低,暗示敲除PGRN对免疫细胞的迁移产生了抑制作用,但是具体的作用机制尚不明确。
研究表明随着小鼠年龄的增长,会引起RNA结合蛋白TDP-43的泛素化[15],而病理性TDP-43蛋白的沉积会导致认知功能的下降[16]。PGRN缺失后会导致小胶质细胞变成病理性的状态,影响溶酶体功能,增强TDP-43蛋白的分泌[17]。在PHEV感染小鼠后,也会引起神经退行性相关蛋白TDP-43表达显著升高[6]。将PHEV感染PGRN缺失鼠,检测脑内TDP-43蛋白的表达量,结果发现与未缺失的接毒小鼠相比,TDP-43的表达量显著升高,因此推测PHEV与PGRN两者呈协同作用,增强TDP-43蛋白的聚集。
总之,本研究初步证实PGRN缺失能抑制体内PHEV的复制,增强免疫反应,并影响病毒的致病性,研究结果为进一步揭示PGRN在PHEV复制过程中的作用机制提供研究基础,并为抗β冠状病毒药物研究提供参考。

