三种有机紫外吸收剂对菲律宾蛤仔(Ruditapes philippinarum)鳃组织抗氧化能力和细胞凋亡相关基因表达的影响*
张韦炜 董飞龙 荆 晨 刘尚书 胡丰晓
三种有机紫外吸收剂对菲律宾蛤仔()鳃组织抗氧化能力和细胞凋亡相关基因表达的影响*
张韦炜1, 2董飞龙1, 2荆 晨1, 2刘尚书1, 2胡丰晓1, 2①
(1. 福建农林大学海洋学院 福建福州 350002; 2. 福建省海洋生物技术重点实验室 福建福州 350002)
二苯甲酮-3 (BP-3)、4-甲基苄亚基樟脑(4-MBC)和4-甲氧基肉桂酸-2-乙基己酯(EHMC)是三种常用的有机紫外吸收剂, 在水环境中被频繁检出, 对水生生态系统安全构成潜在威胁。为探究三种有机紫外吸收剂对菲律宾蛤仔()鳃组织抗氧化响应和相关细胞凋亡基因的影响, 将蛤仔分别暴露于环境相关浓度的三种紫外吸收剂溶液中, 检测鳃组织抗氧化酶活性和细胞凋亡相关基因转录水平, 并通过第二代整合生物标志物响应法(IBRv2)对三种紫外吸收剂的生物毒性进行比较分析。结果显示, 三种紫外吸收剂短期暴露会诱导抗氧化响应提高抗氧化能力, 而长期高浓度暴露会导致抗氧化能力的降低。BP-3、4-MBC和EHMC可能通过启动线粒体途径和介导的死亡受体途径诱导菲律宾蛤仔鳃组织产生细胞凋亡。通过IBRv2分析发现, 在环境常见浓度1 μg/L的暴露水平下, 短期(1 d, 7 d)暴露时, BP-3对菲律宾蛤仔鳃组织表现出的综合毒性效应最强, 而随着暴露时间的延长(28 d), 三种紫外吸收剂表现出的综合毒性效应相近。研究结果为水环境中有机紫外吸收剂的生态风险评估提供了参考数据。
有机紫外吸收剂; 菲律宾蛤仔; 鳃; 氧化胁迫; 细胞凋亡; 整合生物标志物响应法
紫外吸收剂(UV filters)可以反射或吸收紫外辐射, 被广泛应用于防晒霜、乳液、肥皂、口红、牙膏、香水等个人护理产品(personal care products, PCPs)以及建筑材料、涂料、粘合剂、玻璃和鞋子等(Carve, 2021)。这些化合物可分为两类: 无机紫外吸收剂和有机紫外吸收剂(Langford, 2015)。有机紫外吸收剂主要通过吸收紫外来发挥作用, 其中二苯甲酮-3 (Benzophenone-3, BP-3)、4-甲基苄亚基樟脑(4-methyl- benzylidene camphor, 4-MBC)和4-甲氧基肉桂酸-2-乙基己酯(2-ethyl-hexyl-4-trimethoxycinnamate, EHMC)用途广泛且使用量巨大(Ruszkiewicz, 2017)。有机紫外吸收剂通过两种主要途径进入水生环境: 游泳等娱乐活动的直接输入和废水处理厂的间接输入。大多数有机紫外吸收剂是高度亲脂性的, 因此可以在生物体和人体中富集。
近年来, 有机紫外吸收剂污染在废水、湖泊、河流和海水以及沉积物中被频繁检出。例如, 有研究发现EHMC在处理过的废水中的浓度在0.01~0.1 mg/L之间, 在未经处理的城市废水中高达19 mg/L (Balmer, 2005)。BP-3和4-MBC在澳大利亚废水中的含量分别高达1 340和691 ng/L (O’Malley, 2020)。BP-3和EHMC在中国巢湖中的检测浓度分别达到68.4和32.2 ng/L (Tang, 2018)。在日本河流地表水中BP-3含量为16~41 ng/L之间(Kameda, 2011), 4-MBC和EHMC在维多利亚州菲利普湾河口地表水中的含量分别高达642和640 ng/L (Allinson, 2018)。4-MBC和EHMC在香港近岸海水中为98.67和55.7 ng/L (Tsui, 2015), 在台湾万里通和南海附近海水中BP-3浓度分别高达1233和55.7 ng/L (Kung, 2018; Pei, 2023)。在智利和哥伦比亚的海洋沉积物中发现BP-3、4-MBC和EHMC的最高浓度分别为2.5、7.9和17.8 ng/g(DW) (Rodil, 2009), 而EHMC在中国香港和珠江口的海洋沉积物中甚至分别达到447 ng/g和0.5 mg/g(DW) (Tsui, 2015; Huang, 2016)。以上数据显示, 这类新兴的环境污染物在水体中广泛存在, 对水生生态系统安全造成威胁。
近年来, 越来越多的研究开始关注有机紫外吸收剂BP-3、4-MBC和EHMC污染对水生动物造成的负面影响, 包括发育毒性、生殖毒性、内分泌毒性和神经毒性等。例如, 在4-MBC暴露下, 塞内加尔鳎()的体长缩短、CAT活性下降和氧化损伤增加(Araújo, 2021)。EHMC导致斑马鱼()孵化延迟、畸形增加、多种抗氧化酶活性降低(Nataraj, 2020)。BP-3和4-MBC暴露会影响大型溞()的蜕皮和发育, 并上调内分泌相关基因的表达(Lambert, 2021)。BP-3能通过MAPK/ERK信号通路诱导斑马鱼肠神经系统异常发育(Wang, 2021)。然而, 关于BP-3、4-MBC和EHMC对海洋无脊椎动物的毒性研究鲜有报道。
菲律宾蛤仔() (俗称花蛤、杂色蛤)目前已成为世界范围内的重要养殖贝类之一, 也常被用作毒理学实验对象和环境指示物种(Marisa, 2021)。鳃作为滤食性贝类的呼吸和摄食器官, 与海水直接接触, 在对外源污染物的摄入、富集和解毒代谢过程中发挥关键作用(Li, 2020)。本研究将菲律宾蛤仔暴露于不同浓度的三种有机紫外吸收剂(BP-3、4-MBC和EHMC)海水溶液中, 检测鳃组织抗氧化酶活性、脂质过氧化水平和细胞凋亡相关基因转录水平的剂量和时间特异性变化, 并通过第二代整合生物标志物响应法(IBRv2)来比较分析菲律宾蛤仔对BP-3、4-MBC和EHMC的综合毒性响应, 为典型有机紫外吸收剂对海洋无脊椎动物的毒性效应研究提供参考数据。
1 材料与方法
1.1 实验材料
有机紫外吸收剂: BP-3 (CAS#131-57-7, 纯度≥98%)、4-MBC (CAS#36861-47-9, 纯度≥98%)、EHMC (CAS#5466-77-3, 纯度≥98%)和内标BP-3-d5(纯度≥ 99%)购自西格玛奥德里奇(上海)贸易有限公司。二甲基亚砜(DMSO, 纯度≥99%)、纯水、丙酮和甲醇均购自美国Thermo公司。本研究中各组DMSO最终浓度均低于0.001%, 以避免溶剂效应的干扰(Aguirre- Martínez, 2016)。
1.2 实验动物和实验设计
菲律宾蛤仔[(3.61±0.14) cm]购自福州市西营里水产市场。在暴露实验之前, 将菲律宾蛤仔置于40 L塑料养殖箱中暂养一周, 连续曝气, 水温控制在(15±1) °C, 盐度32, pH 8.1~8.3, 溶解氧(8.0±1.0) mg/L。每日人工投喂螺旋藻粉两次[30 mg/(ind./d)]。暂养结束后, 将菲律宾蛤仔暴露于不同浓度(0、1、10和100 μg/L)的BP-3、4-MBC和EHMC海水溶液中28 d, 每组设置3个重复(每个重复50只贝)。其中, 1 μg/L为3种有机紫外吸收剂的水环境常见浓度(Balmer, 2005; Richardson, 2011), 10和100 μg/L仅能在极端环境检测到(Mao, 2019; Huang, 2021)。每天更换全部海水并加入适量的污染物, 以保持BP-3、4-MBC和EHMC的浓度相对稳定。每周采集一次水样冻于−80 °C冰箱, 留待测定紫外吸收剂的实际浓度。在暴露1 d、7 d和28 d时, 从每个平行组中随机选择10只菲律宾蛤仔, 解剖收集鳃组织, 置于−80°C中冻存。
1.3 暴露溶液中紫外吸收剂的定量
采用固相萃取法(SPE)对水样(5 mL,=3)进行富集和净化。用4 mL甲醇和LC级纯水对OASIS®HLB (500 mg, 6 mL)固相萃取柱(Waters, USA)进行预处理。在水样中加入内标BP-3-d5并将pH调整为3.0。装样后, 用5 mL水清洗试剂盒, 然后用4 mL丙酮/甲醇(1︰1,/)和6 mL甲醇洗脱, 洗脱液于1 mL水/甲醇(1︰1,/)中在氮气流(40 °C)下轻轻干燥。参照Fisch等(2021)描述的方法, 在Waters ACQUITY UPLC®H-Plus Class高效液相色谱系统与Waters® XevosTM TQ-XS质谱仪(TQ-XS/MS) (Milford, MA, USA)上进行定量分析。目标物质在色谱柱ACQUITY UPLC®C18 (2.1 mm×50 mm, 1.7 μm粒径) (Waters, Ireland)上进行色谱分离。BP-3、4-MBC和EHMC的平均回收率分别为89%、92%和97%。BP-3、4-MBC和EHMC的检出限定义为信噪比3︰1, 分别为1.5、4.2和1.5 ng/L。
1.4 鳃组织氧化应激相关指标检测
称取100 mg鳃组织, 将样品加入液氮后研磨, 根据质量体积比加入9倍预冷的PBS缓冲液, 旋涡振荡器充分混匀, 制备组织匀浆液。冰上静置5 min后, 3 000 r/min、4 °C离心10 min, 取上清液用于酶活性检测。超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPx)和谷胱甘肽S转移酶(GST)活性以及谷胱甘肽还原酶(GSH)、丙二醛(MDA)含量的测定均采用比色法, 所用检测试剂盒均购自南京建成生物工程研究所。
1.5 荧光定量PCR
鳃组织总RNA采用Fast Pure® Cell/Tissue Total RNA Isolation Kit V2 (南京诺唯赞生物科技有限公司)试剂盒提取。RNA完整性通过1%琼脂糖凝胶电泳检测, 纯度用NanoDrop ND-2000c仪器(赛默飞世尔科技公司)进行定量。使用HiScript® Ⅱ Q RT SuperMix for qPCR (gDNA wiper) (南京诺唯赞生物科技股份有限公司)逆转录试剂盒将RNA进行反转录获得cDNA模板。使用ChamQTM Universal SYBR® qPCR Master Mix 试剂盒(南京诺唯赞生物科技股份有限公司)在Roche Light Cycle® 480 Ⅱ荧光定量PCR仪(瑞士罗氏)上进行qPCR反应。以作为内参基因, 采用2–ΔΔCt法来计算目的基因的相对表达量(Livak, 2001; Volland, 2017)。引物通过NCBI网站的在线工具Primer-Blast设计, 目标及内参基因的引物序列见表1。
表1 引物序列

Tab.1 The primer sequences
1.6 第二代整合生物标志物响应法(IBRv2)
整合生物标志物响应法(Integrated Biomarker Response, IBR)由法国生态毒理学家Benoit Beliaeff和Thierry Burgeot首创, 经过Wilfried Sanchez等改良后形成IBRv2法, 用于全面评估各种毒理因子对生物的毒害效应。本研究将SOD、CAT、GPx、GST的酶活性和GSH、MDA含量, 以及、、、、和基因转录水平这12个指标全部带入, 计算菲律宾蛤仔鳃组织的IBRv2指数。
计算方法如下:
(1) 数值标准化
Y= lg(X/0), (1)
其中,X为某一生物标志物在某暴露条件下的均值,0为对照组平均值,Y为标准化值。
(2) 数值均一化
Z= (Y–) /, (2)
其中,为所有暴露条件下的总均值,为所有暴露条件下的总标准差,Z为均一化值。
(3) 赋值
=Z–0, (3)
其中,0为对照组某生物标志物均一化值,为某生物标志物在某暴露条件下的生物标志物偏差系数, 正值代表诱导, 负值代表抑制。
(4) 计算IBRv2值
IBRv2 =Σ|/. (4)
1.7 数据统计分析
本研究所有数据分析均通过SPSS 20.0 (SPSS, Chicago, IL, USA)实验数据表示为平均值±标准差(mean±S.D.)。数据的方差齐性和正态性首先采用Kolmogorov-Smirnov检验和Levene’s检验。对照组与实验组间的数据差异采用单因素方差分析(One-way ANOVA), 差异显著性通过Tukey’s HSD检验, 显著性水平为<0.05。
2 结果
2.1 暴露溶液中紫外吸收剂水平分析
暴露溶液中紫外吸收剂的实际浓度见表2。结果表明, 实际的BP-3水平相对稳定, 与暴露试验期间的BP-3标定浓度接近; 换水后4-MBC的测量浓度基本与标准值相当, 而在下一次换水前4-MBC的测量浓度下降了约20%; EHMC换水前、后实际暴露浓度分别为标定浓度的50%~95.3%和30%~68.9%。
表2 暴露溶液中的紫外吸收剂浓度
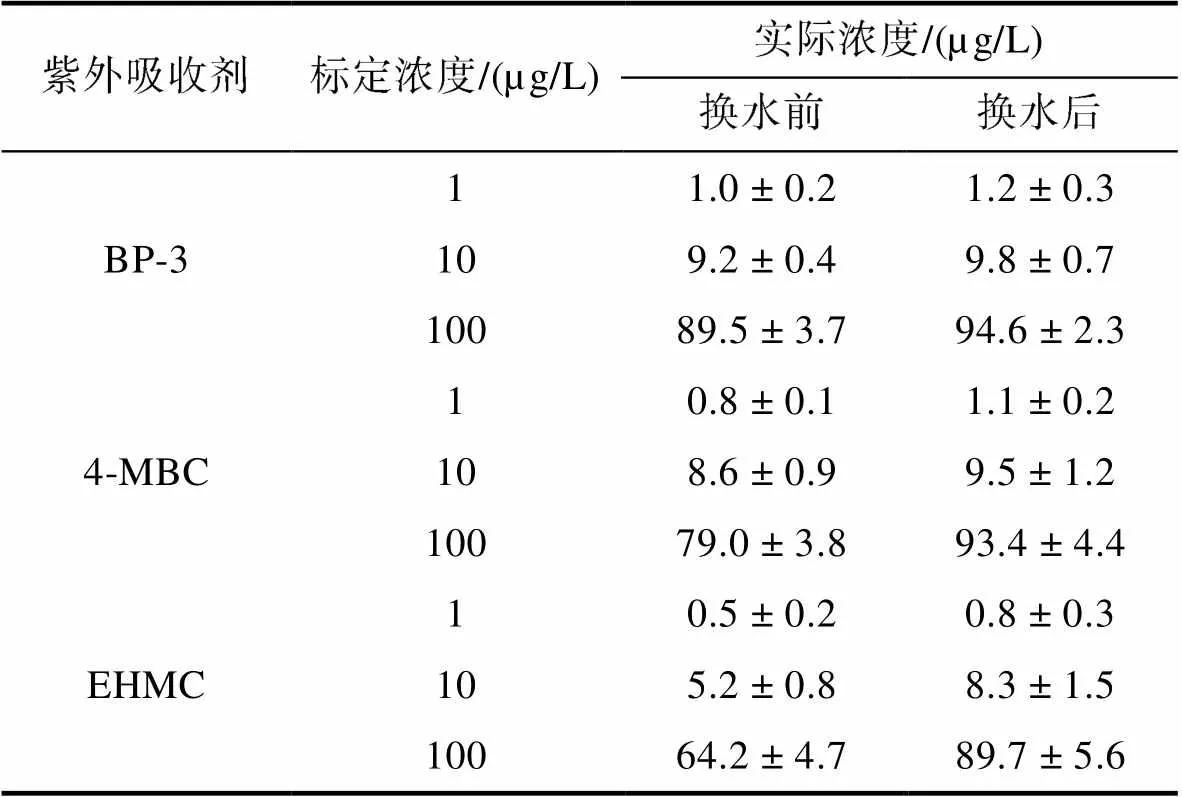
Tab.2 Concentrations of UV filters in exposure solutions
2.2 鳃组织抗氧化酶活性分析
如图1所示, 在BP-3、4-MBC和EHMC胁迫下, 鳃组织SOD活性在1 d时显著上升(<0.05), 随着暴露时间的延长恢复到接近或低于对照组水平(除1 μg/L 4-MBC组暴露28 d仍高于对照组水平)(<0.05)。BP-3和4-MBC暴露1 d时CAT活性受到明显抑制(<0.05), 7 d和28 d时恢复到对照组水平, 而EHMC暴露对CAT活性无显著影响。在BP-3、4-MBC和EHMC胁迫下, 鳃组织GPx活性在1 d和7 d时无显著变化(除1 μg/L BP-3组暴露7 d仍高于对照组水平), 随着暴露时间的延长, GPx活性低于对照组水平(<0.05)。4-MBC暴露1 d时GSH含量显著下降, 随着暴露时间的延长, GSH含量恢复到接近或低于对照组水平(除1 μg/L 4-MBC组暴露28 d仍高于对照组水平) (<0.05); 而在BP-3和EHMC胁迫下, 鳃组织GSH含量在1 d时无显著变化, 随着暴露时间的延长, GSH含量恢复到接近或低于对照组水平(除1 μg/L BP-3组暴露7 d仍高于对照组水平) (<0.05)。BP-3、4-MBC和EHMC暴露对GST活性无显著影响(除1 μg/L EHMC组暴露7 d低于对照组水平)。
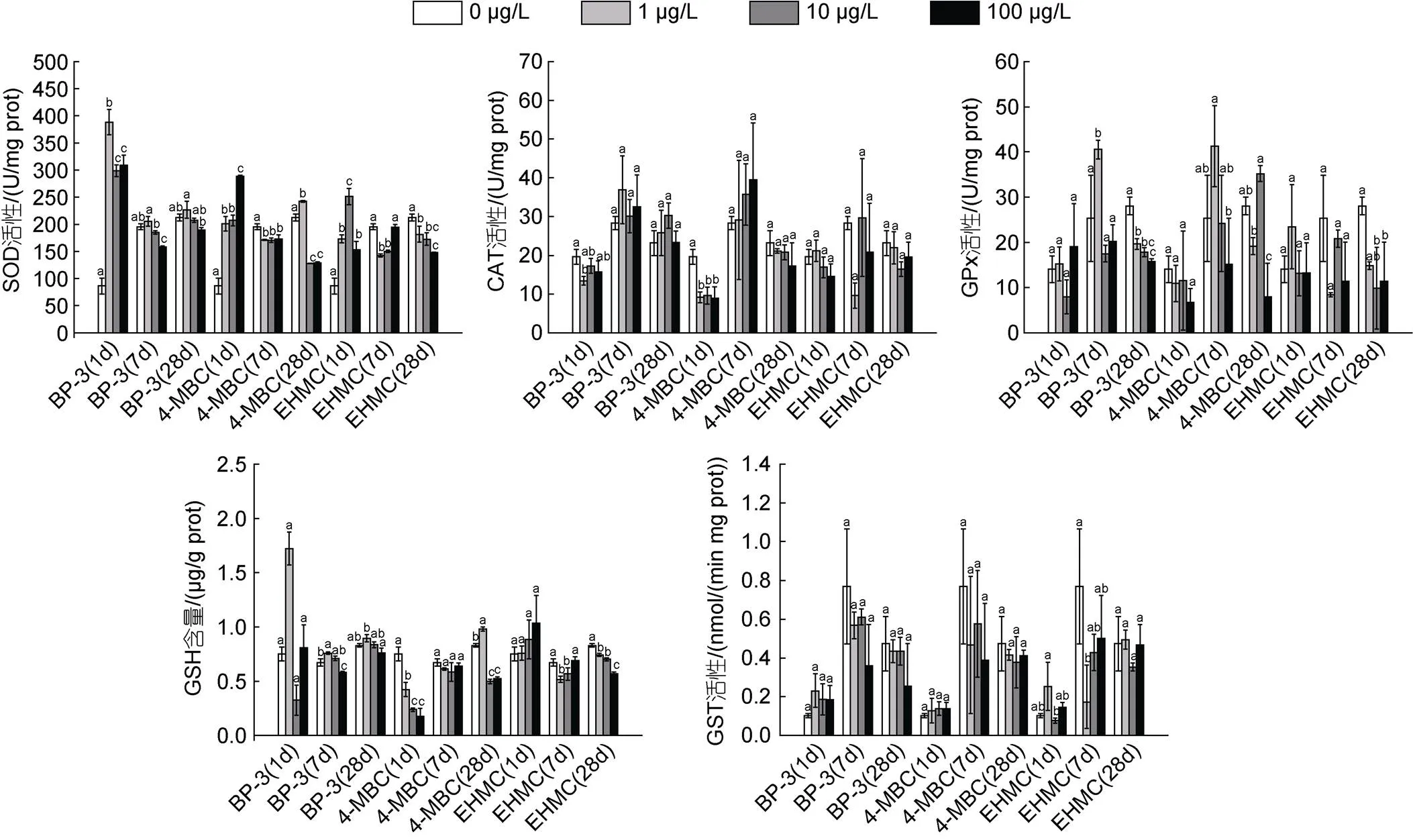
图1 不同浓度的BP-3、4-MBC和EHMC暴露及不同暴露阶段对菲律宾蛤仔鳃SOD、CAT、GPx、GST活性和GSH含量的影响(1 d、7 d和28 d)
注: 不同字母表示组间显著性差异(<0.05)。下同
2.3 鳃组织MDA含量分析
与对照组相比, BP-3 (100 μg/L)和4-MBC (10和100 μg/L)暴露组在1 d时MDA含量显著降低(<0.05), 而随着暴露时间延长, BP-34-MBC和EHMC各暴露组与对照组相比无显著性差异(图2)。
2.4 鳃组织细胞凋亡相关基因表达分析
如图3所示, 在BP-3、4-MBC和EHMC胁迫下, 鳃组织(除10 μg/L BP-3组、1 μg/L 4-MBC组显著上调)(除100 μg/L EHMC组显著上调)基因相对表达量在1 d时显著下调(<0.05), 7 d时(除10 μg/L EHMC组显著下调)(除各浓度BP-3组显著下调)(除1、10 μg/L BP-3组显著下调)基因相对表达量显著上调(<0.05)。BP-3、4-MBC和EHMC暴露1 d时基因相对表达量显著下调(<0.05), 随着暴露时间的延长恢复到接近或高于对照组水平(除各浓度组BP-3暴露7 d低于对照组水平) (<0.05)。在BP-3和4-MBC胁迫下, 鳃组织基因相对表达量在1 d时显著下调(除10 μg/L BP-3组显著上调) (<0.05), 随着暴露时间的延长恢复到接近或高于对照组水平(<0.05); 而EHMC暴露7 d下调了基因相对表达量(除100 μg/L EHMC组显著上调) (<0.05), 28 d时高于对照组水平(<0.05)。BP-3暴露1 d和7 d时下调了基因相对表达量(<0.05), 暴露至28 d时则高于对照组水平(<0.05); 在4-MBC和EHMC胁迫下, 鳃组织基因相对表达量在7 d时显著上调(<0.05), 28 d时显著下调(<0.05)。
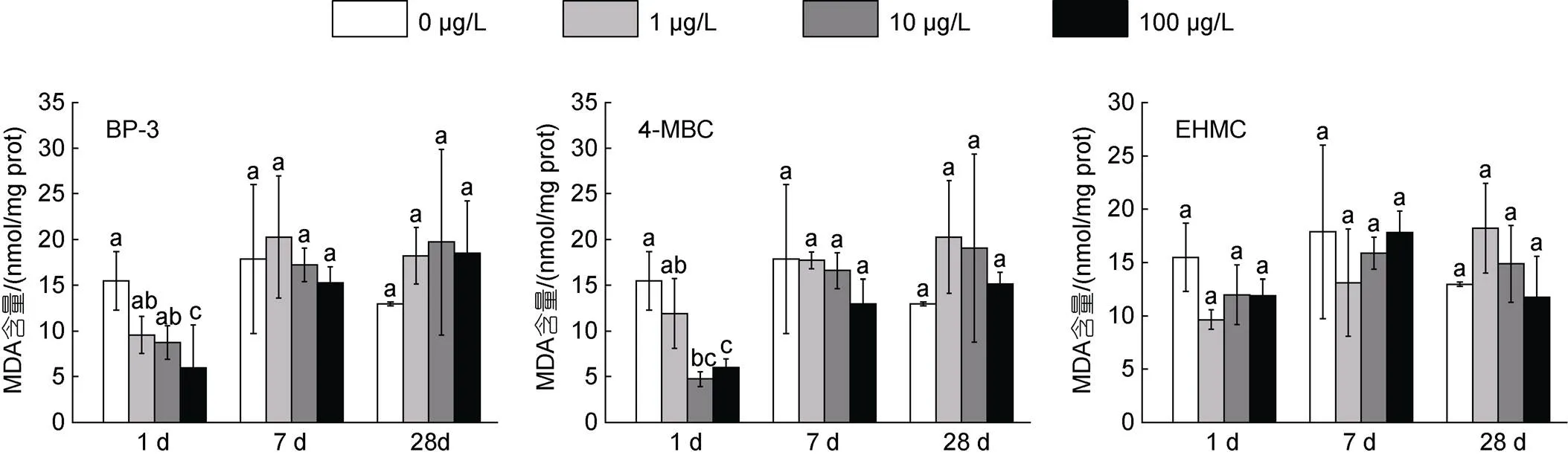
图2 不同浓度的BP-3、4-MBC和EHMC暴露及不同暴露阶段对菲律宾蛤仔鳃MDA含量的影响(1 d、7 d和28 d)

图3 不同浓度的BP-3、4-MBC和EHMC暴露及不同暴露阶段对菲律宾蛤仔鳃细胞凋亡相关基因p53、gadd45、cdk、fas、caspase-2和bcl-2表达量的影响(1 d、7 d和28 d)
2.5 IBRv2分析
如图4所示, 雷达图展示出不同浓度的三种紫外吸收剂暴露1、7和28 d菲律宾蛤仔鳃中生物标志物的偏差系数, 反映出不同生物标志物对不同浓度紫外吸收剂暴露的响应差异。结果发现, 暴露于1 μg/L的三种紫外吸收剂中, 1 d时SOD活性、GSH含量和转录水平变化幅度较大; 7 d时和转录水平变化幅度较大; 28 d时和转录水平变化幅度较大。暴露于10 μg/L的三种紫外吸收剂中, 1 d时主要是GSH含量变化幅度最大; 7 d时GST活性、和转录水平变化幅度较大; 28 d时CAT和GPx活性以及转录水平变化幅度较大。暴露于100 μg/L的三种紫外吸收剂中, 1 d时主要是MDA含量变化幅度最大; 7 d时主要是GPx和GST活性以及转录水平变化幅度较大; 28 d时主要是GPx活性和转录水平变化幅度较大。
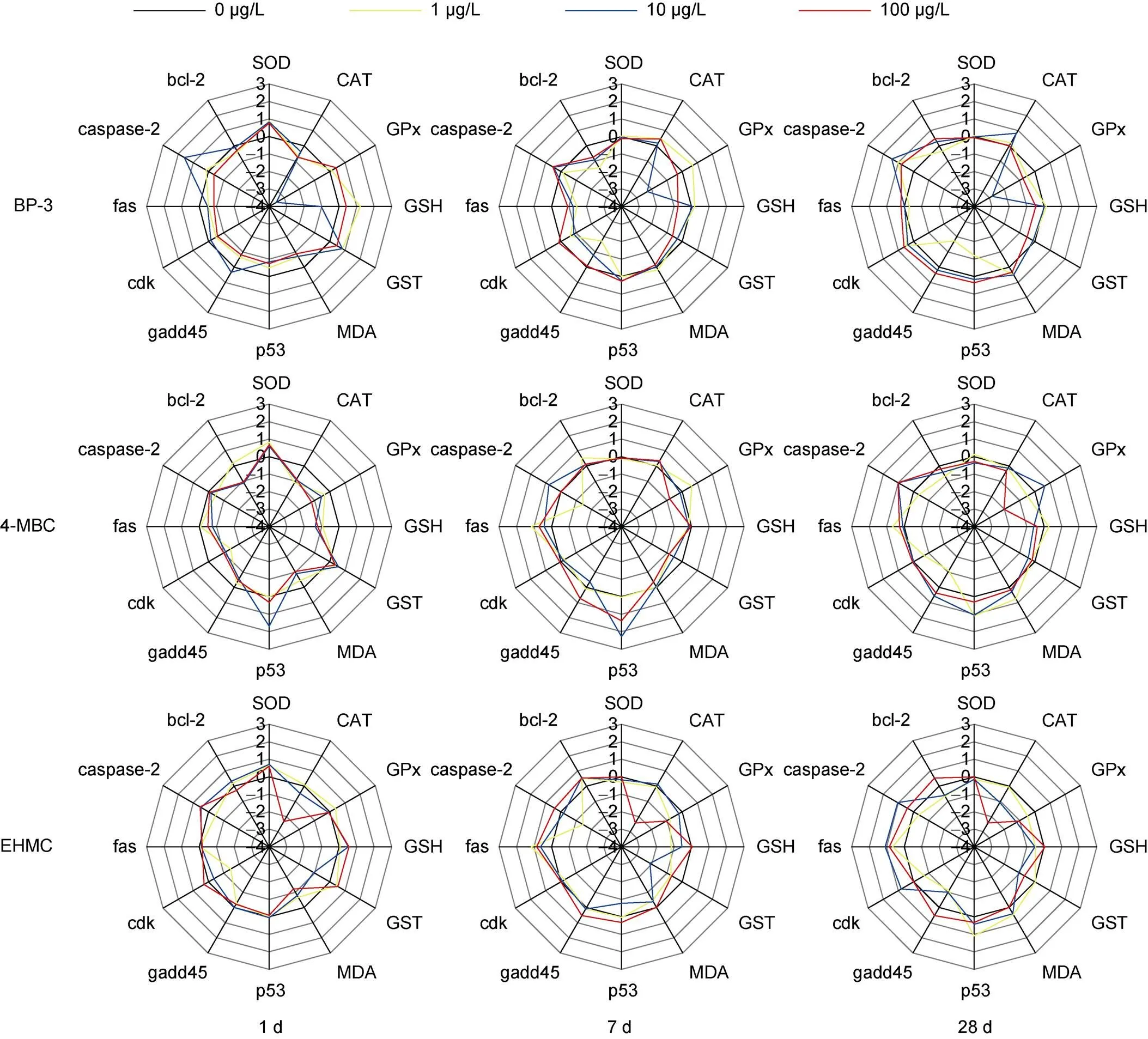
图4 不同浓度的BP-3、4-MBC和EHMC暴露及不同暴露阶段菲律宾蛤仔鳃组织生物标志物偏差系数(1 d、7 d和28 d)
对环境常见浓度1 μg/L的三种紫外吸收剂暴露下菲律宾蛤仔鳃组织的12种生物标志物响应的偏差系数绝对值进行求和, 得到1 μg/L三种紫外吸收剂在暴露1 d、7 d和28 d的IBRv2指数(图5)。结果显示, 三种紫外吸收剂的IBRv2值在暴露1 d时为BP-3 (1.20) > 4-MBC (1.08) > EHMC (0.79); 暴露7 d时为BP-3 (1.21) > EHMC (0.89) > 4-MBC (1.18); 暴露28 d时为BP-3 (1.09) ≈ 4-MBC (1.10) ≈ EHMC (1.04)。
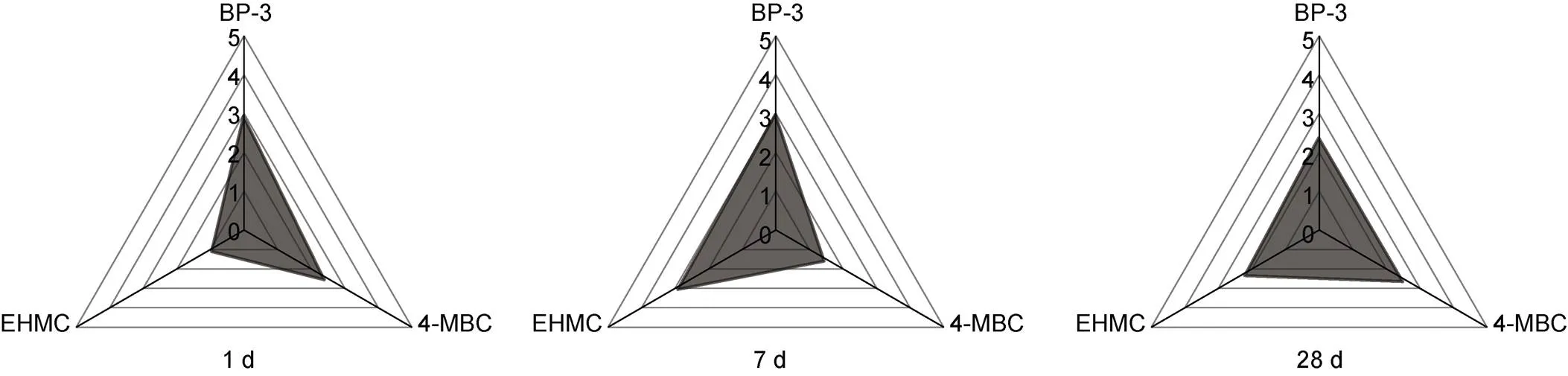
图5 1 μg/L BP-3、4-MBC和EHMC暴露下菲律宾蛤仔鳃组织的第二代整合生物标志物响应(IBRv2)指数(1 d、7 d和28 d)
3 讨论
由于有机紫外吸收剂的广泛使用、在水环境中的普遍存在和潜在的生态毒性效应, 近年来它们潜在的生态风险已成为环境领域的研究热点(Kwon, 2021)。然而, 目前有关有机紫外吸收剂对海洋无脊椎动物的毒性效应研究鲜见报道。本研究从诱导氧化应激和细胞凋亡两方面阐释BP-3、4-MBC和EHMC三种有机紫外吸收剂对菲律宾蛤仔鳃组织的毒性效应, 旨在揭示常见有机紫外吸收剂对海洋无脊椎动物的生态风险。
抗氧化系统可以通过酶和非酶调节保护生物体免受氧化损伤并维持氧化还原平衡(Birnie-Gauvin, 2017)。SOD和CAT是动物体内抗氧化应激的第一道防线, SOD可以加速自由基转化为H2O2, CAT能够将H2O2分解成水, 从而清除ROS减少机体氧化应激损伤(Lesser, 2006)。在本研究中, 三种紫外吸收剂短期暴露显著诱导了鳃组织SOD酶活性升高, 随着暴露时间延长SOD酶活性恢复到接近或低于对照组水平, 并且高浓度暴露组的抑制作用更加显著, 表现出明显的时间和剂量特异性变化, 这与高浓度BP-3暴露28 d后的鲫鱼组织SOD活性下降的结果一致(Liu, 2015)。本研究发现短期的BP-3和4-MBC暴露会抑制鳃中CAT活性, 随着暴露时间的延长, 所有处理组的CAT活性均与对照组无显著性差异。Campos等(2017)将摇蚊四龄幼虫()暴露于4-MBC中48 h后也观察到CAT活性下降。长时间暴露下, CAT活性的恢复可能是机体面对紫外吸收剂诱导的氧化应激产生的适应性响应(Zhang, 2014a)。一项近期研究同样发现, 4-MBC暴露15 d后不会导致斑马鱼5 dpf (days post fertilization, 受精后天数)幼虫的CAT活性变化(Prakash, 2022)。GPx和GSH一起参与H2O2的分解, 作为共同底物清除过多的ROS来防止氧化性细胞损伤(Binelli, 2011)。有研究表明, 暴露于BP-34-MBC和EHMC的嗜热四膜虫() GPx活性在24 h后均未见明显变化, 这与本研究结果一致(Gao, 2013)。但是在28 d时暴露于100 μg/L的3种紫外吸收剂的鳃中GPx活性显著降低, 这与BP-3暴露30 d后的斑马鱼GPx活性显著降低结果一致(Velanganni, 2021), 这些结果显示紫外吸收剂长期暴露会导致GPx活性下降, 并表现出明显的时间依赖性。此外, 在本研究中高浓度的4-MBC和EHMC暴露28 d时, 会导致鳃中GSH含量显著下降。作为维持细胞内氧化还原平衡的重要物质, GSH含量的减少会破坏机体的抗氧化防御系统, 导致氧化应激(Lushchak, 2012)。GST是一种Ⅱ相代谢酶, 能催化外源物质与GSH结合, 加速排出体外从而达到解毒代谢的目的。本研究发现在整个暴露期间, 大多数浓度组的GST活性均无显著变化。与本研究结果相似, 有研究报道将摇蚊四龄幼虫暴露在不同浓度BP-3或OC中, 48 h内同样未观察到GST活性显著变化(Campos, 2017)。这些结果说明GST可能不是典型有机紫外吸收剂污染的敏感生物标志物。
MDA是膜脂过氧化的最终分解产物, 其含量变化可反映膜系统遭受氧化伤害的程度。本研究发现在100 μg/L的BP-3和4-MBC暴露1 d时菲律宾蛤仔鳃中MDA含量显著降低, 7 d和28 d时无显著性变化。与本研究结果相似, 有学者将10 μg/L的BP-3胁迫黄尾蓝魔鱼7 d后, 在其肝脏内未观察到MDA含量显著变化(柯怀泱等, 2022)。本研究结果说明紫外吸收剂短期暴露会提高抗氧化防御能力, 降低脂质过氧化水平; 随着暴露时间延长, 机体面对有机紫外吸收剂引起的氧化应激做出适应性防御, 导致鳃中脂质过氧化水平恢复至对照组水平。
细胞凋亡是一种基因调控的能使细胞产生主动而有序的死亡的细胞自杀机制, 主要分为内源性途径[线粒体途径和内质网(ER)应激诱导途径]和外源性途径(死亡受体途径) (Redza-Dutordoir, 2016)。本研究发现三种紫外吸收剂暴露可能通过线粒体途径和介导的死亡受体途径诱导菲律宾蛤仔鳃组织细胞凋亡。
可调控多个下游基因的转录, 包括、、等, 诱导线粒体途径介导的细胞凋亡。肿瘤抑制基因能阻滞细胞周期、促进细胞凋亡(魏永永等, 2012)。是调控的生长停滞和DNA损伤诱导型基因, 其可介导DNA修复、细胞周期停滞和细胞凋亡。能控制细胞周期进程。抗凋亡成员在线粒体外膜发挥作用, 以保持膜的完整性。本研究结果显示, 长期暴露于高浓度的三种紫外吸收剂中, 鳃内基因相对表达量显著上调并呈浓度依赖性升高, 这表明紫外吸收剂暴露可导致的激活, 从而通过线粒体途径诱导细胞凋亡。本研究发现暴露于100 μg/L三种紫外吸收剂1 d时菲律宾蛤仔鳃内和基因相对表达量显著下调, 而随着暴露时间延长显著上调。有研究报道下调能促进细胞补偿性增殖;上调在一定程度上能降低细胞凋亡比例(Zhang, 2014b; 吕童歆等, 2023)。此外, 先前研究发现将菲律宾蛤仔暴露于高浓度4-MBC (10和100 μg/L) 7 d时编码基因显著高表达(Santonocito, 2020)。这些下游基因的显著表达可能和被激活有关, 进一步说明和参与线粒体途径的细胞凋亡(曾小莉, 1999; Schade, 2019)。此外,可以通过调节Bcl-2家族基因的转录, 调控细胞凋亡(Wei, 2021)。Bcl-2是这个家族中抗凋亡因子, 主要存在于线粒体膜上, 通过与促凋亡因子Bax形成二聚体从而起到抑制凋亡的作用(Czabotar, 2014)。在本研究中, 暴露于高浓度4-MBC和EHMC (10和100 μg/L)7 d时鳃内基因相对表达量显著上调。与此相似, 在10和100 μg/L的4-MBC暴露7 d后, 菲律宾蛤仔消化腺中基因表达量显著增加(Santonocito, 2020)。因此, 机体可能通过上调的转录表达来抑制紫外吸收剂短期暴露导致的细胞凋亡。有研究表明, 丙硫菌唑通过上调表达, 下调基因转录来诱导斑马鱼胚胎细胞凋亡(Shen, 2021), 这与本研究28 d时观察到鳃组织内基因的上调表达和基因转录水平下降的结果一致。这些结果表明, 长期高浓度的4-MBC和EHMC暴露能激活通路, 削弱的转录表达, 诱导线粒体途径的细胞凋亡。而在本研究中, BP-3暴露组抗细胞凋亡基因相对表达量短期内显著下调, 继续暴露至28 d时则显著上调。这结果表明, 长期暴露于BP-3后, 菲律宾蛤仔可能通过上调鳃内表达来阻遏细胞凋亡(Novo, 2006)。
介导的细胞凋亡途径是重要的死亡受体信号转导途径之一(Pallepati, 2011)。是癌细胞中应激诱导的细胞凋亡所需的起始Caspase, 与等的表达密切相关(Zhivotovsky, 2005; Baptiste-Okoh, 2008)。在本研究中, 暴露1 d时100 μg/L的4-MBC和EHMC显著下调了鳃内基因相对表达量, 但在7 d和28 d时均被显著诱导, 这说明被胞外刺激激活向胞内传递更多信号来诱导细胞凋亡(Elmore, 2007)。有研究报道H2O2暴露后, 奶牛子宫内膜细胞中基因表达量显著上调, 而抑制基因表达在一定程度上能降低氧化应激诱导的细胞凋亡比例(靳青等, 2022)。因此, 本研究中有机紫外吸收剂也可能是通过上调的表达从而激活死亡受体途径诱导细胞凋亡。此外, 本研究结果发现, 菲律宾蛤仔暴露于100 μg/L的BP-3和4-MBC 1d时鳃组织中基因相对表达量显著下调, 而暴露于10 μg/L和100 μg/L三种紫外吸收剂28 d时鳃内基因相对表达量显著上调。同样, 朱含开等(2008)发现五氯酚暴露能引起斑马鱼胚胎表达上调增加细胞凋亡。已有研究证实, 通过膜的死亡受体作用,被细胞外部因子活化后激活, 诱导死亡受体途径的细胞凋亡; 这两种还可通过Bid裂解激活线粒体途径(Pallepati, 2010)。综上所述, 本研究结果表明, 三种紫外吸收剂的长期暴露可上调鳃内和表达, 既能激活死亡受体途径诱导细胞凋亡, 又可增加线粒体途径介导的细胞凋亡。
第二代整合生物标志物响应法(IBRv2)是目前生态毒理学领域表征某种污染物对受试生物的综合毒性效应常用的研究方法。本研究中通过与参照值比较多种生物标志物的偏差系数发现, 12种不同生物标志物对BP-3、4-MBC和EHMC的响应情况有明显差异。暴露在环境常见浓度1 μg/L的三种紫外吸收剂1 d时, SOD活性、GSH含量和转录水平指标变化幅度大, 而7 d和28 d、、和转录水平指标变化幅度较大, 这表明紫外吸收剂短期暴露主要引起氧化胁迫响应, 而随着暴露时间的延长, 主要的生物学响应与细胞凋亡有关。此外, 本研究发现, 在环境常见浓度1 μg/L的三种紫外吸收剂短期暴露下, BP-3表现出最强的毒性效应, 而随着暴露时间的延长, 三种紫外吸收剂表现出相近的毒性效应。
4 结论
本研究结果表明, 短期暴露于有机紫外吸收剂会诱导菲律宾蛤仔鳃组织抗氧化响应, 而长期高浓度暴露则会削弱其抗氧化防御能力。BP-3、4-MBC和EHMC可能通过激活线粒体途径和介导的死亡受体途径从而诱导菲律宾蛤仔鳃组织细胞凋亡。IBRv2分析发现短期暴露环境常见浓度1 μg/L时, BP-3表现出的综合毒性效应最强。本研究结果为典型有机紫外吸收剂BP-3、4-MBC和EHMC的生态风险评估以及对海洋无脊椎动物的毒性机制研究提供了重要参考。
吕童歆, 巩双铭, 李磊, 2023. 细胞周期蛋白依赖性激酶及其在肿瘤治疗中的意义[J]. 生物学教学, 48(3): 5-8.
朱含开, 吴兆毅, 赵庆顺, 等, 2008. 五氯酚暴露诱导斑马鱼胚胎细胞凋亡相关基因的变化及caspase-2基因克隆和系统进化分析[J]. 生态毒理学报, 3(4): 356-362.
柯怀泱, 张彦坤, 张纪亮, 等, 2022. 二苯甲酮(BP-3)对黄尾蓝魔鱼()的生态毒理效应[J]. 生态毒理学报, 17(5): 75-81.
曾小莉, 1999. 细胞凋亡基因调控机制研究进展[J]. 国外医学临床生物化学与检验学分册, 20(2): 80-82.
靳青, 张相伦, 魏晨, 等, 2022. 氧化应激通过Fas/FasL信号通路调控奶牛子宫内膜细胞凋亡[J]. 畜牧兽医学报, 53(6): 1819-1828.
魏永永, 侯静, 唐文如, 等, 2012. p53与Ras协同及其在肿瘤发生中的作用[J]. 遗传, 34(12): 1513-1521.
AGUIRRE-MARTÍNEZ G V, DELVALLS T A, MARTÍN-DÍAZ M L, 2016. General stress, detoxification pathways, neurotoxicity and genotoxicity evaluated inexposed to human pharmaceuticals [J]. Ecotoxicology and Environmental Safety, 124: 18-31.
ALLINSON M, KAMEDA Y, KIMURA K,, 2018. Occurrence and assessment of the risk of ultraviolet filters and light stabilizers in Victorian estuaries [J]. Environmental Science and Pollution Research, 25(12): 12022-12033.
ARAÚJO M J, SOARES A M V M, MONTEIRO M S, 2021. Effects of exposure to the UV-filter 4-MBC duringmetamorphosis [J]. Environmental Science and Pollution Research, 28(37): 51440-51452.
BALMER M E, BUSER H R, MÜLLER M D,, 2005. Occurrence of some organic UV filters in wastewater, in surface waters, and in fish from Swiss lakes [J]. Environmental Science & Technology, 39(4): 953-962.
BAPTISTE-OKOH N, BARSOTTI A M, PRIVES C, 2008. Caspase 2 is both required for p53-mediated apoptosis and downregulated by p53 in a p21-dependent manner [J]. Cell Cycle, 7(9): 1133-1138.
BINELLI A, PAROLINI M, PEDRIALI A,, 2011. Antioxidant activity in the zebra mussel () in response to triclosan exposure [J]. Water, Air, & Soil Pollution, 217(1/2/3/4): 421-430.
BIRNIE-GAUVIN K, COSTANTINI D, COOKE S J,, 2017. A comparative and evolutionary approach to oxidative stress in fish: a review [J]. Fish and Fisheries, 18(5): 928-942.
CAMPOS D, GRAVATO C, QUINTANEIRO C,, 2017. Toxicity of organic UV-filters to the aquatic midge[J]. Ecotoxicology and Environmental Safety, 143: 210-216.
CARVE M, NUGEGODA D, ALLINSON G,, 2021. A systematic review and ecological risk assessment for organic ultraviolet filters in aquatic environments [J]. Environmental Pollution, 268: 115894.
CZABOTAR P E, LESSENE G, STRASSER A,, 2014. Control of apoptosis by the BCL-2 protein family: implications for physiology and therapy [J]. Nature Reviews Molecular Cell Biology, 15(1): 49-63.
ELMORE S, 2007. Apoptosis: a review of programmed cell death [J]. Toxicologic Pathology, 35(4): 495-516.
FISCH K, ZHANG R, ZHOU M,, 2021. PPCPs-A human and veterinary fingerprint in the Pearl River Delta and northern South China Sea [J]. Emerging Contaminants, 7: 10-21.
GAO L, YUAN T, ZHOU C Q,, 2013. Effects of four commonly used UV filters on the growth, cell viability and oxidative stress responses of the[J]. Chemosphere, 93(10): 2507-2513.
HUANG Y R, LAW J C F, LAM T K,, 2021. Risks of organic UV filters: A review of environmental and human health concern studies [J]. Science of the Total Environment, 755: 142486.
HUANG W X, XIE Z Y, YAN W,, 2016. Occurrence and distribution of synthetic musks and organic UV filters from riverine and coastal sediments in the Pearl River estuary of China [J]. Marine Pollution Bulletin, 111(1/2): 153-159.
KAMEDA Y, KIMURA K, MIYAZAKI M, 2011. Occurrence and profiles of organic sun-blocking agents in surface waters and sediments in Japanese rivers and lakes [J]. Environmental Pollution, 159(6): 1570-1576.
KUNG T A, LEE S H, YANG T C,, 2018. Survey of selected personal care products in surface water of coral reefs in Kenting National Park, Taiwan [J]. Science of the Total Environment, 635: 1302-1307.
KWON B, CHOI K, 2021. Occurrence of major organic UV filters in aquatic environments and their endocrine disruption potentials: a mini-review [J]. Integrated Environmental Assessment and Management, 17(5): 940-950.
LAMBERT F N, GRACY H R, GRACY A J,, 2021. Effects of ultraviolet-filters ondevelopment and endocrine-related gene expression [J]. Aquatic Toxicology, 238: 105915.
LANGFORD K H, REID M J, FJELD E,, 2015. Environmental occurrence and risk of organic UV filters and stabilizers in multiple matrices in Norway [J]. Environment International, 80: 1-7.
LESSER M P, 2006. Oxidative stress in marine environments: biochemistry and physiological ecology [J]. Annual Review of Physiology, 68: 253-278.
LI Z L, FENG C H, WU Y H,, 2020. Impacts of nanoplastics on bivalve: Fluorescence tracing of organ accumulation, oxidative stress and damage [J]. Journal of Hazardous Materials, 392: 122418.
LIU H, SUN P, LIU H X,, 2015. Hepatic oxidative stress biomarker responses in freshwater fishexposed to four benzophenone UV filters [J]. Ecotoxicology and Environmental Safety, 119: 116-122.
LIVAK K J, SCHMITTGEN T D, 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCTmethod [J]. Methods, 25(4): 402-408.
LUSHCHAK V I, 2012. Glutathione homeostasis and functions: potential targets for medical interventions [J]. Journal of Amino Acids, 2012: 736837.
MAO F J, HE Y L, GIN K Y H, 2019. Occurrence and fate of benzophenone-type UV filters in aquatic environments: a review [J]. Environmental Science: Water Research & Technology, 5(2): 209-223.
MARISA I, ASNICAR D, MATOZZO V,, 2021. Toxicological effects and bioaccumulation of fullerene C60(FC60) in the marine bivalve[J]. Ecotoxicology and Environmental Safety, 207(7): 111560.
NATARAJ B, MAHARAJAN K, HEMALATHA D,, 2020. Comparative toxicity of UV-filter Octyl methoxycinnamate and its photoproducts on zebrafish development [J]. Science of the Total Environment, 718: 134546.
NOVO E, MARRA F, ZAMARA E,, 2006. Overexpression of Bcl-2 by activated human hepatic stellate cells: resistance to apoptosis as a mechanism of progressive hepatic fibrogenesis in humans [J]. Gut, 55(8): 1174-1182.
O’MALLEY E, O’BRIEN J W, VERHAGEN R,, 2020. Annual release of selected UV filters via effluent from wastewater treatment plants in Australia [J]. Chemosphere, 247: 125887.
PALLEPATI P, AVERILL-BATES D, 2010. Mild thermotolerance induced at 40 °C increases antioxidants and protects HeLa cells against mitochondrial apoptosis induced by hydrogen peroxide: role of p53 [J]. Archives of Biochemistry and Biophysics, 495(2): 97-111.
PALLEPATI P, AVERILL-BATES D A, 2011. Mild thermotolerance induced at 40 °C protects HeLa cells against activation of death receptor-mediated apoptosis by hydrogen peroxide [J]. Free Radical Biology and Medicine, 50(6): 667-679.
PEI J Y, HU J J, ZHANG R J,, 2023. Occurrence, bioaccumulation and ecological risk of organic ultraviolet absorbers in multiple coastal and offshore coral communities of the South China Sea [J]. Science of the Total Environment, 868: 161611.
PRAKASH V, JAIN V, CHAUHAN S S,, 2022. Developmental toxicity assessment of 4-MBC inembryo-larval stages [J]. Science of the Total Environment, 804: 149920.
REDZA-DUTORDOIR M, AVERILL-BATES D A, 2016. Activation of apoptosis signalling pathways by reactive oxygen species [J]. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research, 1863(12): 2977-2992.
RICHARDSON S D, TERNES T A, 2011. Water analysis: emerging contaminants and current issues [J]. Analytical Chemistry, 83(12): 4614-4648.
RODIL R, SCHRADER S, MOEDER M, 2009. Non-porous membrane-assisted liquid–liquid extraction of UV filter compounds from water samples [J]. Journal of Chromatography A, 1216(24): 4887-4894.
RUSZKIEWICZ J A, PINKAS A, FERRER B,, 2017. Neurotoxic effect of active ingredients in sunscreen products, a contemporary review [J]. Toxicology Reports, 4: 245-259.
SANTONOCITO M, SALERNO B, TROMBINI C,, 2020. Stress under the sun: Effects of exposure to low concentrations of UV-filter 4-methylbenzylidene camphor (4-MBC) in a marine bivalve filter feeder, the Manila clam[J]. Aquatic Toxicology, 221: 105418.
SCHADE A E, FISCHER M, DECAPRIO J A, 2019. RB, p130 and p107 differentially repress G1/S and G2/M genes after p53 activation [J]. Nucleic Acids Research, 47(21): 11197-11208.
SHEN J, LIU P, SUN Y Q,, 2021. Embryonic exposure to prothioconazole induces oxidative stress and apoptosis in zebrafish () early life stage [J]. Science of the Total Environment, 756: 143859.
TANG Z W, HAN X, LI G H,, 2018. Occurrence, distribution and ecological risk of ultraviolet absorbents in water and sediment from Lake Chaohu and its inflowing rivers, China [J]. Ecotoxicology and Environmental Safety, 164: 540-547.
TSUI M M P, LEUNG H W, KWAN B K Y,, 2015. Occurrence, distribution and ecological risk assessment of multiple classes of UV filters in marine sediments in Hong Kong and Japan [J]. Journal of Hazardous Materials, 292: 180-187.
VELANGANNI S, SIVAKUMAR P, MILTONPRABU S, 2021. Impact of environmentally relevant concentration of benzophenone-3 on antioxidant enzymes, oxidative stress markers and morphology of gills in(Hamilton) [J]. GSC Biological and Pharmaceutical Sciences, 14(3): 189-196.
VOLLAND M, BLASCO J, HAMPEL M, 2017. Validation of reference genes for RT-qPCR in marine bivalve ecotoxicology: systematic review and case study using copper treated primaryhemocytes [J]. Aquatic Toxicology, 185: 86-94.
WANG J, MENG X Y, FENG C Z,, 2021. Benzophenone-3 induced abnormal development of enteric nervous system in zebrafish through MAPK/ERK signaling pathway [J]. Chemosphere, 280: 130670.
WEI H D, QU L Z, DAI S Y,, 2021. Structural insight into the molecular mechanism of p53-mediated mitochondrial apoptosis [J]. Nature Communications, 12(1): 2280.
ZHANG H, PAN L Q, TAO Y X, 2014a. Toxicity assessment of environmental pollutant phenanthrene in clamusing oxidative stress biomarkers [J]. Environmental Toxicology and Pharmacology, 37(2): 697-704.
ZHANG L, YANG Z J, LIU Y Z, 2014b. GADD45 proteins: roles in cellular senescence and tumor development [J]. Experimental Biology and Medicine, 239(7): 773-778.
ZHIVOTOVSKY B, ORRENIUS S, 2005. Caspase-2 function in response to DNA damage [J]. Biochemical and Biophysical Research Communications, 331(3): 859-867.
EFFECT OF THREE ORGANIC ULTRAVIOLET FILTERS ON ANTIOXIDANT CAPACITY AND EXPRESSION OF APOPTOSIS-RELATED GENES IN GILLS OF
ZHANG Wei-Wei1, 2, DONG Fei-Long1, 2, JING Chen1, 2, LIU Shang-Shu1, 2, HU Feng-Xiao1, 2
(1. College of Marine Sciences, Fujian Agriculture and Forestry University, Fuzhou 350002, China; 2.Key Laboratory of Marine Biotechnology of Fujian Province, Fuzhou 350002, China)
Benzophenone-3 (BP-3), 4-methyl-benzylidene camphor (4-MBC), and 2-ethyl-hexyl-4-trimethoxycinnamate (EHMC) are commonly used organic ultraviolet (UV) filters. Recently, these UV filters have been frequently detected in aquatic environment, posing a potential threat to the safety of aquatic ecosystem. To investigate the effects of the three UV filters on the antioxidant response ofgill and apoptosis-related genes,was exposed to the three filters at environmentally relevant concentrations, and the activity of antioxidant enzymes and transcriptional levels of apoptosis-related genes in gills were investigated. Afterwards, the adverse effects of the filters were compared and analyzed using the Integrated Biomarker Response (IBR) (Version 2) method. Results show that the organic UV filters could induce initial antioxidative response to improve antioxidant capacity, while a long-term exposure to high concentrations of the UV filters could decrease the antioxidant capacity. In addition, the three filters could induce apoptosis in the gill tissue ofvia mitochondria pathway and death receptor pathway. After exposure to the three organic UV filters at common environmental concentration (1 μg/L) for 1 d and 7 d, BP-3 exhibited the strongest toxic effects ongill; and the biomarker responses were similar among the three filters in 28 d. Therefore, the toxicity of organic UV filters depends on chemical species, exposure dose, and exposure duration. This study provides reference data for ecological risk assessment of organic UV filters in aquatic environments.
organic UV filters;; gill; oxidative stress; apoptosis; integrated biomarker response
* 自然资源部东南生态脆弱区监测修复工程技术创新中心自主研究课题, KY-090000-04-2022-017号; 福建省大学生创新创业计划项目, S202210389038号。张韦炜, 硕士研究生, E-mail: zhangweiwei0605@126.com
胡丰晓, 博士, 硕士生导师, E-mail: hufengxiao@fafu.edu.cn
2023-06-18,
2023-09-19
Q957; S968.3; Q789
10.11693/hyhz20230600126

