幽门螺杆菌感染诱导的miR-125a-5p靶向EVA1A影响胃癌增殖和侵袭的机制研究
廖雪霞, 彭 鑫, 符 鑫, 吴德建
(海南省儋州市人民医院消化内科, 海南 儋州 571799)
胃癌(Gastric Cancer,GC)是全球第五大常见恶性肿瘤之一[1-2]。尽管近年来GC的死亡率有所下降[3],但许多患者在晚期被诊断为淋巴结或远处转移,无特异性症状。Ⅲ期胃癌的5年生存率仅约为15%。然而,晚期GC的可用治疗方法有限[4-6]。因此,发现新的治疗靶点来控制GC的发展十分有必要。幽门螺杆菌(Helicobacter pylori,Hp)是革兰氏阴性、微需氧的细菌生存于胃部及十二指肠的各区域内。.它会引起胃粘膜轻微的慢性胃炎,或导致胃及十二指肠溃疡与胃癌[7]。目前,Hp感染被认为是GC发展的重要初始因素[8]。尽管Hp感染与GC的发展之间存在密切的因果关系,但这一过程中涉及的确切机制尚未完全明晰。miRNAs参与多细胞生物中基因表达的转录后调控[9-10]。许多研究表明,miRNA在多种疾病(包括癌症)的生理和病理过程中起着至关重要的作用[11-12]。最近的发现揭示了miRNA对Hp感染的反应失调,通过改变正常的生物学过程(如凋亡、增殖和宿主炎症免疫反应),在调节Hp感染的疾病中发挥了重要作用。其中,miR-125a-5p是参与癌症进展的关键miRNA之一。高通量测序数据表明miR-125a-5p在胶质母细胞瘤、乳腺癌和膀胱癌中下调,而在胃癌中上调表达。因此,miR-125a-5p在癌症进展中作用的存在争议,本研究拟进一步探究miR-125a-5p在GC进展中的作用。EVA1A(又称TMEM166/FAM176A,)是一种参与自噬和细胞凋亡的新蛋白,在一些人类原发性癌症中起到抑癌作用。先前的研究表明,EVA1A通过诱导自噬和凋亡抑制胶质母细胞瘤细胞增殖;miR-103a-3p下调EVA1A促进肝细胞癌细胞增殖和迁移。然而,EVA1A在GC中表达的调控机制尚不清楚。因此,本研究拟通过体外细胞模型进一步探讨Hp感染对GC细胞增殖和侵袭的影响,以及Hp诱导的miR-125a-5p靶向EVA1A在GC发生中的作用。
1 材料与方法
1.1样本收集:2021年1月至2022年12月,选取儋州市人民医院20例Hp感染或未感染的患者接受了胃镜检查。收集20例患者的样本,立即在液氮中快速冷冻,并在-80℃下保存,直到提取RNA。当快速尿素酶试验呈阳性时,样品被鉴定为阳性。这些选定的患者也通过13C呼气测试得到证实。这项研究得到了医院伦理委员会的批准(伦审:2021003),每个患者均有书面知情同意书。
1.2细胞培养与细胞转染:人胃癌细胞系AGS、SGC-7901购自ATCC(USA),在添加10%胎牛血清(Gibico)和青霉素(100U/mL)的RPMI-1640培养基中培养。细胞在37℃、5%CO2的条件中培养。miR-125a-5p mimic、miR-125a-5p inhibitor、oe-EVA1A以及对应的阴性对照购自于Ribobio (China)。使用 Lipofectamine 2000试剂盒(Thermo Fisher Scientific,USA),并根据试剂盒操作说明书将上述质粒转染到OSCC细胞中。
1.3细菌培养:从ATCC购买NCTC11637(一株CagA阳性Hp菌株)。Hp细胞在37℃、含10%CO2、5%O2和8%N2的混合空气中,置于补充5%羊血的胰蛋白酶大豆琼脂平板培养。
1.4Hp感染GC细胞:在用Hp感染GC细胞之前,将GC细胞洗涤并重新悬浮在新鲜的无抗生素培养基中。将细菌在含5%羊血的胰蛋白酶大豆肉汤中培养48h,并在37℃下搅拌均匀,在含有10%CO2、5%O2和8%N2的混合空气中培养48h,收获并重新悬浮在RPMI 1640培养基中。GC细胞用10% FBS保存在RPMI 1640中。生长至90%汇合的细胞以100/1的Hp/细胞比率感染Hp。将Hp加入到6孔板的细胞培养板中。在收获前,将细胞与Hp在37℃的潮湿环境中共同培养。
1.5qRT-PCR:利用Trizol法提取总RNA,EVA1A和miR-125a-5p的定量检测,RNA通过Qiagen One-Step RT-PCR kit(Qiagen Gmbh,Germany)一步逆转录法将其反转录为cDNA并进行qRT-PCR实验。具体引物序列如表1所示。

表1 qRT-PCR引物序列
1.6CCK-8和克隆形成实验检测细胞增殖:对于细胞活力的检测,将细胞以2×103个细胞/孔的密度接种到96孔板中,并孵育0h,24h,48h,72h。加入10μL CCK-8溶液(Sigma,USA),继续培养细胞4h。用酶标仪在450nm处检测吸光度。对于细胞增殖的检测,将1×103个不同处理的GC细胞接种于六孔板中,培养14天。细胞用多聚甲醛固定,并用0.5%(w/v)结晶紫染色。最后,对细胞集落进行计数。
1.7Transwell:对于细胞迁移测定,将在无血清培养基中收获的转染细胞置于Boyden Transwell室(Corning,USA)的上室。对于细胞侵袭测定,将细胞接种在预涂有100%Matrigel(BD Biosciences)的上室中。在下腔室中含有10%FBS的完整培养基用作化学引诱剂。用棉签轻轻去除残留在上表面的细胞,固定位于下腔室的细胞,用结晶紫染色,并在光学显微镜下观察计数。
1.8双荧光素酶实验:使用starBase数据库预测miR-125a-5p与EVA1A的结合位点。野生型和突变型EVA1A (EVA1A -WT/MUT)报告载体由 General Biosystems (China)生产。使用 Lipofectamine 2000 (Invitrogen,USA) 用 miR-125a-5p mimic或 NC mimic和上述报告载体共转染AGS细胞。转染 48h后,使用 Dual-Lucy Assay Kit (Solarbio,USA) 测量荧光素酶活性。
1.9免疫组化:将切片与3%H2O2孵育,然后用5%山羊血清(Zsbio,China)封闭15min。将抗EVA1A(Abcam,UK)抗体添加到切片中,并在4℃下孵育过夜。用PBS洗涤切片,将切片与山羊抗兔二抗(Abcam,UK)在37℃下孵育20min。使用DAB检测试剂盒(Beyotime Biotechnology,China)对切片进行可视化,然后在显微镜下观察,Image-Pro Plus 6.0(MediaCybernetics,USA)用于定量分析。
1.10统计分析:本研究所有数据均符合正态分布,数据以平均值±标准差(SD)表示,并使用GraphPad Prism 8.0进行分析并绘图。 多组间差异均使用Anova检验差异显著性,两组间差异的比较均使用T检验差异的显著性。P<0.05认为具有统计学意义。
2 结 果
2.1miR-125a-5p在Hp感染的阳性组织中显著下调:首先,我们通过qRT-PCR分析了Hp感染的阳性组织和正常组织中miR-125a-5p的表达。结果显示,miR-125a-5p在Hp感染阳性组织中的表达减少(图1A)。在Hp感染阳性组织中,我们发现CAG的miR-125a-5p表达低于CG(图1B)。
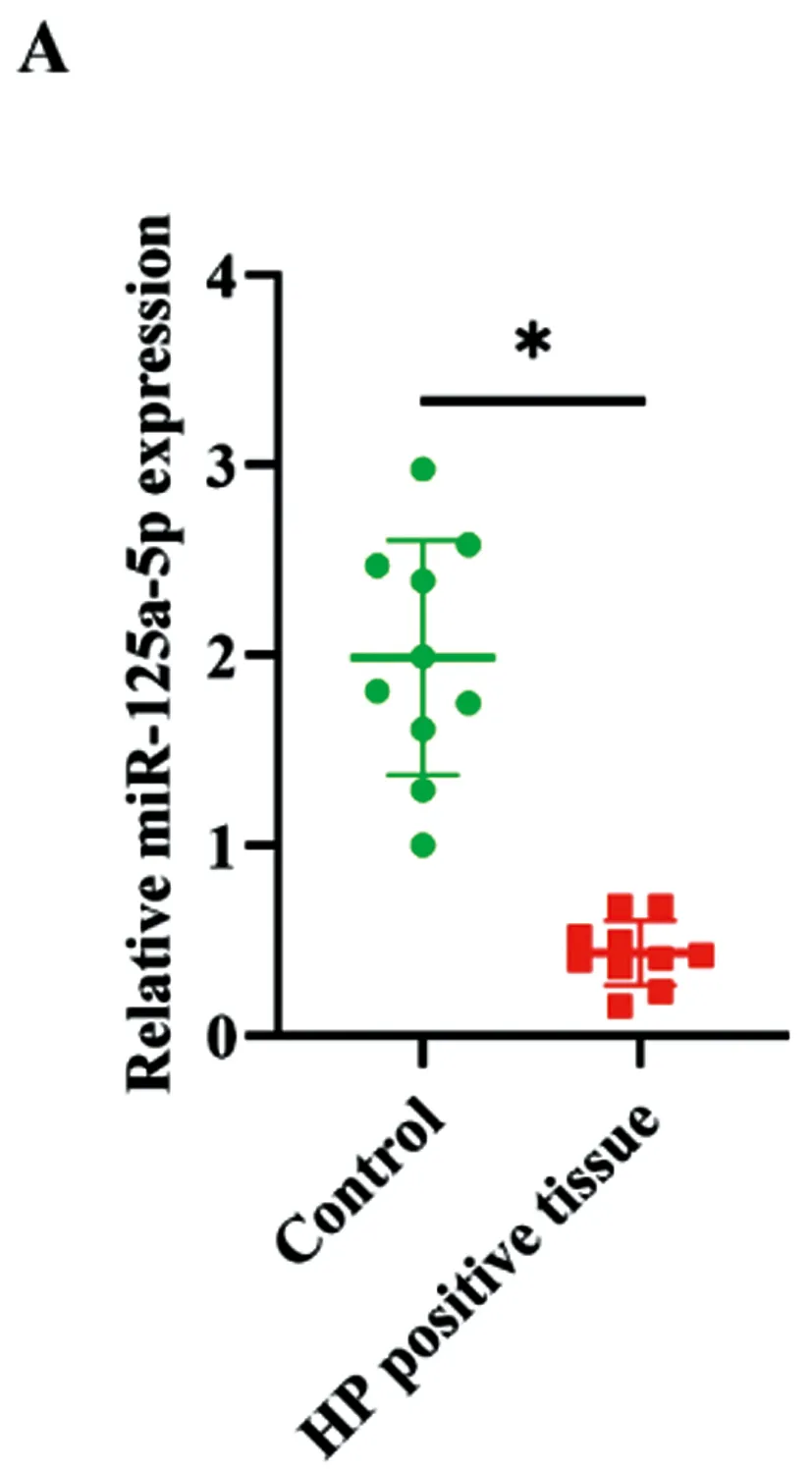

图1 miR-125a-5p在Hp感染的阳性组织表达
2.2miR-125a-5p抑制AGS细胞的迁移和侵袭:为进一步探究miR-125a-5p在GC进展中的作用。用miR-125a-5p mimic和miR-125a-5p inhibitor转染至Hp感染的GC细胞。首先,通过qRT-PCR验证转染效率(图2A)。CCK-8和克隆形成实验结果表明过表达miR-125a-5p可以抑制GC细胞活力和增殖能力,而敲低表达miR-125a-5p则明显抑制GC细胞活力和增殖能力(图2B-C)。Transwell实验表明,miR-125a-5p的过度表达可以抑制GC细胞的迁移和侵袭,而其敲低则促进细胞的迁移侵袭(图2D)。上述结果表明,Hp感染诱导的miR-125a-5p下调可以抑制AGS细胞的迁移和侵袭




图2 miR-125a-5p抑制AGS细胞的迁移和侵袭
2.3EVA1A是miR-125a-5p的下游靶点:我们通过生信数据库预测确定了miR-125a-5p的下游靶点,以阐明miR-125a-5p抑制胃癌细胞增殖和侵袭的机制。starbase数据库预测了数百个靶基因,本研究挑选EVA1A为研究对象(图3A)。通过qRT-PCR和免疫组化实验检测结果显示,EVA1A在Hp感染的阳性组织中显著上调表达,其在CAG中的表达也高于CG(图3B-D)。双荧光素酶实验表明miR-125a-5p过表达可以下调野生型EVA1A的荧光素酶活性(图3E)。最后,我们探究了miR-125a-5p异常表达对EVA1A表达的影响。qRT-PCR实验测表明,miR-125a-5p的过度表达可以显著下调EVA1A的表达,而miR-125a-5p敲低的效果则相反(图3F)。

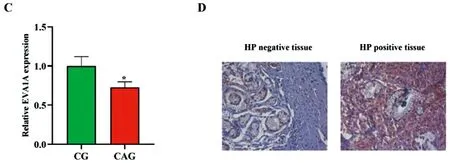
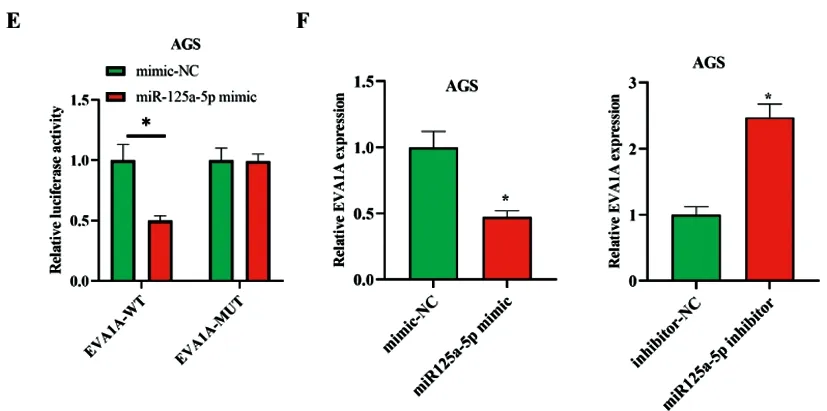
图3 EVA1A是miR-125a-5p的下游靶点
2.4miR-125a-5p靶向EVA1A抑制GC细胞增殖和迁移:为了进一步确定miR-125a-5p/EVA1A轴在GC中的生物学功能及调控作用,我们进行了一系列细胞功能实验。qRT-PCR分析结果表明,过表达miR-125a-5p抑制了AGS细胞中EVAA的表达,进一步过表达EVA1A逆转了这一结果(图4A)。细胞功能实验结果显示,过表达miR-125a-5p抑制了AGS细胞的增殖、迁移和侵袭能力,进一步过表达EVA1A可以减弱过表达miR-125a-5p对这些细胞表型的影响(图4B-D)。综上。这些结果表明miR-125a-5p靶向EVA1A抑制GC细胞增殖和转移。

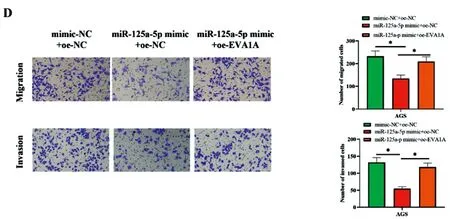
图4 miR-125a-5p靶向EVA1A抑制GC细胞增殖和迁移
3 讨 论
近年来,幽门螺杆菌感染率不断上升,特别是在发展中国家。临床研究表明,幽门螺杆菌与胃癌有关,但其机制尚不清楚。最近的研究表明,miRNAs在调节肿瘤转移过程中发挥着重要作用。然而,它们与癌症的关系尚未完全明晰。在本研究中,证实了miR-125a-5p在Hp感染阳性组织中显著下调。最近研究报道,miR-125a-5p在肿瘤进展中发挥抑癌基因的功能,如miR-125a-5p通过调节TAZ/EGFR信号通路抑制卵巢癌症细胞的EMT。此外,研究表明,miR-125a-5p的表达谱是组织特异性的,它可能具有不同的功能,这取决于肿瘤组织或细胞类型。研究发现miR-125a-5p在GC中高表达,miR-125a-5p通过调节Hippo通路促进GC细胞活性和侵袭。在本研究中,目前的结果表明,miR-125a-5p的过度表达抑制了胃癌细胞的增殖和侵袭,这与既往的研究结果相一致。据此,本文猜测与Hp相关的miR-125a-5p表达降低是可能是GC发生的关键机制,提示可能miR-125a-5p是胃癌早期诊断的潜在标志物。
为进一步探究miR-125a-5p在GC进展中的调控机制。通过生物信息学软件及分子实验证实:miR-125a-5p与EVA1A存在靶向结合关系。EVA1A是2007年高通量筛选的一种参与程序性细胞死亡的新蛋白。EVA1A在许多生理和病理过程中发挥着重要作用。最近研究表明,EVA1A的下调及其抑癌活性被证明是一个高度显著的现象。已经发现,EVA1A在人类肿瘤组织中显著下调,如肝癌症、食管鳞癌、胃腺癌和胰腺肿瘤,表明它可能参与这些肿瘤的发生或发展。EVA1A的过度表达可通过诱导宫颈癌症HeLa细胞、非小细胞肺癌H1299细胞和胶质母细胞瘤SHG44、U87和U251细胞系的凋亡,进而抑制肿瘤细胞增殖。本研究的结果表明,EVA1A在Hp感染阳性的GC患者组织和细胞中的表达显著上调。值得注意的是,Hong Xie等研究报道EVA1A的过度表达通过上调TP53抑制肝细胞癌生长,这使得EVA1A可能成为肝细胞癌的潜在治疗靶点。另一项研究表明,EVA1A是miR-125b的下游直接靶点,MicroRNA-125b通过负调节EVA导的自噬来逆转肝细胞癌中的奥沙利铂耐药性。然而,EVA1A在GC中表达和调控机制尚不清楚。本研究的数据表明,miR-125a-5p可以靶向抑制EVA1A的表达,过表达EVA1A可以逆转miR-125a-5p过表达对GC细胞迁移和侵袭的作用。总之,这些数据阐明了miR-125a-5p/EVA1A轴抑制GC进展的调节机制。
总之,本研究发现Hp可以通过调节miR-125a-5p/EVA1A轴影响GC的发生和发展。Hp-miR-125a-5p-EVA1A可能是一种新的信号级联,为阐明Hp的致癌机制提供了新的研究思路,也为探索miR-125a-5p在GC发生发展中的分子作用机制提供了实验依据。总之,本结果提示miR-125a-5p作为GC治疗的诊断标志物和干预靶点提供了理论依据。

