小花南芥相关转运蛋白及有机酸对锌迁移的响应
廖雨梦,邓随枫,李祖然,王磊,王吉秀,祖艳群
(1.云南农业大学资源与环境学院,昆明 650201;2.云南农业大学园林园艺学院,昆明 650201)
锌(Zn)是植物生长所必需的微量营养元素,能形成金属酶、蛋白质和转录因子,从而在植物细胞中发挥作用[1-2]。但过量的Zn会通过干扰生理生化和分子过程对植物造成危害,Zn 对植物的毒性表现为使叶片发黄、坏死,抑制叶绿素合成酶的活性等[3-4]。利用超富集植物对重金属的吸收转运作用,可通过收获植物地上部,降低土壤中重金属含量,以此修复重金属污染土壤。
以往的研究表明,重金属离子能通过共质体和质外体两种途径被植物吸收,在木质部装载后通过导管运输,并在叶片中积累[5]。其中,细胞壁是重金属进入植物体的第一道屏障,主要由纤维素、半纤维素、果胶和蛋白质组成,细胞壁与重金属的结合能力取决于羟基(—OH)、羧基(—COOH)、氨基(—NH2)等官能团的数量,其中果胶在细胞壁结合重金属过程中发挥关键作用[6]。果胶甲酯酶(PME)能调控果胶的去甲基化,使果胶上含有大量羧基基团,这些基团能与重金属离子结合,从而影响细胞质中游离态重金属离子浓度[7]。研究表明,植物能通过降低脱甲基化程度来缓解重金属毒害[8]。
转运蛋白是存在于植物质膜系统上的一类功能性蛋白,能通过特有的方式运输重金属离子[9]。木质部装载需要转运蛋白的参与,其决定了重金属能否进入木质部向上运输。其中阳离子/H+反向运输体(CAX)、重金属ATP 酶(HMA)、ATP 结合盒转运蛋白(ABC)能将重金属离子转运至液泡中进行区室化,可降低重金属离子对植物的毒性[10-12],也能参与重金属离子的木质部装载和向地上部的转运[13]。且本课题组之前的研究发现,小花南芥体内转运蛋白CAX 和HMA对Cd、Pb的吸收与累积具有重要作用。
有机酸广泛地分布在植物根、茎和叶中[14]。植物体内的有机酸含有一个或者多个羧基基团,能与重金属进行螯合作用形成无毒的化合物,减弱重金属的毒性并使其随水分或离子进行运输[15-16]。在超富集植物鼠尔芥(Arabidopsis halleri)中,Zn在木质部汁液中一半与柠檬酸结合,使其向地上部转运的能力增强[17]。因此,研究有机酸对Zn吸收累积的影响具有一定的意义。
植物能通过改变迁移屏障结构、转运蛋白活性以及生理代谢物质的含量来响应重金属胁迫。然而,超富集植物在Zn胁迫下的响应机制尚不清楚。小花南芥(Arabis alpina)是云南本土的Cd、Pb、Zn 超富集植物,本研究以该植物为材料,研究了不同浓度Zn处理对小花南芥体内细胞壁果胶含量、PME 活性以及转运蛋白CAX、HMA、ABC 活性和代谢物质(草酸、柠檬酸)含量的影响,旨在分析小花南芥体内Zn含量与转运蛋白及代谢物质的变化关系,进一步阐明小花南芥体内Zn 向地上部的迁移转运特征及影响因素,研究膜转运蛋白和有机酸对Zn的吸收和分布的调节过程及作用机理,为利用该植物修复Zn 污染土壤提供理论依据。
1 材料与方法
1.1 供试材料和试验设计
供试植物小花南芥种子采自云南省会泽驰宏铅锌矿区,采样区位于103°03′~103°55′E,25°48′~26°28′N,海拔2 494 m。供试土壤为云南弥勒烟用物资有限公司生产的基质土,其基本理化性质如下:pH 4.49,有机质含量431.75 g∙kg-1,碱解氮含量437.50 mg∙kg-1,速效磷含量81.45 mg∙kg-1,速效钾含量6 220.17 mg∙kg-1,Zn含量74.5 mg∙kg-1。
小花南芥种子经消毒、去离子水浸泡后,均匀播撒至装有无污染基质土的盆中进行育苗生长90 d。选择长33 cm、宽24.5 cm、高13.5 cm 的盆加入2 kg 基质土,添加重金属处理后老化7 d,随后挑选长势一致的幼苗移栽至添加处理的基质土中,每日浇一次水。
试验中Zn 处理以ZnSO4溶液的形式添加至供试土壤中,配制100 mg∙kg-1Zn(Zn100)和300 mg∙kg-1Zn(Zn300)两种浓度的ZnSO4溶液,并以不添加Zn 为对照(CK)。每个处理重复3 次,每盆植株6 株,处理20 d后,收获植物测定各项指标。将收获的植株一部分用去离子水冲洗后,分离叶和根,置于25 mmol·L-1EDTA-Na2中浸泡20 min 去除根上吸附的重金属离子。分离的根和叶放置在105 ℃鼓风干燥箱(DHG-9145A,上海一恒科学仪器有限公司)中杀青30 min,70 ℃烘干至恒质量后磨碎制成干样,用于测定植株中Zn 含量。另一部分收获的植株分为叶和根,在液氮中速冻5 min 后保存在-80 ℃冰箱中,用于其他各项参数的测定。
1.2 指标测定方法
1.2.1 植物Zn含量测定
分别称取0.1 g 叶和根部样品于消解罐中,加3 mL 硝酸过夜,之后加2 mL H2O2,于160 ℃消解4 h 至澄清,过滤后用去离子水定容至50 mL。采用火焰原子吸收分光光度计(Thermo iCETM-3000,赛默飞世尔科技有限公司,美国)测定Zn的浓度[18]。
1.2.2 根部质外体、共质体汁液的提取方法
称取小花南芥根部样品0.25 g,放至50 mmol∙L-1pH 6.5 的MES-Tris 缓冲液中,在0.5 kPa 压强下减压20 min,处理2 次后,取出根部样品,吸干表面的水分后,在4 ℃、1 500g下离心15 min,收集质外体溶液。随后,根系在-20 ℃冷冻3 d,在4 ℃、3 000g下离心15 min,得到共质体溶液Ⅰ,根系样品继续在1 mL 乙醇中匀浆3 min,离心后取上清液,用乙醇清洗残渣后再离心,合并2 次上清液得到共质体溶液Ⅱ,合并溶液Ⅰ和Ⅱ得到共质体溶液[18]。
1.2.3 木质部、韧皮部汁液的提取方法
采用压力室法采集木质部汁液。脱脂棉经过稀盐酸、蒸馏水、去离子水清洗,烘干后装入清洁的50 mL Eppendorf 管中待用。将小花南芥移至阴处,用消毒的刀片切断根与叶连接处,用脱脂棉吸取溢出的汁液,置于10 mL 的离心管中,12 h 后停止收集,木质部渗出液在3 000g条件下离心10 min,收集悬浮液并保存在1.5 mL 离心管中,储存于超低温(-70 ℃以下)冰箱中待用[19]。
将收集木质部汁液时切下的小花南芥叶部用去离子水洗净茎切口,并用脱脂棉吸干表面水分,插入装有15 mL 25 mmol∙L-1EDTA-Na2溶液的小塑料瓶中,放置于遮光密闭的培养箱中,保持相对湿度大于95%,20 ℃下收集韧皮部汁液24 h[20]。将收集到的质外体、共质体、木质部和韧皮部汁液用去离子水定容至50 mL,随后采用火焰原子吸收分光光度计(Thermo iCETM-3000,赛默飞世尔科技有限公司,美国)测定Zn 的浓度。
1.2.4 小花南芥细胞壁果胶的提取和含量测定
总果胶根据试剂盒说明书(购自苏州格锐思生物技术有限公司)测定。称取0.1 g 小花南芥根或叶,加入1.5 mL 80%乙醇,研磨匀浆,85 ℃水浴10 min,在水浴过程中及时补充80%乙醇,冷却至室温后,8 000 r∙min-1离心10 min,去除上清液,重复上述操作,然后向沉淀中加入1 mL 提取液,混匀后95 ℃水浴1 h,冷却至室温后,8 000 r∙min-1离心10 min,上清液即为总果胶。测定时,吸取105µL上清液,加入630µL浓硫酸后85 ℃水浴15 min,加入咔唑-乙醇溶液21µL,暗处反应30 min,在530 nm 处测定溶液的吸光度,记作A测定,同时以蒸馏水为空白进行相同步骤,记作A空白。同时,利用标准品制作标准曲线,得到标准曲线方程:
式中:x为标准品浓度,mg∙mL-1;y为ΔA,ΔA=A测定-A空白。
式中:V1为加入样本体积,mL;W为样品质量,g;V为加入提取液的体积,mL;D为稀释倍数,未稀释即为1。
1.2.5 小花南芥细胞壁果胶甲酯酶提取和活性测定
提取液的制备:称取0.1 g 新鲜根或叶样品,加入1.5 mL提取液冰浴研磨成匀浆,4 ℃、12 000 r∙min-1离心15 min,取上清液待测。
果胶甲酯酶(PME)活性根据试剂盒说明书(购自苏州格锐思生物技术有限公司)测定。记录pH 为7.8时的NaOH体积V2。
式中:V2为滴定所消耗的试剂NaOH 的量,mL;T为反应时间,min;20 为试剂NaOH 的浓度,即20 µmol∙mL-1。
1.2.6 小花南芥CAX、HMA和ABC蛋白的提取和活性测定
酶提取液的制备:称取0.1 g 组织在液氮中碾磨成粉末,加入0.9 mL PBS(pH 为7.2~7.4,浓度为0.01mol∙L-1)缓冲液匀浆,4 ℃、5 000 r∙min-1离心15 min,取上清液待测。
将50 µL 标准品或样品加入酶标板中混匀。用封板膜封好后37 ℃孵育30 min,揭掉封板膜,弃去液体,每孔加满洗涤液,静置30 s 后弃去,重复5 次。加入酶标试剂50 µL 后重复之前的步骤。先加入显色剂A 50 µL,再加入显色剂B 50 µL,轻轻振荡混匀,37 ℃避光显色10 min。加入终止液50µL,终止反应(此时溶液由蓝色变为黄色),同时进行空白孔试验,且空白孔不加酶标试剂。测定时,以空白孔调零,在450 nm 波长处依序测量各孔的吸光度(OD 值),通过绘制标准曲线计算CAX、HMA和ABC活性。
1.2.7 小花南芥木质部和体内有机酸含量
分别称取0.1 g 小花南芥根和叶,加2 mL 超纯水和石英砂研磨匀浆,75 ℃水浴15 min,随后在20 000 r·min-1下离心20 min,上清液过0.22 µm 滤膜后保存至1.5 mL 棕色进样瓶中待测。将1.2.3 节中收集到的木质部汁液过0.22 µm 滤膜后保存至1.5 mL棕色进样瓶中待测[21]。
各有机酸的测定采用外标法,使用高效液相色谱仪(Thermo HPLC-ultimate 3000,赛默飞世尔科技有限公司,美国)测定,测定条件为ODS 反相柱,进样体积为20µL,柱温为30 ℃。流动相使用去离子水配制的0.01 mol·L-1的KH2PO4,用20%H3PO4调节pH 值至2.65,流速为1.0 mL·min-1,紫外检测波长为210 nm。测定的标准酸为草酸、柠檬酸,计算采用峰面积法[22]。
1.3 数据处理与分析
采用Excel 进行数据处理,采用SPSS 21.0 进行方差分析(ANOVA),采用Duncan 新复极差法进行显著性分析,显著性水平为P<0.05。
2 结果与分析
2.1 植物Zn含量
小花南芥根和叶的Zn 含量见表1。100 mg∙kg-1Zn 处理下,根中Zn 含量达到232.11 mg∙kg-1,而叶中Zn 含量随Zn 处理浓度提高呈上升趋势,且Zn 含量在小花南芥体内表现为根>叶。100、300 mg∙kg-1Zn 处理下小花南芥叶中Zn 含量相比对照均显著增加,分别增加45.94%、82.85%;根中Zn 含量相比对照分别显著增加236.44%、96.91%。
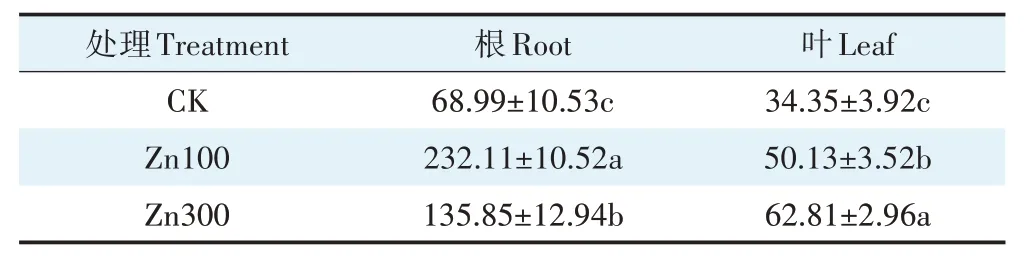
表1 小花南芥根和叶Zn含量(mg∙kg-1)Table 1 Zn content in roots and leaves of A.alpina(mg∙kg-1)
2.2 小花南芥汁液中Zn含量
由图1 可知,100 mg∙kg-1Zn 处理下,质外体汁液中Zn含量比对照显著降低67.95%,而300 mg∙kg-1Zn处理下,质外体汁液中Zn 含量与对照相比显著增加125.64%。随着Zn 处理浓度提高,共质体汁液中Zn含量呈显著上升趋势,两种处理浓度下共质体汁液中Zn 含量相比对照分别显著增加169.63%、379.67%。与对照相比,300 mg∙kg-1Zn处理下,木质部汁液中Zn含量显著增加114.68%;而100 mg∙kg-1Zn 处理下,韧皮部汁液中Zn含量显著增加95.95%。从体系和部位来看,Zn处理下共质体汁液Zn含量高于质外体,韧皮部汁液Zn 含量高于木质部。300 mg∙kg-1Zn 处理下,共质体汁液中的Zn 含量比质外体汁液中的Zn 含量高85.80%,韧皮部汁液中的Zn 含量比木质部汁液中的Zn含量高4.56倍。
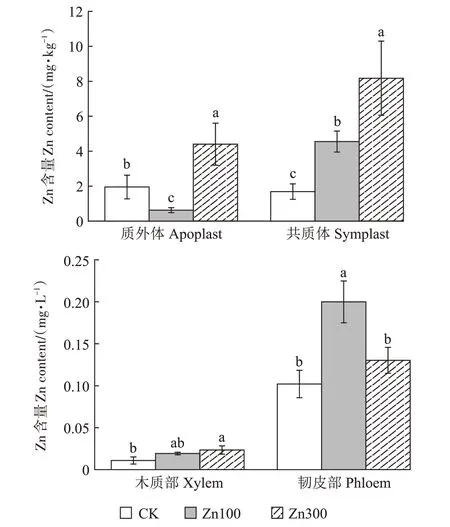
图1 小花南芥各汁液中Zn含量Figure 1 Zn contents in each sap of A.alpina
2.3 小花南芥根和叶中果胶含量
由图2 可知,随着Zn 处理浓度提高,根中果胶含量均显著低于对照,分别降低10.57%、18.06%。而Zn处理下叶中果胶含量与对照相比无显著差异,但100 mg∙kg-1Zn 处理下叶中果胶含量比300 mg∙kg-1Zn 处理下叶中果胶含量显著增加18.28%。对于PME 活性,随着Zn处理浓度提高,叶中PME活性均显著高于对照,分别增加53.85%、30.77%。300 mg∙kg-1Zn 处理下,根中PME活性相比对照显著提高107.69%。
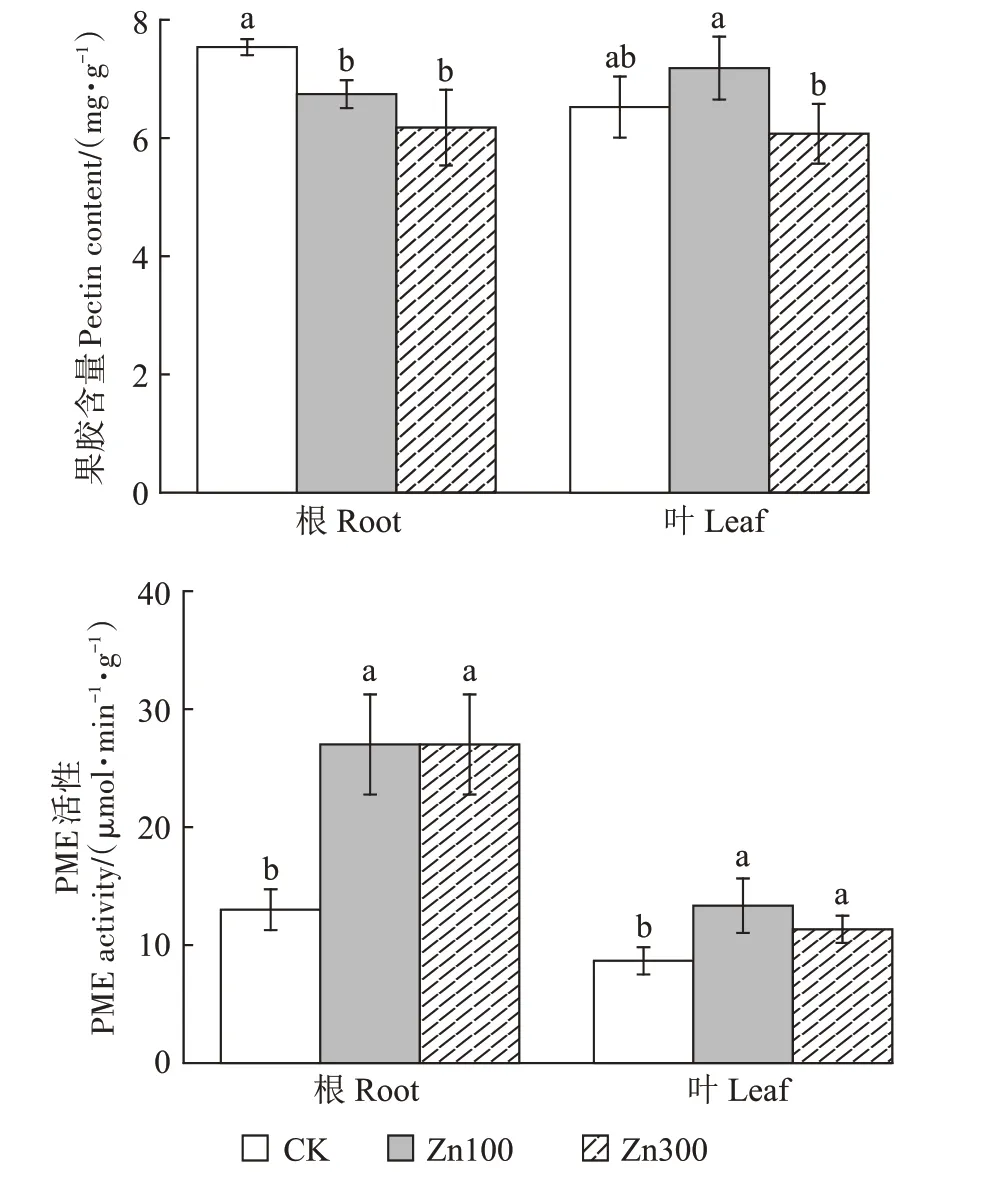
图2 Zn处理对小花南芥植株中果胶含量和PME活性的影响Figure 2 Effects of Zn on pectin contents and PME activities in A.alpina
2.4 小花南芥根和叶中CAX、HMA和ABC蛋白活性
由图3 可知,随着Zn 处理浓度的增加,小花南芥根和叶中CAX 活性均呈上升趋势。100、300 mg∙kg-1Zn 处理与对照相比,根中CAX 活性分别显著提升7.96%、13.53%,叶中CAX 活性分别显著提升44.18%、52.54%。随着Zn 处理浓度的提高,叶中HMA 活性呈上升的趋势。100、300 mg∙kg-1Zn 处理下,根中HMA 活性均显著低于对照,分别降低11.60%、4.22%,而叶中HMA 活性相比对照分别显著提升26.00%、38.73%。小花南芥根中ABC 活性在100 mg∙kg-1Zn 处理下比对照显著降低7.28%,而叶中ABC活性与对照相比差异不显著。
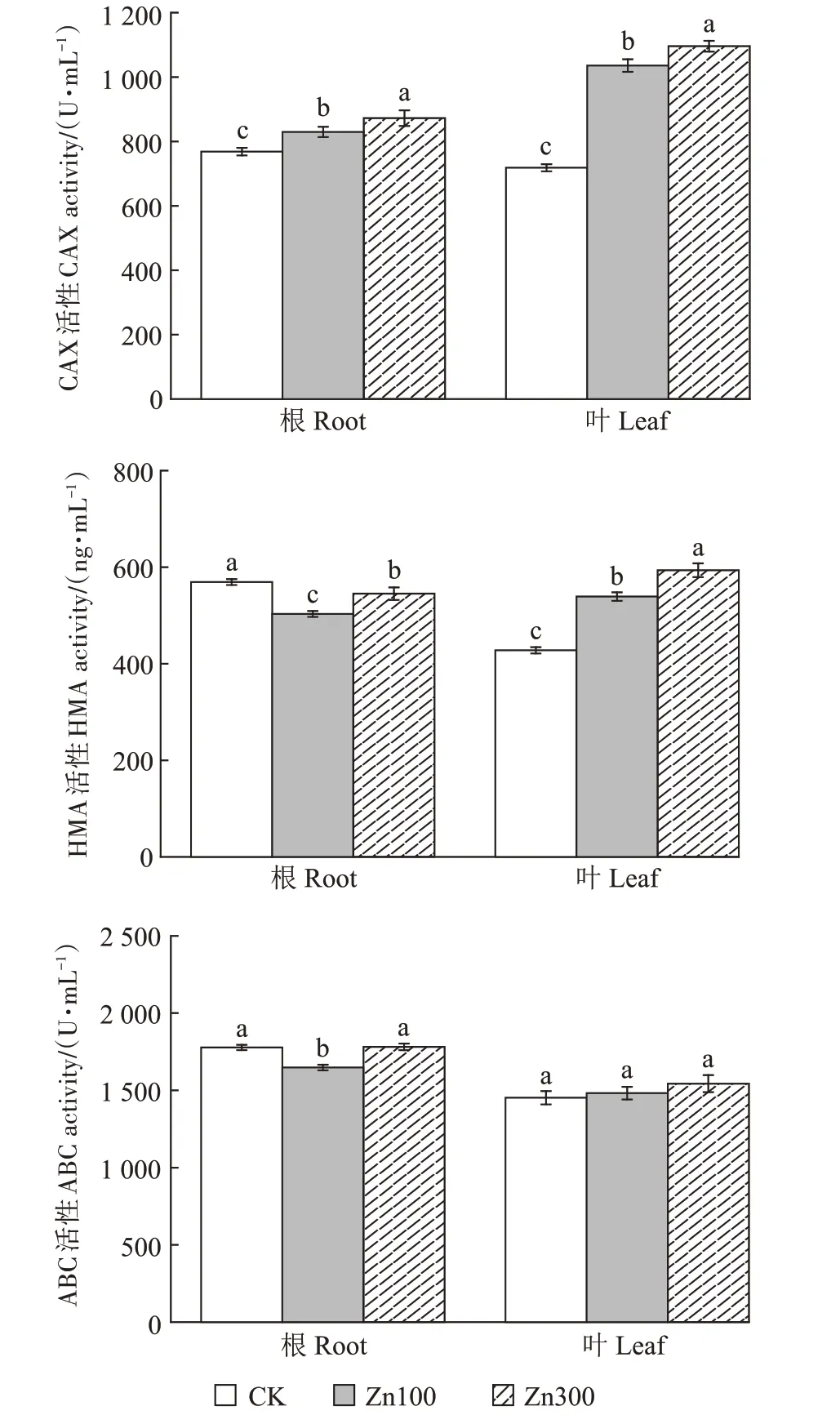
图3 Zn胁迫对小花南芥植株CAX、HMA和ABC活性的影响Figure 3 Effects of Zn on CAX,HMA and ABC activities in A.alpina
2.5 根、叶和木质部中草酸和柠檬酸的含量
由图4 可知,在小花南芥根中,100 mg∙kg-1Zn 处理下草酸含量与对照相比显著下降36.51%。100、300 mg∙kg-1Zn 处理浓度下,柠檬酸含量分别显著下降50.56%、56.38%。在小花南芥叶中,Zn处理下的草酸含量均显著高于对照,且100 mg∙kg-1Zn 处理比300 mg∙kg-1Zn 处理草酸含量高71.80%,柠檬酸含量在300 mg∙kg-1Zn 处理下较对照组增加107.88%。在木质部汁液中,Zn 处理下草酸含量与对照相比无显著变化,100、300 mg∙kg-1Zn处理浓度下,柠檬酸含量与对照相比分别显著增加138.60%、161.10%。
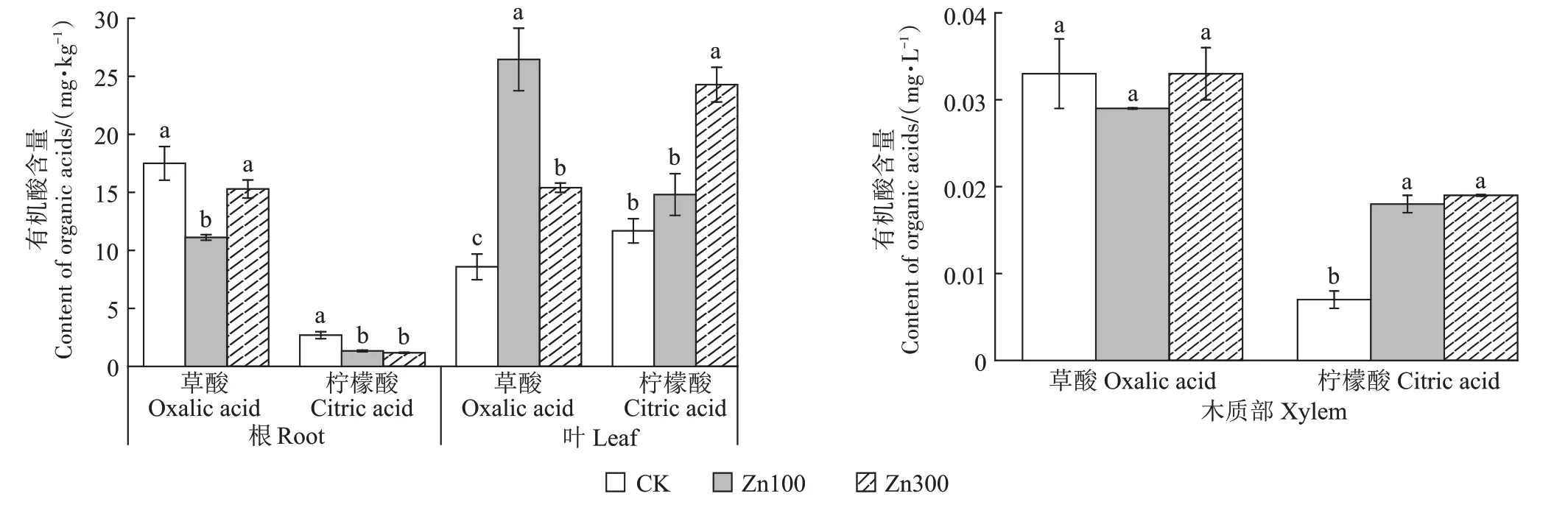
图4 小花南芥根、叶和木质部中草酸与柠檬酸含量Figure 4 Contents of oxalic and citric acid in roots,leaves and xylem of A.alpina
2.6 相关性分析
由表2 可知,小花南芥根中Zn 含量与PME 活性呈极显著正相关,与HMA 活性呈极显著负相关,与ABC 活性和草酸含量呈显著负相关。小花南芥根中PME 活性与CAX 活性呈显著正相关,与HMA 活性呈显著负相关。小花南芥根中果胶含量与柠檬酸含量呈极显著正相关。
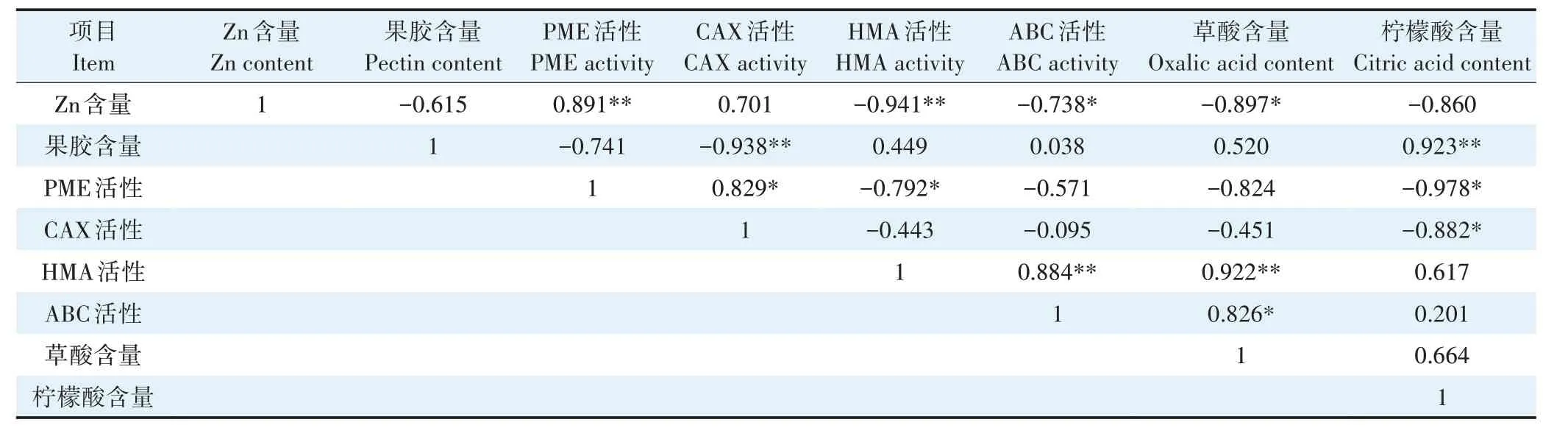
表2 小花南芥根中Zn含量、果胶含量、转运蛋白活性和有机酸含量的相关性分析Table 2 Correlation analysis of Zn content,pectin content,transporter protein activity and organic acid content in roots of A.alpina
由表3 可知,叶中Zn 含量与CAX 活性、HMA 活性和木质部柠檬酸含量呈极显著正相关。木质部草酸含量与果胶含量呈显著负相关。
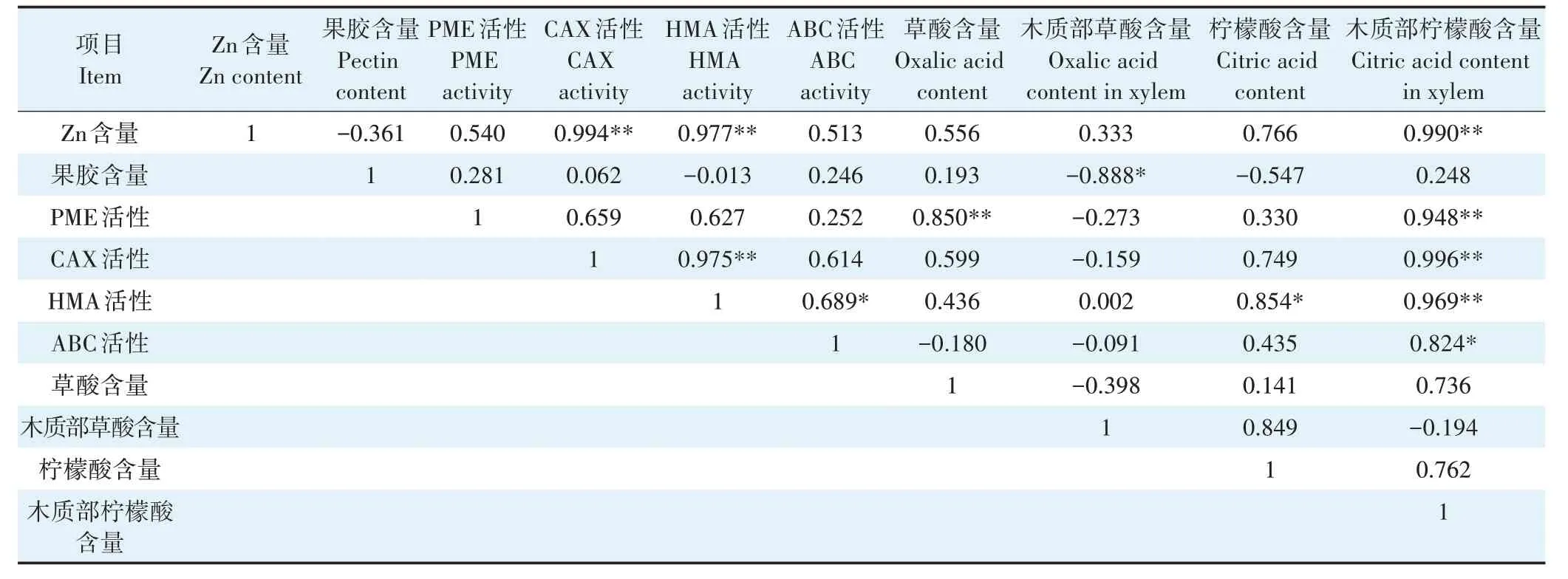
表3 小花南芥叶中Zn含量、果胶含量、转运蛋白活性和有机酸含量的相关性分析Table 3 Correlation analysis of Zn content,pectin content,transporter protein activity and organic acid content in leaves of A.alpina
3 讨论
Zn 作为植物生长必需的微量元素,参与了植物体内许多生理生化过程,但土壤中过量的Zn 被植物吸收后,会对植物造成危害[1-2]。有研究表明,过量的Zn 会影响小麦生长[3]。本研究中,小花南芥根中Zn含量大于叶中的Zn 含量,这与针对小麦和蓖麻幼苗的研究结果[3,23]相似,说明小花南芥将Zn 富集在根部,从而减弱Zn 在叶中的毒性。植物通过共质体和质外体途径吸收水分和离子[5],以往的研究表明,根中Zn 的运输有共质体和质外体两种途径[24]。本研究发现,共质体汁液中的Zn 含量高于质外体汁液中的Zn 含量,说明小花南芥对Zn 的运输可能以共质体途径为主。而木质部汁液中Zn的含量低于韧皮部汁液中Zn 含量,说明Zn 能通过韧皮部进行运输,Tan 等[25]对水稻中Zn含量的研究也得到相似的结果。
细胞壁中的果胶能与重金属离子结合[26-27],降低重金属离子的移动性,对于缓解重金属毒害起着重要作用[28]。有研究表明,细胞壁对金属离子的累积与细胞壁果胶含量和果胶的甲酯化程度有关。PME 是一种调控果胶甲基化程度的酶,能够使果胶去甲基化后形成果胶酸[29],果胶酸含有大量羧基,能与重金属离子结合,降低游离重金属含量[30]。本研究中,Zn 处理下根中果胶含量下降,但根和叶中PME 活性升高,表明PME 促使生成更多的果胶酸来结合Zn。李学文等[31]研究发现,根尖细胞壁PME 活性越高,果胶甲酯化程度越低。PME 活性与根中Zn 含量呈显著正相关,说明小花南芥体内PME 在植物应对Zn 胁迫时发挥重要作用,植物体内Zn含量的增加,促使PME活性增大。
重金属被植物吸收后能继续向地上部转运。研究发现,CAX、HMA 和ABC 是植物体内位于质膜系统上的一类功能性蛋白,能以特有的方式运输重金属离子,从而将重金属离子转运至地上部[9]。研究表明,烟草中表达的CAX4能将Cd2+、Zn2+、Ca2+和Mn2+阻隔在液泡中,对Cd2+的区隔能力最强[11]。这种能力在Cd/Zn 超富集植物拟南芥(Arabidopsis thaliana)中表现为HMA4的过表达[32],Cd 胁迫下,HMA3等基因的表达能将Cd 阻隔在根部,降低Cd 向叶的转运[33-34]。本研究中,小花南芥根和叶中CAX 活性均随Zn 处理浓度的提高而增大,叶中HMA 活性随Zn 处理浓度的提高而增大,但在根中HMA 活性均下降。ABC 活性变化并不显著。小花南芥根部Zn 含量与HMA 活性呈极显著负相关,与ABC活性呈显著负相关,而叶中Zn含量与CAX、HMA 活性呈极显著正相关。这说明小花南芥通过提高根部CAX 活性、降低HMA 和ABC 活性促进Zn向叶的转运。
有机酸广泛存在于植物根、茎、叶中[14],能与重金属进行配位结合,改变重金属的形态,降低重金属的毒性[15-16]。木质部汁液中存在很多有机酸,能与Zn形成有机配体,并将其转运至地上部[35]。王沛琦等[36]研究发现,在不同程度的Cd 胁迫下,蓖麻(Ricinus communisL.)根部主要含有草酸,叶片主要含有柠檬酸,这些有机酸与Cd 络合,形成低毒或无毒的络合物。Ueno 等[17]的研究表明,Zn 在木质部汁液中一半与柠檬酸结合。Li 等[37]的研究表明,Cd 能与鼠尔芥(A.halleri)和水稻(Oryza sativa)木质部汁液中的柠檬酸结合。本研究发现:小花南芥根部的草酸含量较高,在木质部汁液中,Zn 处理下的柠檬酸含量显著高于对照;小花南芥根部Zn 含量与草酸含量呈显著负相关,叶中Zn 含量与木质部汁液中柠檬酸含量呈极显著正相关。这表明根部Zn 的累积与草酸含量相关,木质部汁液中的柠檬酸能促使Zn向叶转运。
综上所述,在Zn胁迫下,小花南芥通过降低果胶含量、增加PME活性降低果胶的甲酯化程度,将Zn富集在根系中,同时通过提高根部CAX活性、降低HMA和ABC活性以及提高木质部汁液中的柠檬酸含量促进Zn向上转运,并在叶中积累。
研究得出,果胶、膜转运蛋白以及柠檬酸能影响Zn 在小花南芥中的转运,但对于Zn 的转运机理尚不清楚,今后工作的重点主要在于:①果胶调控重金属的途径;②膜转运蛋白的基因表达及其对重金属在质膜上的转运调控机理;③木质部汁液中柠檬酸与Zn的结合形态。
4 结论
(1)Zn 胁迫下,小花南芥根中果胶含量降低,小花南芥通过增加果胶甲酯酶活性来调控果胶的去甲基化,将Zn富集在根中。
(2)Zn胁迫下,小花南芥通过提高根中阳离子/H+反向运输体活性、降低根中重金属ATP 酶活性、提高叶中阳离子/H+反向运输体和重金属ATP 酶活性来调控Zn在质膜上的运输,从而促使Zn向上转运。
(3)Zn 胁迫下,小花南芥木质部汁液中柠檬酸含量的增加能促进Zn在叶中的积累。

