硫素对小花南芥同化关键酶活性与铅富集的影响
刘艺瑄,刘才鑫,祖艳群,王磊,李祖然,王吉秀
(云南农业大学资源与环境学院,昆明 650201)
铅(Pb)是一种毒性很强的重金属元素。随着我国工业化和城镇化的高速发展,农田受到不同程度的铅污染,据报道我国27 个省的表层土壤铅含量高于全国背景值[1]。铅污染已成为影响耕地安全和粮食安全的严重问题。铅在土壤中的溶解度小,滞留时间长,是一种不可降解的环境污染物,在表土积累后,影响农作物的产量和质量,并可通过食物链富集进而影响人类的健康[2]。在铅胁迫下,植物体内酶活性发生改变,影响植物对矿物元素的吸收利用,同时改变土壤中污染元素的迁移转化。
硫是植物生长发育的重要营养物质之一[3]。近年来研究表明,硫在植物对重金属铅耐受机制中发挥重要作用,与植物对铅胁迫反应机制密切相关。外源硫营养元素可促进超富集植物小花南芥累积铅[4],使小花南芥体内含硫巯基化合物含量增加[5]。硫同化过程与植物响应重金属胁迫有着密切的联系。硫通常以硫酸盐()的形态被植物根部所吸收[6],植物吸收后,通过一系列的代谢同化过程生成半胱氨酸、胱氨酸和甲硫氨酸等[7],进而生成多种含硫化合物螯合重金属,降低其毒性。在植物响应重金属胁迫的硫同化过程中,硫同化关键酶起着至关重要的作用,但目前硫同化关键酶代谢如何调控小花南芥体内硫化合物的合成及其对铅的耐受机制尚不明确。
本研究选取云南会泽铅锌矿区周边超富集植物小花南芥的种子,通过外源添加不同浓度的硫,研究硫营养元素施加对小花南芥富集铅的调控及对硫同化关键酶的影响,旨在揭示硫同化关键酶对小花南芥耐铅胁迫的调控机制。
1 材料与方法
1.1 试验材料
供试植物小花南芥(Arabis alpinaL.var.parvifloraFranch)属于十字花科南芥属植物。小花南芥种子采自云南会泽铅锌矿区废弃地,试验用土采自云南农业大学后山科研基地。试验地点为云南农业大学后山科研基地,试验期平均气温为20 ℃,降水量为1 031 mm,相对湿度为74%,紫外线强度为3 级。试验用土基本理化性质见表1。

表1 试验用土基本理化性质Table 1 Basic physical and chemical properties of the test soil
1.2 试验设计
盆栽试验于2021 年云南农业大学农场温室大棚进行,试验基质土采自后山自然植被下的土壤,自然风干后过2 mm 筛,每盆装4 kg土壤。参考《土壤环境质量 农用地土壤污染风险管控标准》(GB 15678—2018)中农用地土壤铅污染风险管制值,设置铅胁迫浓度为1 000 mg·kg-1(以纯Pb2+计),以Pb(CH3COO)2溶液的形式与土充分混合均匀,平衡期为7 d;土壤与铅均质7 d后,设置不同硫浓度,采用Na2SO4(分析纯)配制,以计,配制浓度分别为0(CK)、25(S25)、50(S50)、100(S100)、200(S200)、400(S400)mg·kg-1,向土壤中加入外源硫溶液,充分混合均匀,均质期为7 d。每个处理3个重复,共计18盆,每盆移栽6株植物,随机排列,培养时间为50 d,培养期间进行常规的浇水管理。移栽培养50 d 后,收集植物分地上部、地下部制样备用,收集小花南芥根际土壤,自然风干后过筛备用。
1.3 指标测定
1.3.1 土壤基本理化性质
(1)参照鲍士旦[8]的测定方法测定全氮、全磷、全钾、碱解氮、速效磷、速效钾、有机质、pH。
(2)土壤中铅、硫含量:称取0.1 g 风干土样置于50 mL三角瓶中,用适量蒸馏水润湿,加浓硝酸3 mL,封口过夜,低温加热至微沸(140~160 ℃),待棕色氮氧化物基本赶完后,取下冷却。沿壁加入高氯酸5 mL,继续加热,样品呈灰白色糊状,取下冷却。将消化好的溶液过滤,转移到50 mL 容量瓶中,用去离子水多次洗涤三角瓶,最后用去离子水定容至50 mL。用火焰原子吸收分光光度计(北京,普析通用TAS-990 原子吸收)测定铅含量,采用全谱直读等离子体发射光谱仪(ICAP6300)测定硫含量。
1.3.2 植物生长指标
(1)根系形态:利用数字化扫描仪(STD1600 Epson,美国)扫描每盆6 株小花南芥的总根系,利用WinRhizo(Version 4.0B)对根系形态进行分析。
(2)生物量:收获的植株样先用自来水反复冲洗,后用去离子水浸泡10 min,最后再用去离子水洗净,用吸水纸吸干多余水分。将植株地上部和地下部置于105 ℃烘箱中杀青30 min,然后75 ℃烘干至恒质量,称取干质量,计算生物量。
1.3.3 小花南芥地上部和地下部铅含量
(1)称取0.1 g植物干样于消解罐中,加入3 mL硝酸后过夜,第2 天加入2 mL 30%过氧化氢,随后将消解罐放入140 ℃烘箱(DHG-9145A)消解4 h,取出冷却至室温。将消化好的溶液过滤,滤液转移到50 mL容量瓶中,用去离子水多次洗涤消煮罐壁,最后用去离子水定容到50 mL,测定铅含量。
(2)富集系数=植株地上部铅含量(mg·kg-1)/土壤铅含量(mg·kg-1)
(3)转运系数=植株地上部铅含量(mg·kg-1)/植株地下部铅含量(mg·kg-1)
(4)生物累积量(mg)=植株地上部铅含量(mg·kg-1)×植物地上部生物量(kg)+植株地下部铅含量(mg·kg-1)×植物地下部生物量(kg)。
1.3.4 小花南芥体内硫含量
将烘干的小花南芥的茎叶、根分别粉碎,各称取0.1 g,倒入消煮罐中加入2 mL 硝酸,过夜,加入2 mL过氧化氢溶液,将消煮罐放入烘箱,140 ℃加热4 h,进行消化。4 h 后,取出消煮罐,冷却至室温。将消化好的溶液过滤,滤液转移到50 mL 容量瓶中,用去离子水多次洗涤消煮罐壁,最后用去离子水定容到50 mL,测定硫含量。
1.3.5 小花南芥体内含硫化合物含量及酶活性
测定半胱氨酸(Cys)、乙酰丝氨酸(AS)的含量和硫酸化酶(ATPS)、乙酰丝氨酸水解酶(OASS)、半胱氨酸合成酶(OAS-TL)、γ 谷氨酰半胱氨酸合成酶(γ-ECS)、螯合肽合成酶(PCSase)、腺苷酰硫酸还原酶(APSR)、亚硫酸盐还原酶(SUR)的活性。
测定方法:称取地上部或地下部0.1 g 鲜样于2 mL 离心管中,加入提取液,置冰箱冰浴30 min,于高通量组织研磨器(SCIENTZ-48)中研磨成匀浆。置于高速冷冻离心机(HC-3018R)中冷冻离心,取上清液置冰上待测。根据试剂盒说明书(苏州格锐思生物技术有限公司),用紫外可见分光光度计(UV-5800)测定。
1.4 数据分析
试验数据用Excel 和SPSS 26 软件进行处理和统计分析,用Duncan′s 新复极差法进行差异显著性检验(Duncan,P<0.05)及Pearson 相关性分析,用Origin 2018绘图。
2 结果与分析
2.1 不同硫浓度对铅胁迫下小花南芥生长的影响
由图1 可知,不同硫浓度处理下,小花南芥地上部和地下部的生物量均增加。S25、S50、S100、S200、S400 处理下,地上部的生物量相比对照组分别增加了20.33%、29.74%、68.66%、94.61%、125.80%;地下部的生物量相比对照组分别增加了7.31%、54.48%、88.61%、90.67%、71.50%。由此得出,外源添加硫增加了小花南芥的生物量。
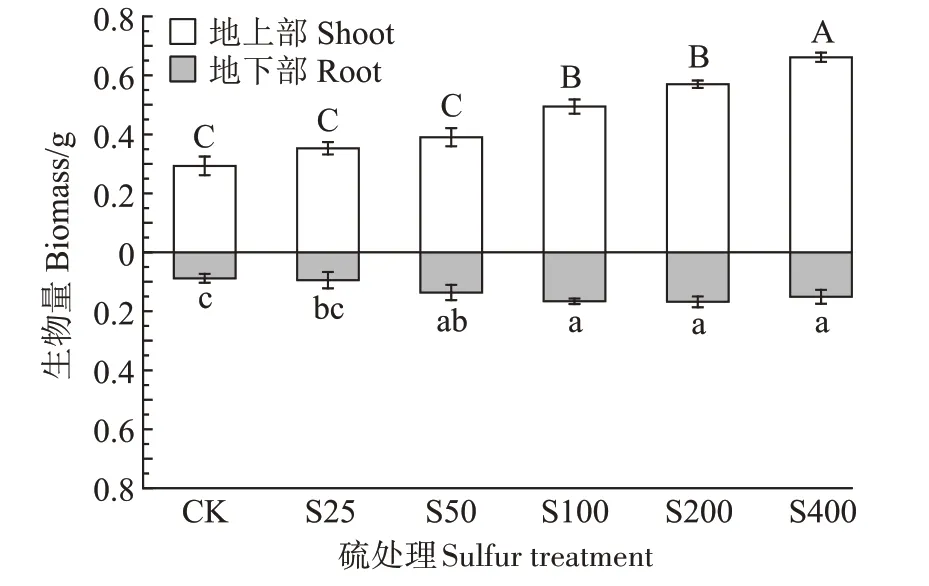
图1 不同硫浓度对小花南芥生物量的影响Figure 1 Effects of different sulfur concentrations on biomass of A.alpina
2.2 不同硫浓度对铅胁迫下小花南芥根系形态的影响
由表2 可知,与对照相比,在不同硫浓度处理下小花南芥根系形态发生显著改变。在硫处理浓度为50 mg·kg-1时,总根投影面积、总根表面积、根平均直径和总根体积分别是对照的2.2、2.4、1.8 倍和5.5 倍。总的来说,外源施加硫显著改变了小花南芥根系形态,促进了小花南芥根系的生长。
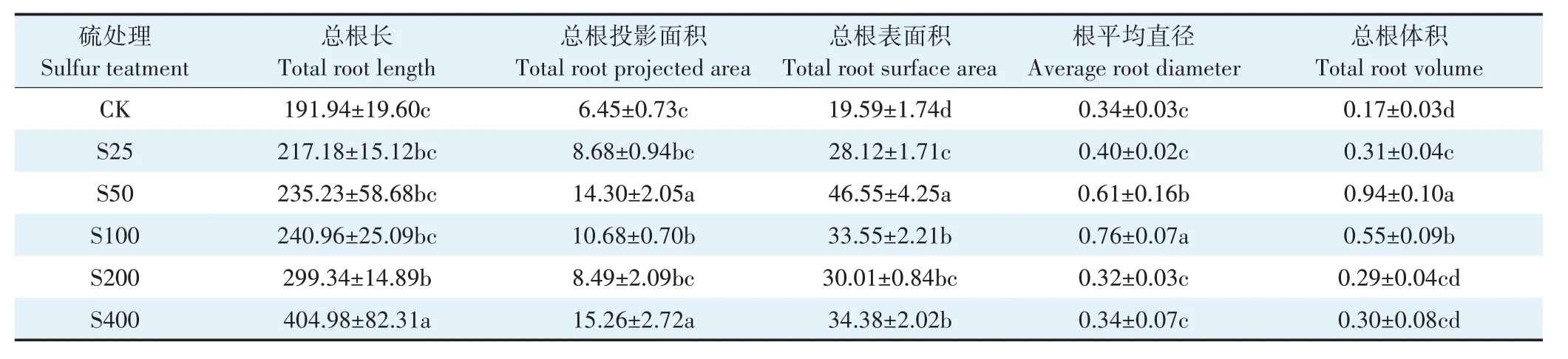
表2 不同硫浓度对小花南芥根系形态的影响Table 2 Effects of different sulfur concentrations on root morphology of A.alpina
2.3 不同硫浓度对小花南芥富集铅的影响
2.3.1 对小花南芥铅含量的影响
图2 为不同硫浓度下小花南芥地上部和地下部铅含量的变化。随着硫浓度的增加,小花南芥地上部铅含量呈现先上升再下降的趋势,在S50 处理下,铅含量达到最高值,为350.33 mg·kg-1,较对照显著增加了41.45%,而在S400 处理下,铅含量降低至220.67 mg·kg-1,较对照降低了10.90%;随着硫浓度的增加,小花南芥地下部铅含量呈现先下降再上升的趋势,在S400处理下铅含量达到最高值,为911.67 mg·kg-1,较对照显著增加了40.54%,而在S50 处理下,铅含量降低至557.67 mg·kg-1,较对照显著降低了14.03%。总的来说,低浓度的硫抑制小花南芥地下部对铅的吸收,高浓度的硫促进小花南芥地下部对铅的吸收。
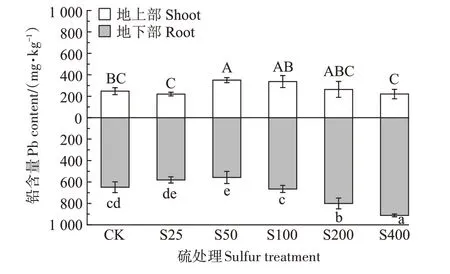
图2 不同硫浓度对小花南芥体内铅含量的影响Figure 2 Effects of different sulfur concentrations on lead content in A.alpina
2.3.2 对小花南芥吸收累积铅特征的影响
由表3 可知,不同硫浓度对小花南芥吸收铅的特征有不同的影响。S25、S50、S100、S200、S400 处理下,小花南芥的富集系数均比对照组高,分别是对照组的1.17、3.76、4.17、1.52、1.38倍;小花南芥的转运系数分别是对照组的1.00、1.66、1.34 倍和87%、63%。在S50 和S100 处理下,小花南芥的富集系数大于1,转运系数也处于较高水平,而高浓度的硫反而抑制了小花南芥对铅的转运,S200 和S400 处理下小花南芥的转运系数与对照组相比分别下降了13.2% 和36.8%。由此说明,外源添加硫促进小花南芥对铅的富集;低浓度的硫促进小花南芥对铅的转运,高浓度的硫抑制小花南芥对铅的转运。
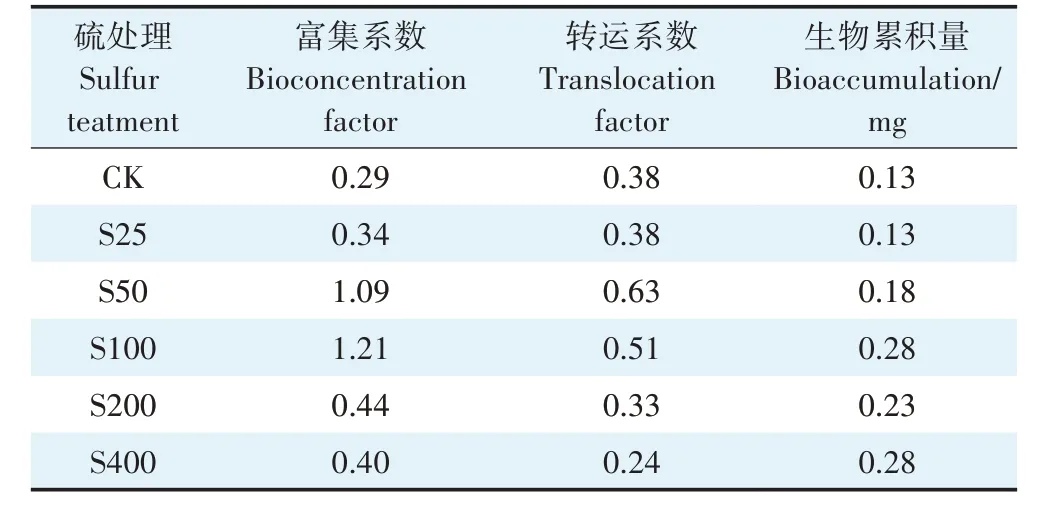
表3 不同硫浓度对小花南芥吸收铅特征的影响Table 3 Effects of sulfur mediated on Pb absorption characteristics of A.alpina
2.4 不同硫浓度对小花南芥硫同化关键酶活性的影响
2.4.1 对小花南芥体内ATPS和OASS活性的影响
ATPS 的活性如图3a 所示,外源添加硫增加了小花南芥地上部和地下部ATPS的活性。地上部整体呈先上升后下降趋势,且处理组间存在显著差异,在S50 处理下,ATPS 活性达到最高,为549.51 U·L-1,较对照显著增加21.66%;随着硫浓度的增加,地下部ATPS 活性呈上升趋势,在S400 处理下达到最高,为649.79 U·L-1。
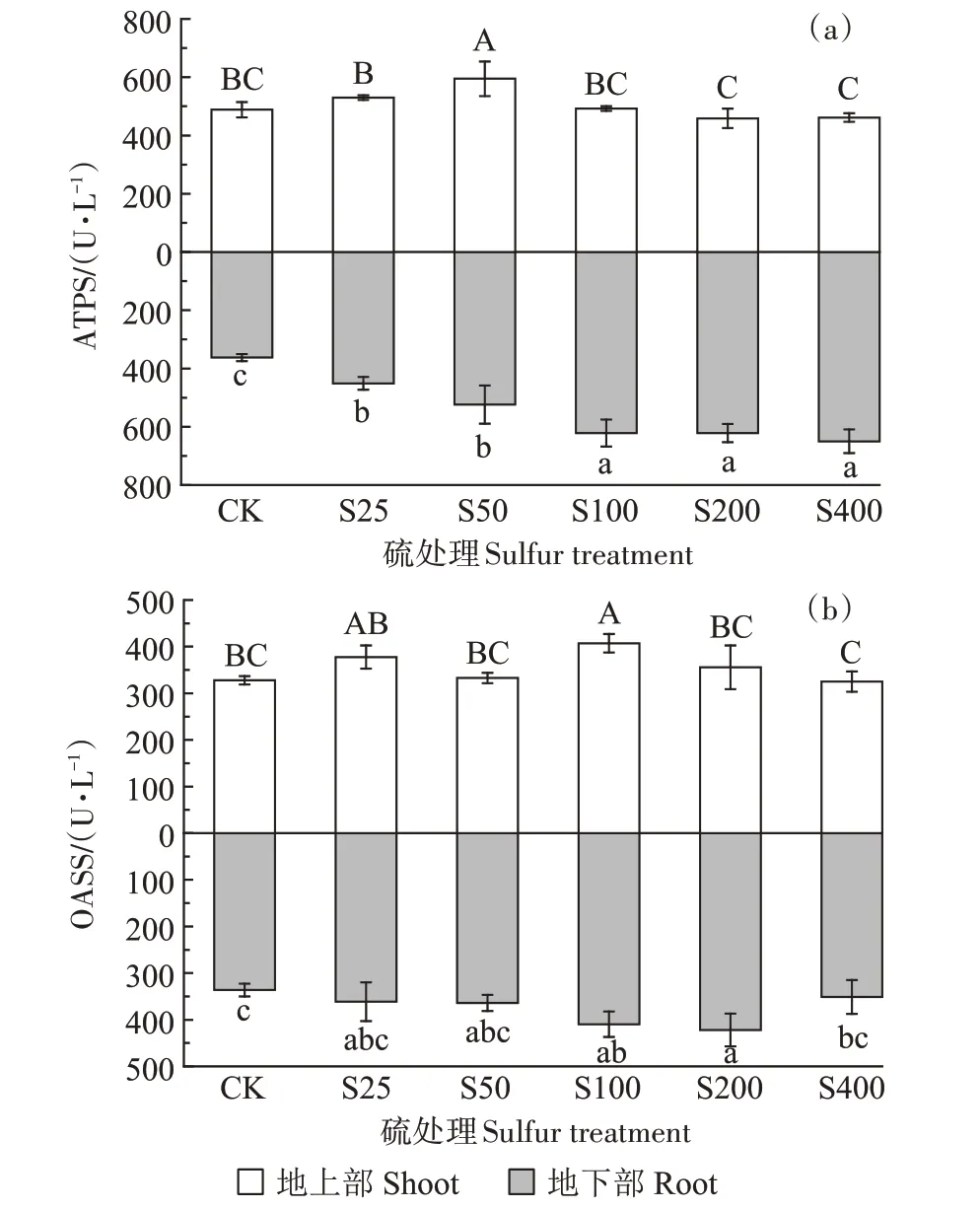
图3 不同硫浓度对小花南芥体内ATPS和OASS活性的影响Figure 3 Effects of different sulfur concentrations on ATPS and OASS activities in A.alpina
OASS 的活性如图3b 所示,外源添加硫增加了小花南芥地上部和地下部OASS 的活性。地上部和地下部均呈现先上升再下降的趋势,在S100 处理下,地上部OASS 活性达到最高,为407.19 U·L-1,较对照显著增加24.27%;在S200 处理下,地下部OASS 活性达到最高,为422.07 U·L-1。与S50 相比,S100 处理下地上部OASS 活性显著增加了22.38%,地下部增加了12.52%。
2.4.2 对小花南芥体内γ-ECS和OAS-TL活性的影响
γ-ECS 的活性如图4a 所示。地上部呈现先上升再下降的趋势,而地下部呈现先下降再上升的趋势。在S50 处理下,地上部γ-ECS 的活性达到最高,为348.02 U·L-1,较对照显著增加了29.80%,而地下部γ-ECS的活性达到最低,为210.25 U·L-1,较对照显著降低了28.45%。
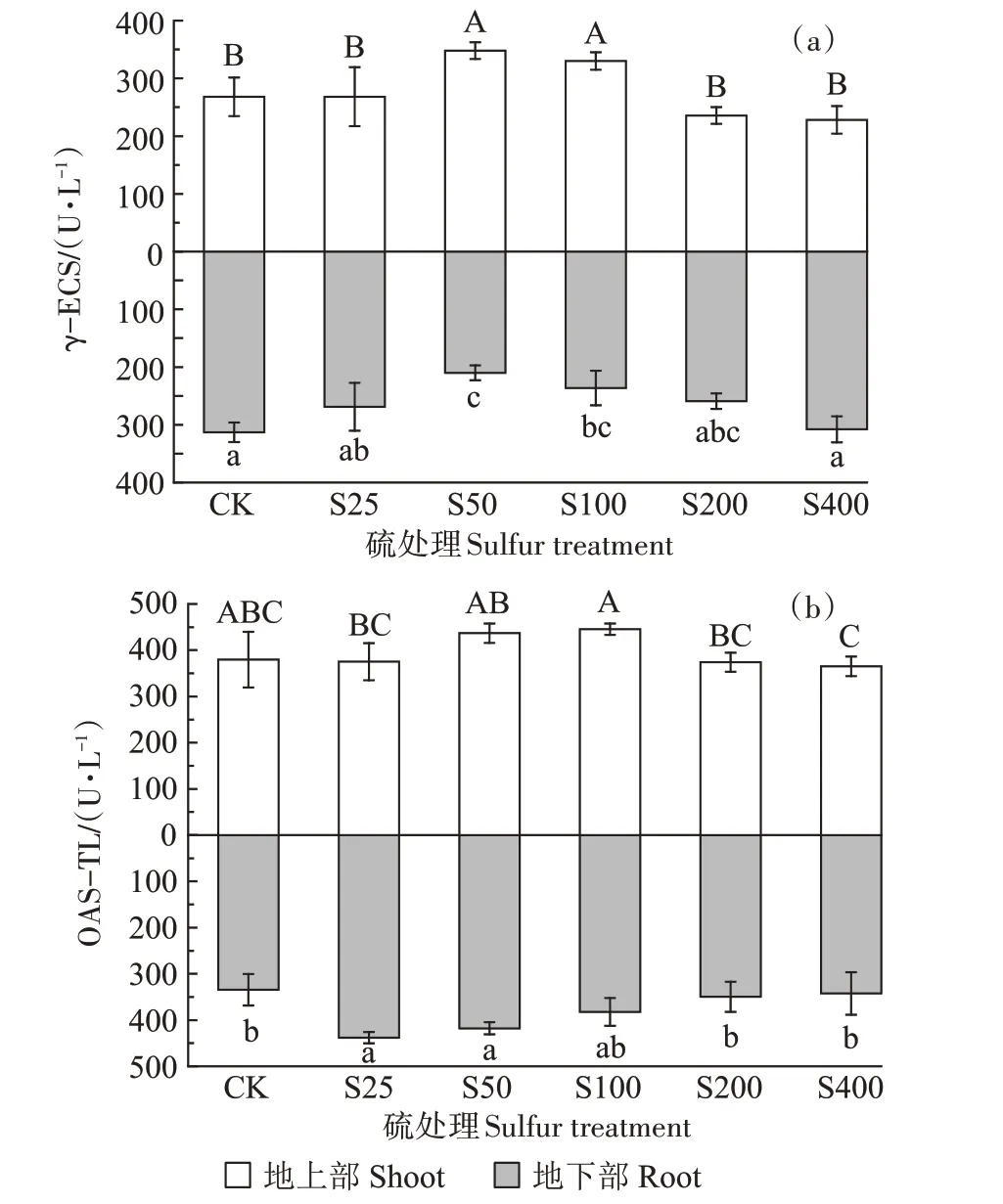
图4 不同硫浓度对小花南芥体内γ-ECS和OAS-TL活性的影响Figure 4 Effects of different sulfur concentrations on γ-ECS and OAS-TL activities in A.alpina
OAS-TL 的活性如图4b 所示。外源添加硫增加了小花南芥地上部和地下部OAS-TL 的活性。地上部呈现先上升再下降的趋势,在S50 处理下,OAS-TL活性较对照增加15.08%,在S100 处理时下OAS-TL的活性达到最高,为445.29 U·L-1;地下部在S25 处理下,OAS-TL的活性达到最高,为438.26 U·L-1,较对照显著升高了31.02%,随后随着硫浓度的升高,OASTL的活性逐渐降低。
2.4.3 对小花南芥体内PCSase、APSR 和SUR 活性的影响
PCSase 的活性如图5a 所示。随着硫浓度的增加,地上部呈现上升趋势,而地下部呈现下降趋势。在S100 处理下,地上部PCSase 活性较对照显著增加19.29%,在S400 处理下,PCSase 的活性达到最高,为852.89 U·L-1,较对照显著增加了29.54%;地下部在S400 处理下,PCSase 的活性降至最低,为536.54 U·L-1,较对照显著降低了33.89%。地上部PCSase 的活性均比地下部高。
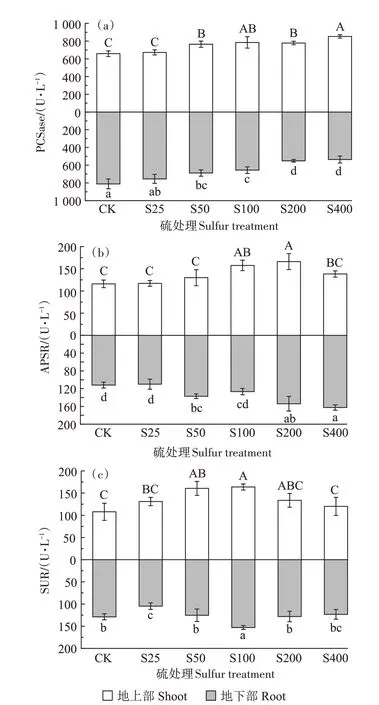
图5 不同硫浓度对小花南芥体内PCSase、APSR和SUR活性的影响Figure 5 Effects of different sulfur concentrations on PCSase,APSR and SUR activities in A.alpina
APSR 的活性如图5b 所示。外源添加硫增加了小花南芥地上部和地下部APSR 的活性,地上部和地下部整体呈现上升趋势,在S100 处理下,地上部APSR 活性较对照显著提升36.71%,在S200 处理下,地上部APSR 的活性达到最高,为166.16 U·L-1,较对照显著增加了43.18%;在S400 处理下,地下部APSR 的活性达到最高,为162.59 U·L-1,较对照显著增加了45.18%。
SUR 的活性如图5c 所示。地上部和地下部整体均呈现先上升再下降的趋势。与不施加硫相比,施硫处理地上部SUR 的活性均有提高,在S50 处理下SUR活性提高48.95%,且在S100 处理时SUR 的活性达到最高,为163.86 U·L-1,较对照显著增加了51.89%,而地下部分S25、S50、S200、S400 处理SUR 的活性均受到抑制,仅S100处理SUR的活性有所提高。
2.5 不同硫浓度对小花南芥体内硫和硫合成物质含量的影响
由图6 可知,在不同硫浓度处理下,小花南芥地上部和地下部的硫含量均呈现先上升后下降的趋势。地上部S25、S50、S400 处理小花南芥体内硫含量与对照无显著差异,而S100 处理下,小花南芥体内硫含量与对照相比显著增加了49%;地下部S25、S200、S400处理小花南芥体内硫含量与对照无显著差异,在S100处理时达到最大,为29.17 mg·L-1。
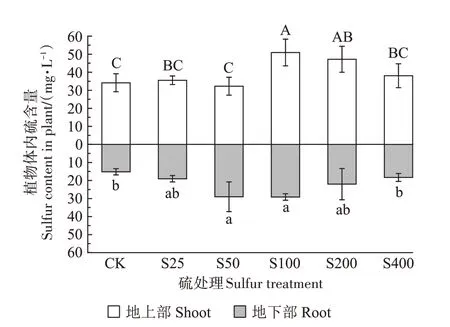
图6 不同硫浓度对小花南芥体内硫含量的影响Figure 6 Effects of different sulfur concentrations on sulfur contents in A.alpina
硫素对小花南芥体内硫合成物质半胱氨酸(Cys)和乙酰丝氨酸(AS)含量的影响见图7。小花南芥地上部Cys 的含量整体随着硫浓度的增加而增加,在S50 和S100 处理下,Cys 含量较对照分别增加18.10%和7.96%。在S400 处理下达到最高,为89.09 ng·L-1;小花南芥地下部Cys 的含量随着硫浓度的增加呈现先增加后降低的趋势,在S50 处理时达到最高,为89.49 ng·L-1,较对照增加11.93%,而在S400处理时降至最低,为66.02 ng·L-1。不同硫浓度下,小花南芥地上部和地下部的AS含量均随着硫浓度的增加先降低后增加,地上部均比对照组的含量低,地下部在S200处理时达到最高,为188.85 ng·L-1。
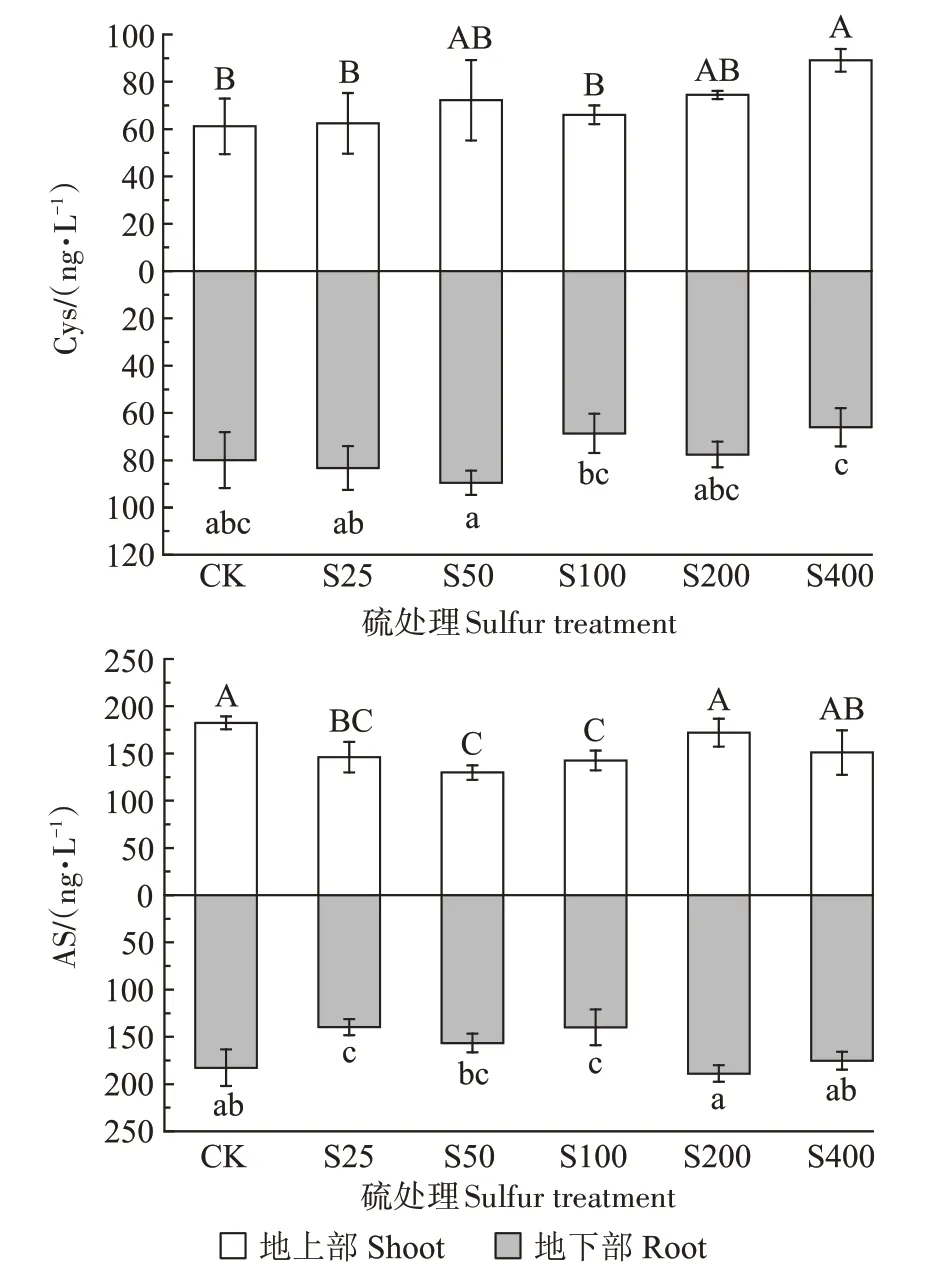
图7 不同硫浓度对小花南芥体内Cys和AS含量的影响Figure 7 Effects of different sulfur concentrations on the contents of Cys and AS in A.alpina
2.6 不同硫浓度下小花南芥关键同化酶活性与铅的相关性
2.6.1 地上部铅含量与含硫化合物及酶活性的相关性由表4 可知,小花南芥地上部铅含量与地上部OAS-TL、SUR 具有显著正相关性(P<0.05),与地上部γ-ECS具有极显著正相关性(P<0.01)。

表4 小花南芥地上部铅含量与含硫化合物及酶活性的相关性Table 4 Correlations between Pb content and sulfur compounds and enzyme activities in shoots of A.alpina
2.6.2 地下部铅含量与含硫化合物及酶活性的相关性由表5 可知,小花南芥地下部铅含量与地下部OAS-TL 呈显著负相关,与地下部PCSase、Cys 呈极显著负相关,与地下γ-ECS 呈显著正相关,与APSR 呈极显著正相关。
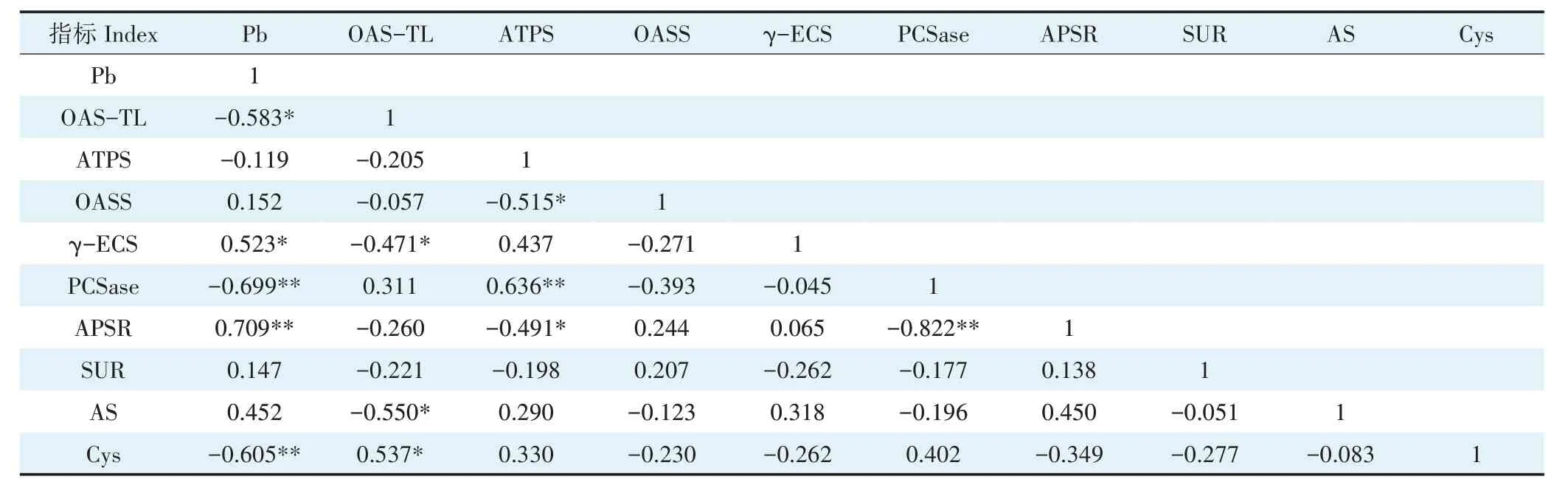
表5 小花南芥地下部铅含量与地下部含硫化合物及酶活性的相关性Table 5 Correlations between Pb content and sulfur compounds and enzyme activities in roots of A.alpina
3 讨论
3.1 施硫对小花南芥生长及铅富集特征的影响
硫是植物生长的必需元素,参与植物体内许多重要的生理过程[9],在植物的生长发育和逆境反应过程中发挥重要的作用[10]。在重金属胁迫下,外源施硫可以改善植物的生长、生理代谢过程[5]。梁泰帅等[11]发现外施硫50 mg·kg-1可促进小白菜的生长和光合作用。外源施加硫促进不结球白菜、蓖麻、玉米、水稻等生物量的增加[12-15]。本试验中,在铅胁迫下,不同浓度的硫促进小花南芥地上部和地下部的生物量增加。S50 处理总根投影面积、总根表面积、根平均直径和总根体积分别是对照的2.2、2.4、1.8 倍和5.5 倍,显著改变了小花南芥根系形态,促进小花南芥的生长。
不同硫浓度处理下小花南芥的富集系数均比未添加硫处理高,与王吉秀等[4]的研究结果一致。这可能是由于外源施加硫改变了土壤的理化性质,造成土壤pH下降,土壤重金属被活化,进而增加了土壤中重金属的生物有效性[16],促进超富集植物对重金属的吸收。S50 和S100 处理下小花南芥转运系数是对照组的1.66 倍和1.34 倍,地上部铅含量显著提高,地下部铅含量显著下降;S400处理小花南芥转运系数是对照组的63%,地上部铅含量降至最低值,地下部铅含量达到最高值,该趋势与牟凤丽等[5]的研究结果一致。这可能是由于高浓度的硫处理中小花南芥地下部含硫化合物合成较多,使得更多的铅被固定在地下部,降低了向地上部的转移,从而减少了铅的转运。这表明铅胁迫下低浓度的硫促进小花南芥对铅的转运,而高浓度的硫明显抑制了小花南芥对铅的转运。
3.2 施硫对含硫化合物合成的影响
Cys 是植物硫同化过程的第一个有机产物[17],是硫代谢的中心产物。GSH在缓解金属毒害、增加植物对金属的耐受性方面起着重要的作用[17]。外源添加硫增加了植物体内Cys、GSH 等含硫氨基酸、多肽的生物合成量,提高了植物对镉的耐性[10]。在硫供应充足时,施硫会促进半胱氨酸的生成,不会使AS发生积累[18]。牟凤丽等[5]的研究表明在铅胁迫下,施硫增加了小花南芥体内Cys 的含量。本研究中,在铅胁迫下外源添加硫增加了小花南芥体内Cys 的含量,与对照组相比,施硫条件下小花南芥地上部Cys 的增加量比地下部要多,但地下部Cys 含量整体上比地上部高,且小花南芥地下部铅含量与地下部Cys 的含量具有极显著负相关性,也解释了前文提到的高浓度的硫明显抑制了小花南芥对铅的转运。
AS 是合成Cys 的重要前体,S50 和S100 处理下,外源添加硫显著降低了小花南芥体内AS的含量。本试验处理施硫增加了Cys 的含量,降低了AS的含量,这可能是由于施硫给植物体内提供了充足的硫元素,使OASS和OAS-TL活性增加,从而增加了AS的含量,进一步使更多的AS 合成了Cys,最终出现了Cys 含量增加而AS含量降低的现象。由此推测,铅胁迫下施硫增加了小花南芥体内Cys 的含量,从而进一步增加了GSH的合成,GSH通过自身的氧化作用或者在谷胱甘肽转移酶作用下使GSH与铅结合并转移至液泡,减少铅向地上部的转运,从而降低了铅对小花南芥的毒害作用,增加了小花南芥地下部对铅的吸收。
3.3 施硫对硫同化关键酶合成含硫化合物的影响
硫同化关键酶在植物合成含硫化合物的过程中起着至关重要的的作用。ATPS 和OASS 作为植物硫素同化的关键酶,分别参与硫酸盐的活化和半胱氨酸的合成[19]。OAS-TL 是合成Cys 过程中最后一步的硫同化关键酶。本研究显示,外源添加硫均增加了小花南芥地上部和地下部ATPS、OASS、OAS-TL、APSR 的活性,而且地上部铅含量与地上部OAS-TL 活性有显著正相关性,地下部铅含量与地下部OAS-TL 活性有显著负相关性,地下部的铅含量与地下部APSR 的活性有极显著正相关性。孔灵君等[20]发现,在大葱生长的中后期适量提高供硫水平显著增强了OASS 的活性;梁泰帅[21]发现施硫提高了镉胁迫下小白菜体内ATPS 和OAS-TL 酶活性,与本试验结果一致。这可能是由于施硫增加了ATPS、OASS、APSR 的活性,促进植物体内硫素的同化,APSR 催化APS 生成SO2-3,进而促使合成更多的Cys 的重要前体S2-。同时OAS-TL 活性的增加,使游离的OAS-TL 催化生成了更多的Cys,在这个过程中利用了累积的AS 作为底物,降低了AS 的水平,促进Cys 的形成,与前文提到的铅胁迫下施硫导致AS 含量下降、Cys 含量增加的结果相互印证。
γ-ECS 是合成GSH 的限速酶之一。GSH 在缓解金属毒害、增加植物对金属的耐受性方面起着重要的作用[17]。在GSH 代谢过程中,由OAS-TL 产生的Cys必须经过γ-ECS 催化形成谷氨酰半胱氨酸,进而在谷胱甘肽合成酶作用下形成GSH,同时谷氨酰半胱氨酸的表达量又会反向调节γ-ECS 活性[21]。S50 和S100 处理增加了地上部γ-ECS 的活性。相关性分析表明,地上部铅含量与地上部γ-ECS活性有极显著正相关性。王世华等[22]在针对水稻的研究中也发现,Cd胁迫下,水稻地上部的γ-ECS 合成酶表达量有所提高,从而使地上部GSH 含量高于对照组。由此推测,铅胁迫下低浓度的硫增加了γ-ECS的活性,从而促进GSH 的产生,增强小花南芥对铅的耐受能力,缓解铅引起的氧化胁迫。
在重金属胁迫下,植物会通过增强硫同化过程应对重金属引起的胁迫效应[17]。孙惠莉等[23]的研究表明,镉硫交互处理明显增加了小白菜幼苗体内非蛋白巯基、谷胱甘肽和络合素的含量以及坏血酸-谷胱甘肽循环关键酶的活性,从而提高植株对镉胁迫的耐受性。适量的硫供给可促进植物生长发育,增强植物耐受生物和非生物胁迫的能力[24]。本研究表明,在铅胁迫下,外源添加硫增加了硫同化关键酶的活性,进而促进了含硫化合物的合成,增强了小花南芥对铅的富集和耐受能力。
4 结论
(1)外源施加硫浓度50~100 mg·kg-1,显著提高了小花南芥地下部的生物量,改变了小花南芥根系形态特征。
(2)适量施加硫能够改变小花南芥对铅的累积特征,低浓度硫促进小花南芥对铅的富集,而高浓度硫抑制了小花南芥对铅的转运。
(3)外源施加硫浓度50~100 mg·kg-1,增加了硫关键同化酶的活性,进而促进了含硫化合物的合成。
总而言之,适当施硫促进小花南芥的生长,提高硫同化关键酶活性和含硫化合物含量,从而对小花南芥富集铅有促进作用,同时增强了小花南芥对铅胁迫的耐性,提高了超富集植物小花南芥修复铅污染农田的能力。

