添加Delftia sp.B9对土壤Cd形态分布及水稻吸收积累Cd的影响
刘玉玲,姚俊帆,丁司铎,伍德,张朴心,铁柏清,罗斯
(1.湖南农业大学资源环境学院,长沙 410128;2.湖南省灌溉水源水质污染净化工程技术研究中心,长沙 410128)
土壤重金属污染具有不可降解性、累积性和高毒性[1],进入土壤后会造成作物质量和产量下降,同时通过食物链在生物体内累积,对生物体造成不可逆的损害[2-3]。水稻是我国主要的粮食作物之一[4],近年来,镉(Cd)污染已成为南方地区突出的粮食安全问题。土壤中Cd 主要以Cd2+形态通过水稻根系进入水稻体内,再经木质部装载并转运至地上部分,被分配至各组织器官后沉积,其毒性作用会造成水稻产量降低、籽粒Cd 含量超标[5]。如何降低土壤中Cd 的有效性、降低稻米Cd 污染、保证稻米安全生产,是Cd 污染地区亟待解决的问题。
近年来,针对土壤Cd污染问题,微生物修复法得到越来越多关注。微生物作为土壤中的活性胶体,具有比表面积大、带电荷、代谢活动旺盛、种类繁多、数量多等特点,土壤微生物不仅参与土壤中污染物的循环过程,还可作为环境载体吸附重金属污染物[6]。微生物对土壤中重金属的钝化作用主要通过生物吸附、转化、沉淀及溶解作用实现[7]:①微生物可通过细胞壁表面的官能团(如巯基、羧基和羟基等)以离子或共价键形式吸附Cd[8];②可通过离子转运系统将Cd 吸收到细胞内特定部位并固定[9];③其代谢产物能与Cd形成胞外络合物,促进生物矿化或沉淀[10];④具有特定功能的微生物(如硫酸盐还原菌)能够将硫酸盐还原成S2-、HS-和H2S,进一步与Cd 反应生成难溶性金属硫化物[11-12]。由此可见,微生物可通过降低土壤中Cd 的生物有效性抑制水稻根系对Cd 的吸收。另外,具有根际促生能力的菌株通过根表定殖成为拦截水稻吸收转运Cd 的一道屏障,降低植物对Cd 的吸收和转运,提高植株的总抗氧化能力[13-14]。
微生物是土壤的重要组分,其群落组成、活性和稳定性对土壤功能非常重要[15]。外源添加细菌会造成土壤微生物生存环境的改变,导致土壤微生物群落组成和功能发生一系列的变化。分析土壤微生物群落结构组成及多样性等指标可为农田生态系统的修复过程提供有价值的信息。细菌Delftiasp.B9 是从Cd 污染土壤中筛选分离的一株耐Cd 细菌[16],Delftia菌属是1999 年由Wen 等[17]建立的菌属,目前对该类菌的研究主要集中于其对有机污染物的降解或对金属的转化[18-20]。本课题组前期研究已表明菌株B9 能改变土壤中的Cd 形态,其机理主要是通过蛋白质上的官能团吸附Cd2+[21],减少生物可利用Cd 的含量,从而降低水稻对Cd 的吸收[5,22]。但对于该菌株降低土壤有效态Cd 含量及减少稻米吸收Cd 的适宜用量还未进行研究,不同外源添加量对土壤微生物群落的影响也尚不清楚,且该菌株多用于盆栽试验,还未有研究将其用于环境复杂和条件不可控制的田间试验。
本研究使用耐Cd 菌株B9,研究其不同添加量对土壤Cd 形态、水稻吸收积累Cd 以及土壤微生物群落结构的影响,并综合盆栽试验结果选择合理添加量进行田间试验验证,选择水肥施用更加均匀、日常管理更加精细但面积较小的小区试验,以及面积更大、水肥及日常管理更加贴近于实际农业生产活动的大区试验,为菌株B9的实际应用提供理论参考。
1 材料与方法
1.1 供试材料
1.1.1 供试菌株
本研究所用耐Cd 菌株为Delftiasp.B9,分离自湖南省株洲市霞湾地区某冶炼厂周边表层土壤[16]。基因登录号:MF679148,菌种保藏号:CGMCC No.16073。
试验用菌液按照文献[21]所述方法制备。
1.1.2 供试土壤
盆栽试验土壤采自湖南省株洲县南州镇泗马村稻田,采样深度0~20 cm。土壤理化性质如表1所示。土壤总Cd 含量是《土壤环境质量农用地土壤污染风险管控标准(试行)》(GB 15618—2018)规定Cd 污染风险筛选值的3.4倍。
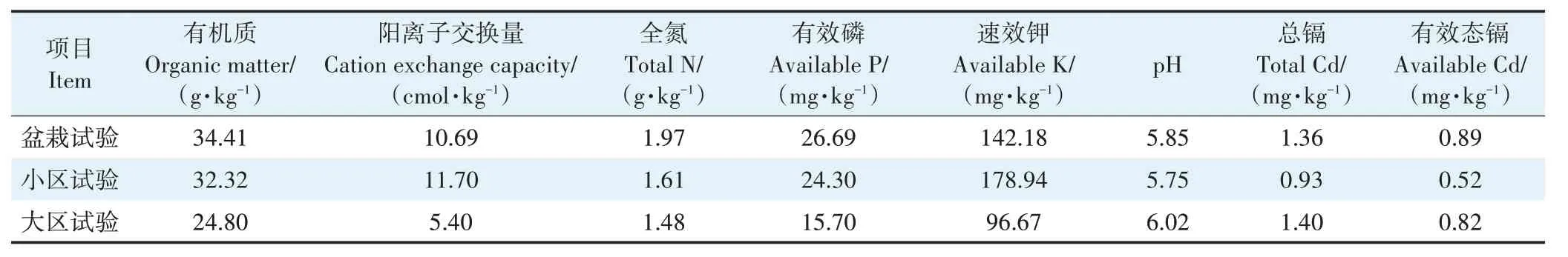
表1 供试土壤基本理化性质Table 1 Basic physicochemical properties of the paddy soils
田间试验包括小区试验和大区试验。小区试验位于湖南省株洲县南州镇,大区试验位于湖南省长沙市浏阳市蕉溪乡,其土壤理化性质见表1。
1.1.3 供试水稻
根据当地种植习惯,盆栽及小区试验种植双季早晚稻(早稻:中嘉早17 号,籼型常规稻;晚稻:泸优9803,籼型三系杂交稻),大区试验种植单季中稻(晶两优华占,籼型两系杂交稻),试验所用水稻品种均为湖南省农业农村厅推荐的Cd低积累水稻品种。
(2) 当接近真实地应力释放率后再进行支护,对比支护前后的变形及力学特征可知,支撑前后的位移,应力和应变分布基本相同,但剪切应力和剪切应变有一定程度的降低。这表明在地面应力释放速率达到一定水平后,特别是当它接近真实的应力释放速率时,支撑效果更好。
1.1.4 盆栽试验桶
盆栽桶为红色聚乙烯材质,上口直径36 cm、下口直径33 cm、桶高30 cm。每个盆栽桶装入25 kg 风干土壤。土壤淹水紧实后,土层表面积约为0.10 m2。
1.2 试验设计
盆栽试验于2020 年进行,早晚稻移栽及收获与当地种植习惯一致。新鲜菌液于早稻移栽前7 d施入盆栽土壤中并混匀,晚稻种植前不再施用。试验设置4个处理(表2),每个处理重复3次。水稻移栽前3 d,根据当地正常的水稻栽培施肥量进行换算,每个试验桶中均匀施加复合肥6.67 g。肥料与土壤混匀,淹水3~5 cm。选取长势均匀一致的秧苗移栽至盆内,每盆种植5蔸,每蔸3株。其他管理措施按当地习惯进行。

表2 盆栽种植试验设计Table 2 Details of treatments of pot experiments
田间试验(小区试验和大区试验)于2021 年进行,根据盆栽试验结果,选取对水稻降Cd效果最佳的菌株添加量作为田间试验菌株添加量,新鲜菌液于水稻移栽前7 d均匀施入土壤(仅施用一次)。小区试验设置对照组和试验组(表3),每组试验重复3 次,共6个小区,每个小区面积为30 m2。小区间作埂高30 cm,覆盖农膜,并留30 cm 宽的灌排水沟,单排单灌。在全生育期进行淹水处理,施肥及病虫害管理参照当地习惯进行。大区试验设置对照组和试验组(表3),每组面积约为666.67 m2,两组田块间作埂高30 cm。在全生育期进行淹水处理,施肥及病虫害管理参照当地习惯进行。由于小区及大区试验所需菌液量大,菌株B9 利用发酵罐培养后进行抽滤浓缩,施用前将新鲜菌液稀释至12.50 g·L-1撒施于土壤并混匀。

表3 田间小区及大区试验设计Table 3 Details of treatments of field experiments
1.3 测定指标与方法
盆栽土壤pH:在水稻分蘖期、抽穗期、成熟期采用氧化还原电位(ORP)去极化法全自动测定仪(FJA-6 型,南京传滴仪器设备有限公司,中国)原位测定土壤pH。
水稻根茎叶和籽粒Cd 含量:盆栽种植试验分别于水稻分蘖期、抽穗期、成熟期采集植株样品,小区及大区试验于水稻成熟期采集稻米样品,植株样品各部位按照文献[22]所述方法进行处理,采用电感耦合等离子体发射光谱(ICP Optima8300,PE 公司,美国)测定Cd的含量。
盆栽土壤Cd 测定:土壤样品与水稻样品同步采集。土壤风干后研磨,过0.15 mm 的尼龙筛,标记好装入塑料密封袋内保存待用。土壤样品经混合酸HCl-HNO3-HClO4消解、定容。土壤有效态Cd 采用DTPA 法[23]提取。土壤Cd 形态分析采用BCR 顺序提取法[24],提取弱酸可溶态、可还原态、可氧化态、残渣态(消解法)。土壤Cd含量均采用ICP测定。
1.4 数据处理及分析
运用IMB SPSS 22.0 对数据进行统计分析,差异显著性采用ANOVA 单因素方差分析。运用Origin 8.5 软件对数据进行图表处理。Pearson 相关性分析、冗余分析及聚类分析采用R 3.5.3完成。
2 结果与分析
2.1 添加菌株B9对盆栽土壤pH的影响
在水稻种植期间,各处理土壤pH值均有升高(图1)。与对照(CK)相比,添加菌株B9 的处理(T1、T2、T3)在水稻生长不同时期均能明显提高土壤pH。早稻成熟期,各处理pH 大小表现为T3>T2≈T1>CK;与CK 相比,T1、T2、T3 分别使土壤pH 显著增加1.57%、2.20%、2.97%。晚稻成熟期,T1、T2、T3 处理土壤pH无显著性差异,但均显著高于CK;与CK 相比,T1、T2、T3 分别使土壤pH显著增加1.29%、2.06%、2.13%。
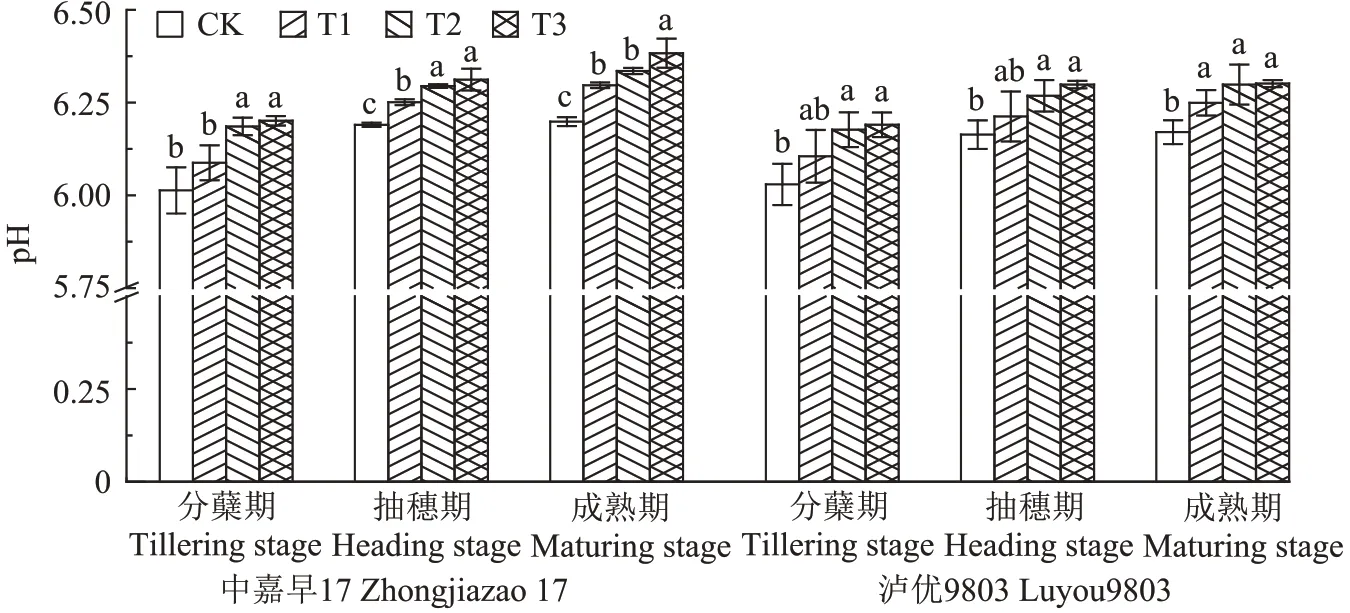
图1 菌株B9不同添加量对盆栽土壤pH的影响Figure 1 Effects of biomass content of Delftia sp.B9 on soil pH value in pot experiments
2.2 添加菌株B9对盆栽土壤Cd有效态及各形态分布的影响
添加菌株B9 各处理均能降低盆栽土壤有效态Cd 含量(图2)。与CK 相比,早稻成熟期T1、T2、T3处理土壤有效态Cd 含量分别显著降低4.72%、14.57%、11.48%;晚稻成熟期T1、T2、T3处理土壤有效态Cd含量分别显著降低8.06%、15.65%、12.52%。其中,T2处理有效态Cd含量在早晚稻成熟期均显著低于其他处理。
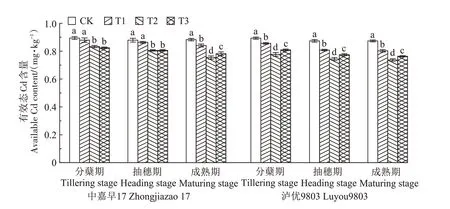
图2 菌株B9不同添加量对盆栽土壤有效态Cd的影响Figure 2 Effects of biomass content of Delftia sp.B9 on soil available Cd in pot experiments
盆栽试验土壤中Cd 各形态占比如图3 所示:弱酸可溶态>可还原态>残渣态>可氧化态。与CK 相比,T1、T2、T3 处理均能使早、晚稻成熟期土壤Cd 形态发生改变。其中,弱酸可溶态Cd含量均显著降低,可还原态、可氧化态、残渣态Cd 含量均增加。与CK相比,T1、T2、T3 处理早、晚稻成熟期弱酸可溶态Cd含量分别显著减少3.33%~10.13%、4.33%~9.77%,弱酸可溶态Cd 降幅表现为T2>T3>T1;可还原态Cd 含量分别显著增加1.87%~4.33%、3.30%~6.07%;早、晚稻成熟期残渣态Cd 含量均显著增加,残渣态Cd 增加量表现为T3>T2>T1,但T1、T2、T3 处理之间无显著差异;早稻成熟期,T2 处理土壤可氧化态Cd 含量显著增加;晚稻成熟期,T2、T3 处理均能显著增加土壤可氧化态Cd含量。
图3 不同菌株B9添加量对盆栽土壤Cd形态的影响Figure 3 Effects of biomass content of Delftia sp.B9 on soil Cd speciations in pot experiments
土壤pH、有效态Cd 及Cd 形态之间的相关性结果如表4所示。pH与有效态Cd含量呈极显著负相关(P<0.01),相关系数为-0.70;pH 与弱酸可溶态Cd 呈极显著负相关(P<0.001),相关系数为-0.71。pH 与可还原态Cd 呈极显著正相关(P<0.001),相关系数为0.66。有效态Cd 含量与可还原态Cd 含量、可氧化态Cd 含量、残渣态Cd 含量均呈极显著负相关(P<0.001),相关系数分别为-0.92、-0.64、-0.72。
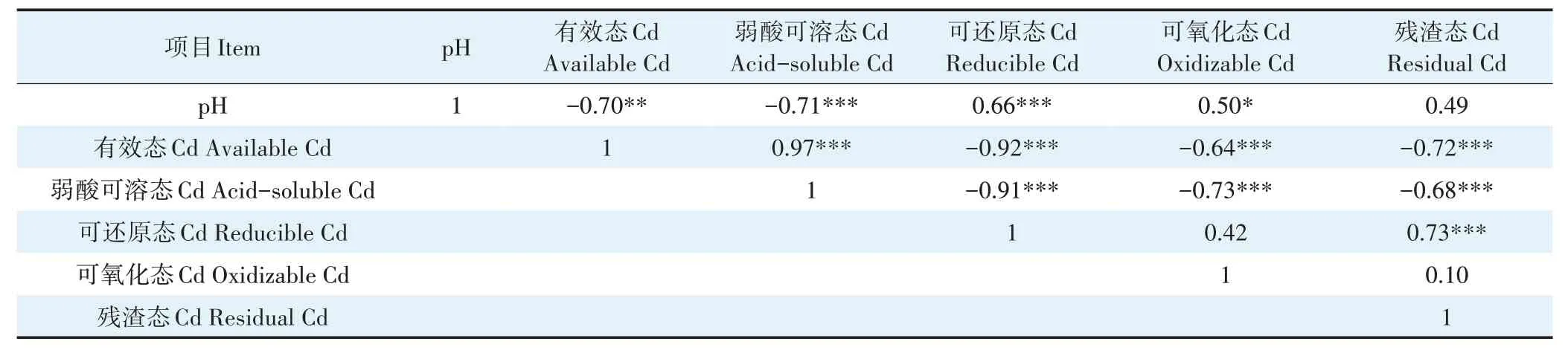
表4 盆栽土壤中pH与Cd形态间的皮尔森相关性分析Table 4 Pearson correlation analysis between soil pH and Cd speciations in pot experiments
2.3 添加菌株B9对水稻吸收积累Cd的影响
2.3.1 对盆栽种植水稻各部位Cd的影响
与CK 相比,添加菌株B9的处理均可以减少盆栽试验早晚稻各部位Cd 含量(图4)。与CK 相比,T2、T3 处理可使早稻(中嘉早17)根部Cd 含量分别显著减少32.61%、15.84%(图4a);T1、T2 均可显著减少早稻茎和叶中Cd 含量;T1、T2、T3 均可显著减少早稻谷壳和糙米中Cd 含量,糙米中Cd 含量分别显著减少55.10%、59.90%、22.87%。在盆栽早稻试验中,所有处理的糙米中Cd 含量均低于0.20 mg·kg-1,均符合《食品安全国家标准食品中污染物限量》(GB 2762—2017)标准要求。
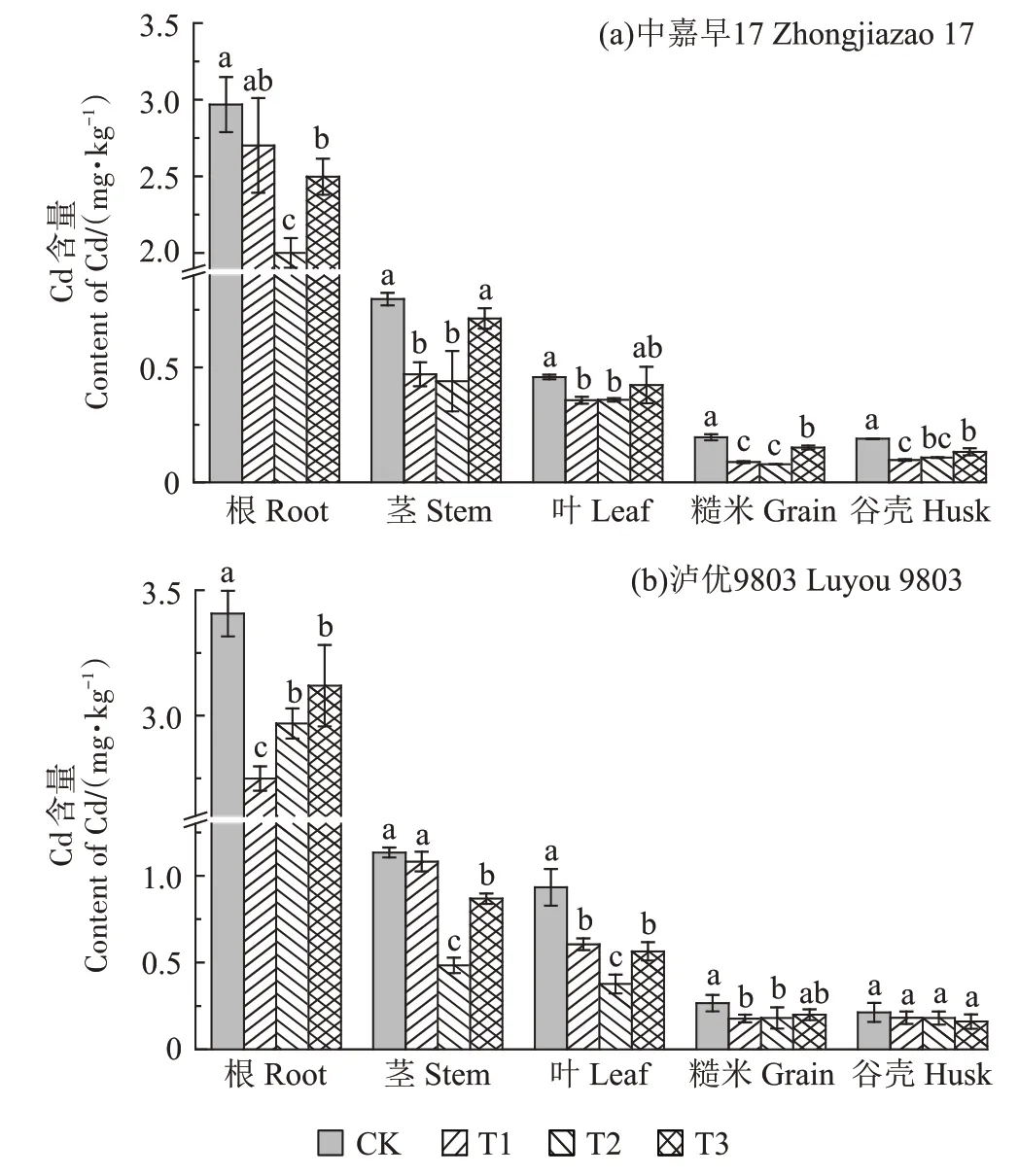
图4 不同菌株添加量对盆栽种植水稻各部位Cd含量的影响Figure 4 Effects of biomass content of Delftia sp.B9 on Cd content in rice organs
在盆栽晚稻试验中(图4b),与CK 相比,T1、T2、T3 处理均可减少晚稻(泸优9803)根、叶、糙米Cd 含量,晚稻糙米中Cd 含量分别降低33.34%、32.05%、25.05%,糙米中Cd 含量均降至0.20 mg·kg-1以下,达到国家食品卫生标准允许的Cd含量水平。
2.3.2 对田间小区及大区试验稻米Cd的影响
综合盆栽试验结果可以得出,T2 处理对土壤Cd的钝化效果及降低水稻积累Cd的效果最佳,因此,选择T2 处理的菌株B9 添加量进行小区及大区试验来验证B9 在田间试验中的效果。由图5 可以看出,在小区试验(株洲早晚稻)及大区试验(浏阳中稻)中,与对照组相比,添加菌株B9 均能显著降低水稻糙米中Cd 含量。株洲小区试验早、晚稻糙米中Cd 含量均未超过0.20 mg·kg-1,但添加菌株B9的试验组糙米Cd含量与对照组相比分别显著减少28.38%、31.34%。浏阳大区试验(晶两优华占)中,对照组糙米Cd 含量达到0.35 mg·kg-1,添加菌株B9的试验组糙米Cd含量为0.03 mg·kg-1,显著降低91.43%。添加菌株B9 的各试验组均可显著减少稻壳中Cd 含量。因此,施用12.50 g·m-2菌株B9可以显著降低田间试验稻米Cd含量。
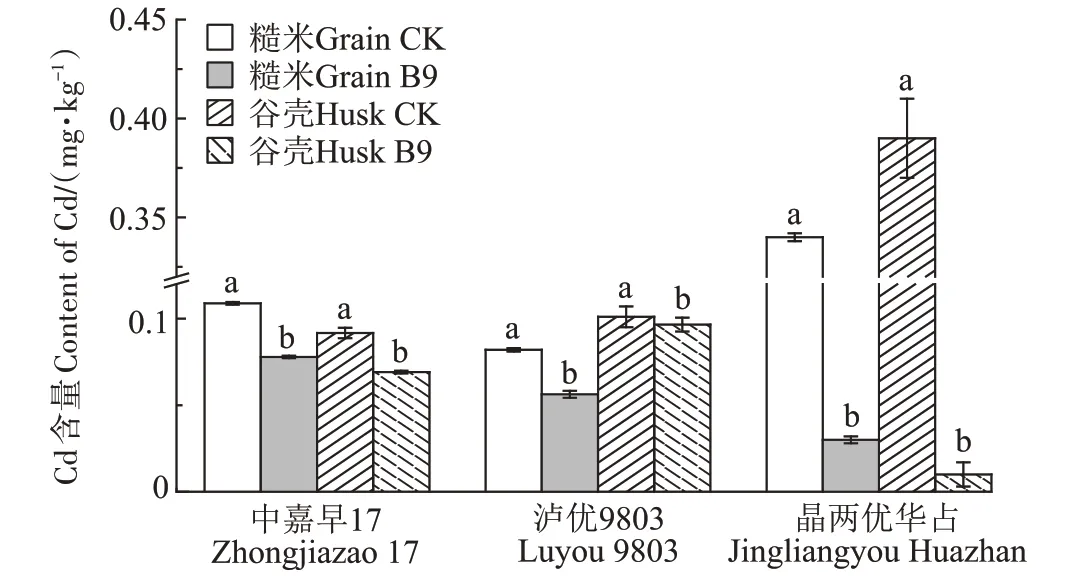
图5 添加菌株对Cd污染稻田水稻籽粒Cd含量的影响Figure 5 Effects of Delftia sp.application B9 on Cd content in rice grains of Cd-contaminated rice fields
2.4 添加菌株B9 对盆栽土壤微生物多样性及群落结构的影响
不同B9添加量对土壤微生物多样性指数的影响见表5。各处理高通量测序覆盖率均大于99%,反映测序结果样本中物种覆盖率高。与种植水稻前原始土壤相比,添加菌株B9并种植早晚稻后,各处理土壤群落多样性均显著增加。种植早晚稻后,与CK相比,T2、T3 处理Shannon 指数显著增加,但各处理间Simpson指数无显著差异。从微生物群落丰富度指数来看,与CK 相比,T2、T3 处理的ACE 指数分别显著增加6.32%、6.16%;Chao1 指数分别增加7.01%、6.32%;但T1处理的ACE、Chao1指数显著降低。
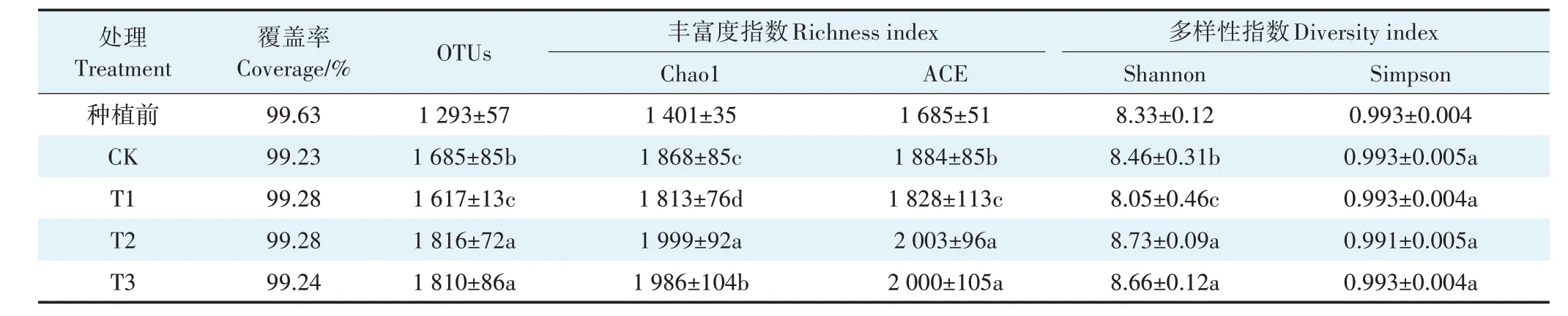
表5 盆栽试验土壤微生物多样性指数变化(均值±标准误差,n=3)Table 5 Changes of microbial community diversity indices in soils under different treatments in pot experiments(mean±SE,n=3)
土壤微生物门水平的相对丰度结果(图6)表明:优势菌门包括变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、酸杆菌门(Acidobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、疣微菌门(Verrucomicrobia)和硝化螺旋菌门(Nitrospirae),相对丰度占比83.74%~90.94%。在所有处理中,变形菌门占比最高,为41.57%~54.01%,其次为拟杆菌门和酸杆菌门。种植水稻后,变形菌门、酸杆菌门和疣微菌门丰度均增加。与CK 相比,添加菌株B9 的3 个处理变形菌门相对丰度均增加,增幅分别为1.49%、10.08%、0.92%。
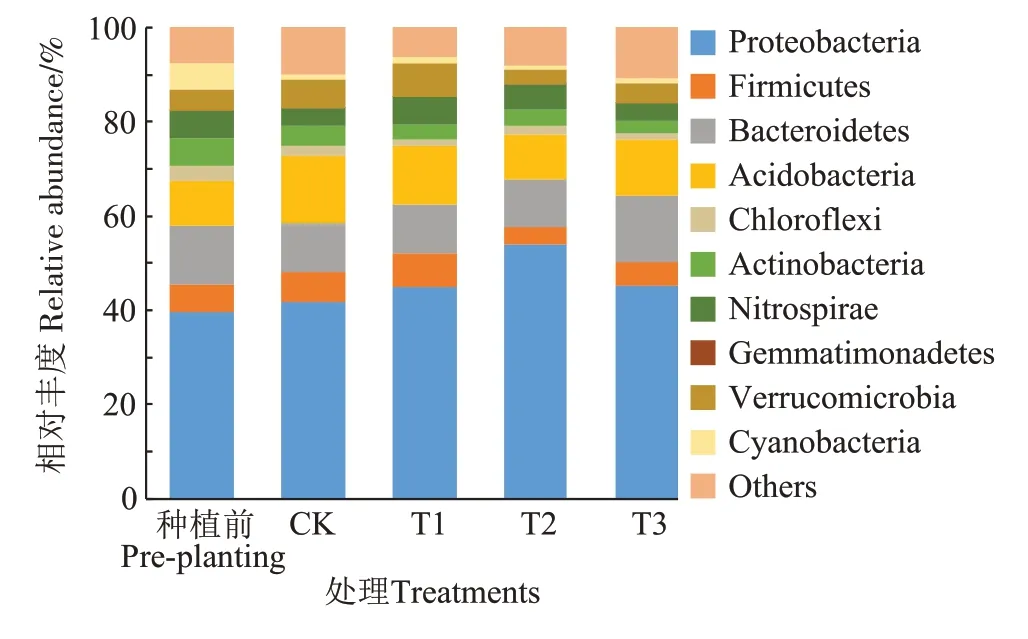
图6 不同处理对盆栽土壤微生物群落门水平相对丰度的影响Figure 6 Effects of different treatments on the soil microbial community structure at phylum relative abundance in pot experiments
2.5 土壤微生物群落结构与Cd形态的相关性
通过冗余分析(RDA)进一步揭示微生物群落结构的影响机制,结果见图7。两个坐标轴共解释了微生物群落和土壤理化因子、水稻各部位Cd 含量总方差的79.76%,其中横向坐标轴解释53.29%,纵向坐标轴解释26.47%。图中蓝色实线表示不同菌门,红色实线表示pH、有效态Cd、不同形态Cd 以及水稻各部位Cd 含量,箭头间的夹角代表正相关性(锐角)或负相关性(钝角)。菌株B9 所属的变形菌门(Proteobacteria)与土壤pH、可还原态Cd、残渣态Cd 含量呈正相关,与有效态Cd、弱酸可溶态Cd 含量呈负相关,与水稻根、茎、叶部Cd含量呈负相关。
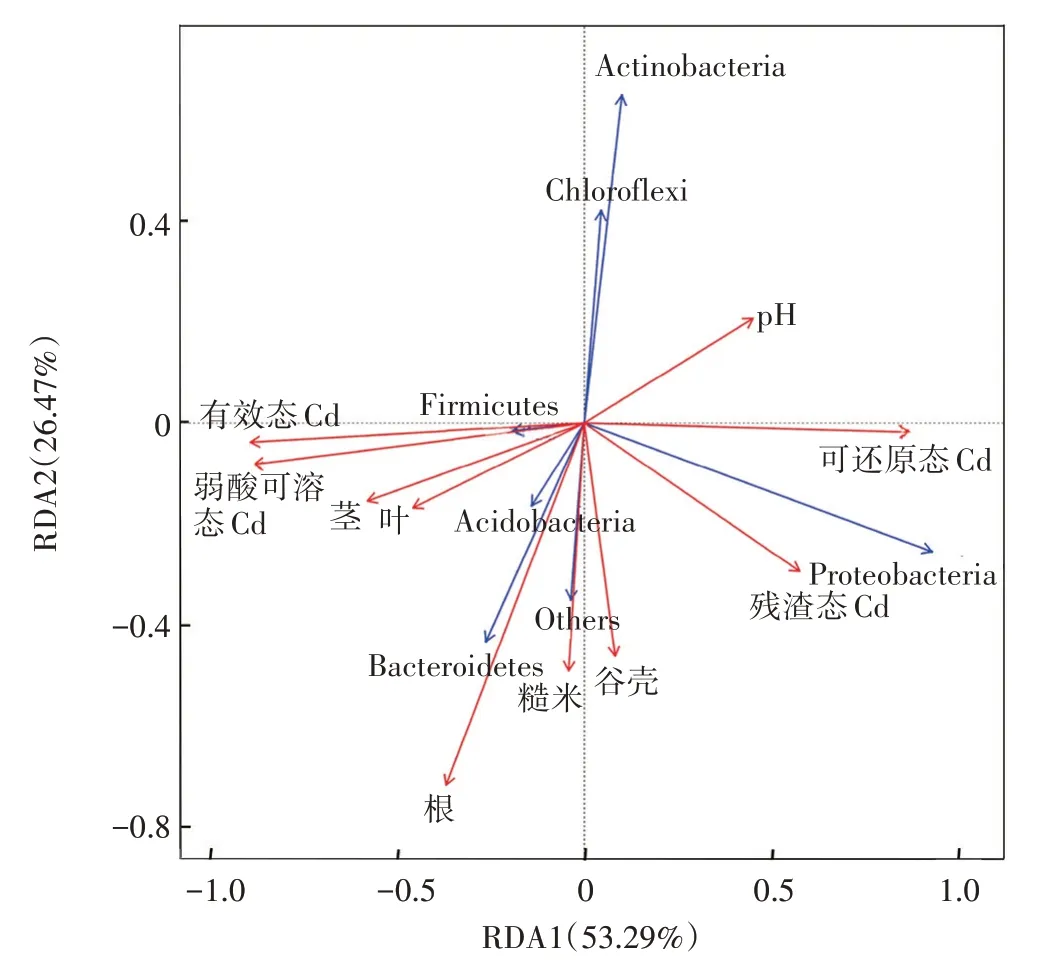
图7 盆栽试验土壤菌门与土壤、水稻Cd含量的冗余分析Figure 7 Redundancy analysis on soil bacteria phylum level and Cd content of soil and rice in pot experiments
通过聚类分析(图8)可知,10 个主要优势菌门中,Proteobacteria、Bacteroidetes、Nitrospirae、Gemmatimonadetes、Cyanobacteria、Chloroflexi、Acidobacteria 聚在一起,其中,Gemmatimonadetes 与水稻各部位Cd 含量均呈极显著(P<0.01)负相关,Proteobacteria 与土壤有效态Cd 和弱酸可溶态Cd 呈极显著(P<0.01)负相关。Verrucomicrobia、Firmicutes、Acidobacteria 与水稻各部位Cd 含量呈显著(P<0.05)或极显著(P<0.01)正相关;Verrucomicrobia 与土壤有效态Cd 和弱酸可溶态Cd呈极显著(P<0.01)正相关。
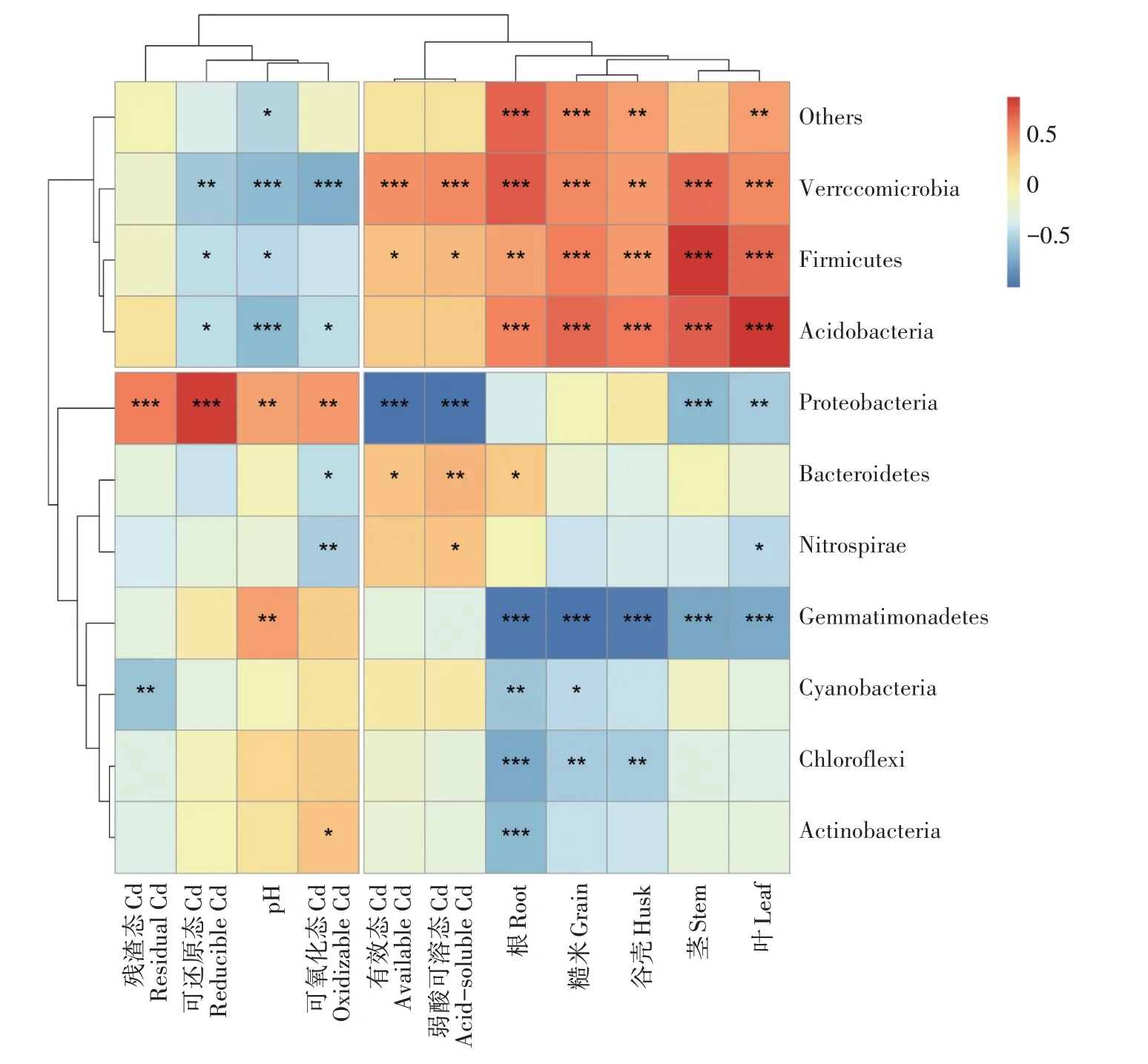
图8 盆栽试验土壤菌门与土壤、水稻Cd含量的聚类分析Figure 8 Cluster heatmap on soil bacteria phylum level and Cd content of soil and rice in pot experiments
3 讨论
3.1 添加菌株B9对土壤Cd有效态含量及赋存形态的影响
Cd 的有效态含量比总量更能反映其可被水稻吸收的特性[25]。Cd 的不同赋存形态能反映其环境行为和生态效应,Cd 在土壤中可分为弱酸可溶态(水溶态、可交换态、碳酸盐结合态)、可还原态(铁锰氧化物结合态)、可氧化态(有机结合态、硫化物)以及残渣态(硅酸盐、原生次生矿物)[26]。当土壤环境条件发生变化时,各形态之间就会发生转变,形成新的平衡。外源添加菌株B9 并种植水稻后,土壤Cd 形态由弱酸可溶态向可还原态、可氧化态及残渣态转化(图3)。菌株B9 属于革兰氏阴性细菌,其细胞壁结构主要包含磷脂、脂多糖、脂蛋白和肽聚糖。外源添加耐Cd菌株B9 后,细胞壁和胞外聚合物中带负电的官能团,如羧基(—COOH)、羟基(—OH)、羰基()等,与Cd 发生配位络合作用,形成离子键或共价键吸附Cd。同时,Cd 还能进入菌株B9 细胞内并被固定[22]。菌株B9对Cd的胞外吸附及胞内固定可使土壤中弱酸可溶态Cd 向有机结合态Cd 转化,使T2、T3 处理中可氧化态Cd 含量增加。添加菌株B9 还可通过改变土壤pH 改变Cd 的有效性。土壤pH 值是影响Cd 有效态含量的最主要因素之一[27],pH 与有效态Cd、弱酸可溶态Cd含量均呈极显著负相关(表4)。与对照相比,添加菌株B9的处理能显著提升土壤pH 值,这可能归因于菌株B9 自身可产生碱性物质。Li 等[28-29]、Wang 等[30]的研究表明,细菌可通过产生碱性物质提高土壤pH,释放Cd 结合位点,减少有效态Cd 含量。添加菌株B9使土壤pH 升高、Eh 降低,增强铁氧(氢氧)化物的溶解,释放出Fe3+并还原为Fe2+,提高与Cd 结合能力,从而增加铁锰氧化态Cd,即可还原态Cd含量[31-32]。
与早稻成熟期相比,晚稻分蘖期土壤pH 略有降低、有效态Cd 含量略有升高(图1、图2),这可能是由于早稻收获前后土壤处于落干状态,至晚稻种植前恢复淹水,土壤落干-淹水会导致土壤pH 变化,从而导致有效态Cd 含量的变化。另外,盆栽试验中水稻收获后,稻茬及根部仍留在盆栽中,这与田间收获水稻时实际操作一致。水稻对Cd 的累积量较高,尤其是在根部和茎部(图4),积累在水稻根部、茎部的Cd 可能会随着秸秆的腐解而释放,这可能会增加土壤有效态Cd含量[33]。
3.2 添加菌株B9对微生物群落的影响
土壤微生物群落是反映土壤稳定性和生态机制的重要指标,良好的微生物种群是适应外界因素和维持土壤肥力的必要因素[34]。水稻生长环境的干湿交替过程,不仅会影响微生物多样性,还会通过影响Cd的生物有效性来影响微生物的群落结构[35]。在本研究中,土壤中外源添加菌株B9并种植水稻后,微生物多样性及相对丰度均增加(表5),T2处理中变形菌门(Proteobacteria)丰度增加10.08%,菌株B9 属于变形菌门,因此,T2 处理的添加量是菌株B9 在土壤中发挥作用的合理用量。有研究表明,变形菌门能够较好地适应重金属胁迫并在维持土壤微生物生态过程中起到重要作用[34]。另外,变形菌门与土壤pH 呈显著正相关,与有效态Cd 含量呈极显著负相关(图7、图8),是农田Cd污染原位修复的潜在钝化材料[36]。
与T2 处理相比,T3 处理菌株B9 添加量更多,但土壤中有效态Cd含量、水稻各部位Cd含量均高于T2处理(图2、图4)。经过水稻种植后,T3处理土壤中变形菌门相对丰度(图6)以及微生物丰富度指数(Chao1、ACE,表5)明显低于T2 处理,猜测是由于菌株B9 具有较高的产铁载体的能力[22],过量添加菌株B9 产生的铁载体能更多地溶解释放矿物中的有害金属。铁载体不仅对Fe3+具有较高的螯合能力,还可通过多种官能团与重金属离子进行络合,增加土壤重金属的浓度[37-39],溶解的重金属会对微生物产生毒害作用。外源微生物的施入量会影响菌株功能的发挥和土壤群落的功能,因此需要进一步探究以使菌株在不影响土壤稳定性的前提下发挥作用。
4 结论
(1)菌株B9(Deftiasp.B9)不同添加量均可显著提高盆栽试验酸性中度Cd 污染土壤pH,显著降低土壤有效态Cd 含量。菌株B9 添加量为1.28 g·盆-1时,提升酸性土壤pH及降低土壤有效态Cd含量的效果最佳,显著促进弱酸可溶态Cd向可还原态、可氧化态及残渣态Cd转化。
(2)盆栽试验中,菌株B9 添加量为1.28 g·盆-1时,可显著降低盆栽试验水稻各部位Cd含量,糙米中Cd含量均低于0.20 mg·kg-1。
(3)菌株B9 添加量为12.50 g·m-2时,可显著降低酸性中度Cd 污染土壤(小区及大区试验)糙米Cd 含量。株洲小区试验中,早、晚稻糙米Cd含量与对照组相比分别显著减少28.38%、31.34%。浏阳大区试验中,中稻糙米中Cd 含量与对照组相比显著降低91.43%。

