CAR-T 治疗复发 难治性大B 细胞淋巴瘤失败后的临床分析*
喻敏 孔繁聪 周玉兰 齐凌 李菲
嵌合抗原受体-T(chimeric antigen receptor-T,CAR-T)细胞疗法将识别肿瘤相关抗原的单链抗体和免疫细胞的活化基序相结合,通过基因转导赋予T 细胞识别并杀伤表达靶抗原肿瘤细胞的能力[1]。目前,以CD19 为靶点的CAR-T 疗法在治疗复发难治性大B 细胞淋巴瘤(large B-cell lymphoma,LBCL)中取得了较好的临床效果,临床研究显示CAR-T 疗法客观缓解率(objective response rate,ORR)达80%,完全缓解(complete response,CR)率达40%~70%,但仍有60%患者在CD19 CAR-T 治疗后最终复发或进展[2-3]。CAR-T 治疗失败后的如何进行有效挽救治疗是临床面临的难点和挑战之一。目前,焦点主要集中在包含新靶点的二次CAR-T、新药靶向治疗及异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,allo-HSCT)方面,但能够指导管理的数据有限。本研究回顾性分析于本中心接受CD19 CART 细胞治疗后复发或进展的LBCL 患者的特征和结局,分析CAR-T 治疗后一线干预方案的缓解情况和总生存期,以指导CAR-T 细胞治疗后失败后患者的治疗选择。
1 材料与方法
1.1 临床资料
回顾性分析2018 年7 月至2022 年12 月于南昌大学第一附属医院接受CD19 CAR-T 细胞治疗、在成像和(或)活检方面有进展、且随访至少1 个月的复发/难治性16 例LBCL 患者的临床资料。所有患者均明确诊断复发/难治性LBCL,且肿瘤表面存在CD19 表达,诊断标准依据NCCN 指南非霍奇金淋巴瘤(2017.V5)标准;难治的定义为最近1 次系统治疗未取得过缓解[≥部分缓解(partial response,PR)]的患者,复发/进展性定义为最近1 次系统治疗出现新病灶,或者病灶出现≥50%的增加(基于LUGANO 2014评价标准[4]);大包块定义为肿物直径>7 cm。输注CAR-T 前采用FC 方案预处理,具体为氟达拉滨30 mg/m2×3 d,环磷酰胺 750 mg/m2×3 d,CAR-T 输注剂量3(2~6)×106/kg。
1.2 方法
患者生存情况来自电话随访、查阅门诊/住院病历,随访截止时间为2023 年6 月,无失访病例。总生存期(overall survival,OS)定义为从CAR-T 疗法输注当日至任何原因死亡或随访终止时间。疾病进展(progressive disease,PD)定义为临床或影像学复发的日期。参照2014 年LUGANO 会议修订的淋巴瘤评估标准进行疗效评估,主要反应标准有CR、PR、疾病稳定(stable disease,SD)和PD,疾病控制率(disease control rate,DCR)为CR+PR+SD。本研究通过本院医学伦理委员会批准(伦理批号:IIT[2018]医研伦审第027 号)且所有患者签署知情同意书。
1.3 统计学分析
采用 SPSS 25.0 软件进行统计学分析。应用Kaplan-Meier 绘制生存曲线,采用Log-rank 法进行单因素分析。以P<0.05 为差异具有统计学意义。
2 结果
2.1 病例临床特点
16 例患者符合入组要求,其临床特征见表1。其中男性10 例、女性6 例,中位年龄53.5(16.0~72.0)岁。根据细胞起源,生发中心(germinal center B-cell,GCB)型5 例,非生发中心(non-germinal center B-celllike,non-GCB)型9 例,2 例未知;3 例为转化型LBCL,11 例为原发型LBCL,2 例未知;Ann Arbor Ⅲ~Ⅳ期患者11 例;11 例患者国际预后(IPI)评分为中高危组;7 例患者对免疫化疗不敏感,为原发性难治患者。初诊至CAR-T 治疗中位总生存期(median overall survival,mOS)为13.5(4.0~36.0)个月,既往中位化疗疗程数为2(1~5)线。在上述患者中,对CAR-T 疗法的最佳疗效,2 例(12.5%)为CR,3 例(18.8%)为PR,5例(31.2%)SD,6 例(37.5%)PD。CAR-T 治疗失败后,4 例(25.0%)患者姑息或放弃治疗,12 例(75.0%)患者进行了后续系统性抗肿瘤治疗,时间间隔范围为1.2~15.0 个月。

表1 16 例CAR-T 细胞治疗后出现疾病复发或进展的复发/难治性LBCL 患者临床特征及后续治疗
2.2 后续治疗及疗效评估情况
CAR-T 治疗失败后接受后续抗肿瘤治疗的12 例患者中,4 例(33.3%)采用Pola-BR 方案:利妥昔单抗375 mg/m2×1 d ;维泊妥珠单抗1.8 mg/kg×1 d ;苯达莫司汀 90 mg/m2×2 d,4 例(33.3%)使用含BTK 抑制剂(泽布替尼 160 mg×1 天2 次×28 d )的治疗,2 例(16.7%)使用抗PD-1 抗体(替雷利珠单抗 200 mg×1 d),2 例(16.7%)进行传统免疫化疗。最佳疗效为PR 4 例(33.3%),SD 2 例(16.7%),PD 6 例(50%)。BTK 抑制剂治疗组有2 例(50.0%)患者PR,Pola-BR组(25%)和免疫化疗组(50%)各有1 例PR,抗PD-1抗体组无患者获得PR 及以上疗效;BTK 抑制剂治疗组有3 例(75%)患者得到疾病控制,Pola-BR 组和免疫化疗组DCR 分别为50% 和50%(表2)。BTK 抑制剂组的反应率较其他方案似有获益趋势,差异无统计学意义(P>0.05)。
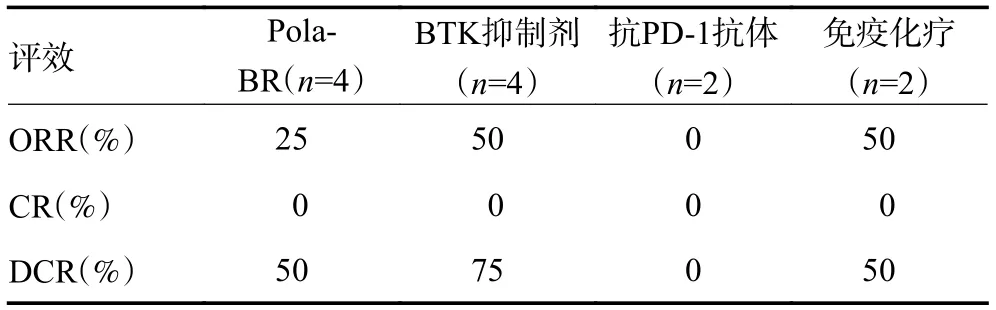
表2 CAR-T 治疗失败后后续治疗的缓解情况
2.3 随访
患者随访时间为1.5~16.8 个月,平均14.2 个月,14 例患者死亡,仍生存的2 例患者中1 例接受BTK抑制剂治疗、1 例接受Pola-BR 方案后达PR,正在进行allo-HSCT 巩固疗效。CAR-T 治疗后复发或进展的患者预后极差,mOS 仅为5.7 个月(95%CI:5.1~6.3)。9 例(56%)为早期失败(第0~90 d),7 例(44%)为晚期失败(>90 d),早期失败患者的mOS 为4.3 个月(96%CI:2.8~5.7),晚期失败患者mOS 为10.9(5.9~15.8)个月,差异具有统计学意义(P=0.01)。12例患者接受后续抗肿瘤治疗,mOS 为9.8 个月(95%CI:3.3~16.3),4 例患者接受支持治疗或放弃治疗,mOS 为2.1 个月(95%CI:0~4.8),两者比较差异具有统计学意义(P<0.005)。在接受治疗的患者中,以BTK 抑制剂为基础的治疗方案有生存获益趋势,mOS 为10.8 个月(95%CI:3.4~18.1),差异无统计学意义(P=0.33)。
3 讨论
尽管CAR-T 细胞治疗可使近80%复发/难治性LBCL 患者在短期内获益,但获益患者中近50%患者在1 年内再次复发或进展。CAR-T 细胞治疗后复发或进展的患者,预后不佳,目前暂无标准的挽救治疗策略[5-6]。本研究对本中心16 例接受CD19 CAR-T细胞输注后出现疾病复发/难治性患者的进行了临床分析,其预后差,mOS 仅为5.7 个月,早期进展的患者尤其明显,该结果跟国外CAR-T 治疗失败后的临床数据基本一致[7-8]。16 例患者中4 例接受支持性治疗,12 例接受了后续抗癌治疗,治疗方案包括Pola-BR、BTK 抑制剂、免疫化疗和免疫检查点抑制剂,但整体疗效欠佳,对后续治疗有应答的患者不足35%。即使如此,后续积极进行抗肿瘤治疗仍可带来一定的生存获益,其mOS 为9.8 个月(95%CI:3.3~16.3),支持或姑息治疗的患者mOS 为2.1 个月(95%CI:0~4.8)。在上述患者中,暂无最优的挽救治疗方案,但基于BTK 抑制剂的治疗方案不论整体反应率还是总体OS 较其他方案均有改善趋势,本研究中2 例患者观察到对BTK 抑制剂的持久反应,截至随访时间仍有1 例为无进展生存。BTK 抑制剂作为对CAR-T 细胞治疗无效的挽救性治疗策略,值得在大量人群中进一步研究,其疗效与疾病分子病理特征的关系及如何影响CAR-T 细胞持续性和功能的研究是有意义的。
Pola 是一种针对CD79b 靶点的首创抗体偶联药物(antibody-drug conjugate,ADC)。与BR 相比,Pola-BR 方案显著改善了复发/难治性LBCL 患者的最佳CR 率、无进展生存率(progression-free survival,PFS)和OS 近3 倍,不良反应可控[9]。本中心Pola CUP 项目使用Pola-BR 方案治疗11 例复发/难治性LBCL患者,ORR 达81.8%[10]。上述研究均未纳入CAR-T治疗失败患者,真实世界回顾性研究发现,对于CART 失败后进展的患者,有40%~70%可从Pola-BR 挽救中获得缓解,CR 率为20%~40%[11-12]。本研究4 例患者CAR-T 治疗失败后接受Pola-BR 方案治疗,ORR 为25%,一方面由于样本量小,另一方面可能跟患者存在原发耐药、大包块等多个难治因素有关。
Lonca 是一种靶向CD19 的ADC 药物,LOTIS-2关键性Ⅱ期临床试验中入组了13 例既往接受过CD19 CAR-T 治疗的患者,CAR-T 治疗至接受Lonca的中位间隔时间为7 个月,ORR 达到 46.2%,CR 为15.4%,mOS 为8.2 个月[13]。CAR-T 治疗进展患者的反应率与入组的整体人群无明显差异,提示Lonca 针对这部分患者仍具备一定的治疗潜力,应用前景可期。双特异抗体虽然同样是通过T 细胞发挥作用,但在CAR-T 治疗失败后,双特异抗体同样具有治疗效果,如mosunetuzumab 和odronextamab(两者均为CD20/CD3 双抗)。在临床研究中,这两个双特异抗体在治疗CAR-T 失败的患者中分别具有22%(n=18)和27%(n=30)的CR 率[14],而同样为CD20/CD3 双抗的glofitamab 在Ⅰ期临床试验具有更好的效果,其在CAR-T 治疗失败的患者中具有44% 的CR 率,Ⅱ期临床试验更多样本中具有35%的CR 率[15-16]。Tafasitamab(Tafa)是一种针对CD19 的Fc 工程化IgG1抗体,通常与来那度胺(lenalidomide,Len)联合使用用于治疗复发/难治性LBCL,对比CAR-T 治疗,Tafa+Len 方案具有相似的OS 获益,但具有更长的缓解持续时间[17]。Selinexor 是一种选择性核输出蛋白抑制剂,单药治疗使部分患者获益,总体ORR 为28%,CR率为12%,中位随访时间为11.1 个月,mOS 为9.1 个月[18]。在CAR-T 失败后患者中,Tafa+Len、Selinexor 尚无数据公布。尽管上述药物大多已获批上市,但由于国内药物可及性较低的现状,本研究无患者使用上述药物作为挽救性治疗。
免疫抑制分子在肿瘤微环境表达,前期研究数据显示程序性死亡受体-1(programmed death receptor-1,PD-1)/细胞程序性死亡-配体1(programmed cell deathligand 1,PD-L1)表达可以抑制CAR-T 细胞活化,从而导致免疫逃逸[19]。研究人员一直尝试探索CAR-T细胞联合PD-1/PD-L1 阻断疗法的潜在疗效。在CD19 CAR-T 细胞治疗后疾病复发的患者中,小样本患者群观察到PD-1 抗体治疗“重新启动”CAR-T 细胞,促进CAR-T 细胞扩增及PD 患者肿瘤缩小[8,20]。但一项大型回顾性队列研究揭示,CAR-T 细胞治疗后复发而接受免疫检查点抑制剂治疗的患者总体OS 率和反应率非常差,mOS 仅为5.2 个月[21]。本研究中2 例患者CAR-T 治疗失败后使用抗PD-1 抗体,最佳疗效仅为SD,疾病均在短期内迅速进展,提示免疫检查点抑制剂挽救性治疗疗效十分有限。即使CD19 CAR-T细胞和PD-1 阻断早期联合使用,其持久的应答率并不优于单独使用CAR-T 细胞治疗[22]。个体化的析因分析对于提高CAR-T 治疗的抗肿瘤效果至关重要,对于肿瘤微环境中免疫细胞丰富、免疫检查点高表达的患者,更有可能从免疫检查点药物中获益。
靶抗原的丢失是研究最广泛的CAR-T 治疗抵抗机制,靶向CD22 的CAR-T 给CD19 CAR-T 复发的患者带来新的希望,来自美国的研究者探索了靶向CD22 的CAR-T 细胞疗法在接受CD19 CAR-T 治疗后复发的LBCL 成人患者中的疗效和安全性,其ORR和CR 率分别为68%(n=26)和53%(n=20),CD22 CAR-T 是CD19 CAR-T 治疗后复发的LBCL 患者的一种高效、安全的挽救治疗,为患者提供了新的治愈机会[23]。本团队系统评价了双靶点CAR-T 细胞治疗B 细胞淋巴瘤的安全性和有效性,发现双靶点CART 疗法的CR 率有进一步增加趋势,缓解持续时间更长,总体发生抗原调变的概率更低,对于既往CD19 CAR-T 治疗失败的患者也有显著疗效[24]。此外,PD-1/CD28 转换受体等新型CAR-T 在既往CAR-T 治疗失败的患者中也显示了可控的不良反应和较好的早期疗效[25]。相对于其他治疗,更换靶点的二次CAR-T 可作为传统CAR-T 细胞治疗失败后的优先挽救选择[26]。
Allo-HSCT 作为复发难治恶性淋巴瘤的挽救性治疗可以显著改善预后,CAR-T 既往研究3 年PFS率为36%~38%[27]。目前,关于CAR-T 细胞治疗后行allo-HSCT 疗效和不良反应的数据有限,大多为单中心小样本的结果。一项多中心回顾性分析纳入了88 例CD19 CAR-T 治疗失败后接受allo-HSCT 的患者,mOS 和PFS 为21 个月(95%CI:12~NR)和10个月(95%CI:5.1~17.0),且接受allo-HSCT 时处于缓解状态的患者预后更佳[28]。根据该研究结果,CAR-T治疗失败后达缓解并符合移植条件的患者可考虑接受allo-HSCT,未来需要长期随访来证实行allo-HSCT 的持久缓解率和治愈潜力。
CAR-T 细胞治疗后复发或进展的淋巴瘤患者预后差,已知的CAR-T 细胞治疗失败原因与患者临床和生物学特征、CAR-T 产品因素和肿瘤免疫逃逸机制有关。肿瘤细胞对CAR-T 的抵抗机制有助于精准预测CAR-T 疗效并探索提高CAR-T 细胞疗效的方法。目前,大部分策略大多数都处于临床前研究阶段,仍需要应用于更多的患者并进行评价,如何合理化分层使用后线治疗策略是未来值得进一步探索的问题。
本文无影响其科学性与可信度的经济利益冲突。

