腹腔镜辅助下切除消化道同时性双原发癌11 例*
冀富强 王举
据2020 年全球癌症数据统计[1],消化道肿瘤为最常见的恶性肿瘤之一,其发病率及死亡率均位居前列。在人口老龄化及社会医疗普及的背景下,消化道恶性肿瘤的诊出率逐渐增高,肿瘤患者的生存期也明显延长,使得消化道多原发癌的发病率也逐渐升高[2]。多原发恶性肿瘤(multiple primary malignant tumors,MPMT)的定义[3]:同一患者在同时或相继诊断有两个及以上不同病理类型的肿瘤,不包括既往癌症的复发或转移,其中,双原发癌是最常见的多原发恶性肿瘤类型。如果在诊断出第一种肿瘤后6 个月诊断出第二种肿瘤,则称为异时性双原发癌;如果在首次诊断后6 个月内诊断第二种肿瘤,称为同时性双原发癌。同时性双原发癌的发病率明显低于异时性双原发癌[4],而消化道多原发癌更是少见。MPMT 的治疗目前尚缺乏统一共识[5],当患者同时诊断出两种活动性恶性肿瘤时,探寻一种抗癌治疗策略是临床面临的最大挑战。目前,随着腹腔镜技术的不断发展和应用经验的积累,对于单纯消化道的切除和重建已经变得越来越成熟。然而,对于腹腔镜辅助切除消化道双原发癌的报道极少且多为个案报道。本研究回顾性分析内蒙古自治区人民医院收治的消化道双原发癌行腹腔镜切除的11 例患者病例资料,旨在为临床提供参考。
1 材料与方法
1.1 病例资料
回顾性分析2019 年1 月至2023 年4 月于内蒙古自治区人民医院诊断为原发性消化道恶性肿瘤的1247 患者病例资料,对其中11 例多原发恶性肿瘤的患者进行病例分析。根据MPMT 的判断标准制定纳入及排除标准[6]。纳入标准:1)每个原发性肿瘤在组织学上证明是恶性的;2)每个原发肿瘤具有不同的组织学类型;3)须确认一个肿瘤不是另一个肿瘤的转移性病变或复发;4)至少有2 个不同肿瘤位于消化道,相隔至少2 cm 以上的正常黏膜。排除标准:1)未经病理证实为原发癌或无法排除转移;2)家族性腺瘤性息肉病引起的多原发癌:3)合并严重全身慢性病不适合手术者。11 例同时性双原发癌患者中,男性10 例、女性1 例,平均年龄为63.4(44~81)岁。11 例患者因不同症状就诊,其中6 例以便血为主要症状,2 例出现乏力及消瘦,2 例出现排便习惯改变,还有1 例出现肠梗阻表现。6 例患者术前无基础疾病病史,其余5 例患者分别有不同程度的高血压、糖尿病、冠心病及腹部手术史等。所有患者术前根据胃镜、肠镜、腹盆腔增强CT 明确各原发癌的诊断,其中胃-结肠双原发癌2 例,胃-直肠1 例,结肠-结肠2 例,结肠-直肠5 例,小肠-结肠1 例。11 例患者的临床资料见表1。
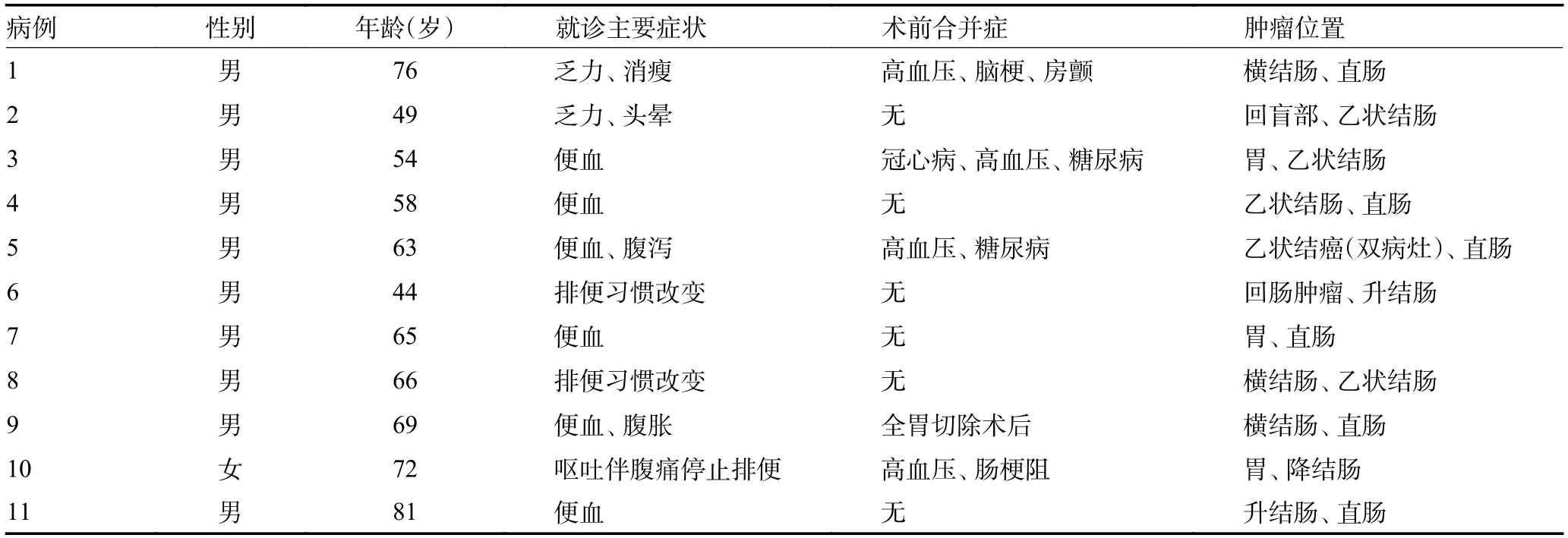
表1 11 例患者临床资料
1.2 方法
患者在术前完善相关检查确诊消化道同时性双原发癌后,明确手术的先后顺序。对具有明显便血及有不全梗阻的患者,评估患者影像学资料后,对患者进行术前TNM 分期,术中先对引起患者主要就诊症状的病灶行手术切除,然后再对第二原发癌行同期切除。对于无明显症状且术前分期早的患者采取消化道由上至下的顺序操作。术中先将第一原发癌切除后置于标本袋中,保留可用戳卡,再重新穿刺新戳卡孔,完成第二原发癌的切除。入组患者均由同一组医生团队行腹腔镜辅助下肿瘤根治术,根据术中探查肿瘤的位置及侵犯的具体情况改变术式。以患者(3)胃-乙状结肠双原发癌为例,摆好“人”字位,考虑上身身长后,在全麻下先在脐上2 cm 处打观察孔,置入气腹针及观察戳卡,设定气腹压力13 mmHg。腹腔镜探查腹腔,在腹腔镜直视下分别在左腋前线肋下1 cm、左锁中线平脐处、右腋前线肋下1 cm、右锁中线平脐处置入共4 个戳卡,操作孔的选择需合理的兼顾多个病灶。体位及戳卡布局见图1。手术切除采取腹腔镜下远端胃根治性切除+D2 淋巴结清扫,整体布局见图1A。将远端胃、十二指肠第一段、大网膜、横结肠系膜前叶、胰腺背膜、胃周淋巴结整块置入标本袋,操作过程始终遵循无菌无瘤原则。采用直线切割闭合器Echelon 60A完成胃十二指肠消化道重建(三角吻合),Covidien Vlocl 3-0 倒刺线加固缝合吻合口。外科医生及腹腔镜显示器改变位置,保留可用的原戳卡孔,在腹腔镜直视下于两侧脐下3 cm 腹直肌外缘处置入新戳卡孔,整体布局见图1B。遵循TME 原则,采用“隧道式”游离,充分游离直肠至肿瘤远端5 cm。向上以肠系膜下动脉为导向,充分游离至结肠系膜,保留左结肠血管,并清扫淋巴结,切除途中保护生殖血管及输尿管,距离肿瘤近端10 cm 处结扎血管弓。取脐下正中切口置入切口保护套,取出胃标本,在提取乙状结肠,预定切除部位离断肿瘤,采用圆吻的方式完成消化道的重建。整体戳卡布局见图1C 中a:腹腔镜观察孔;b:胃癌手术主操作孔;c、d、e、g:辅助操作孔;f:乙状结肠癌手术主操作孔;d:胃十二指肠吻合口引流管;g 盆腔引流管。
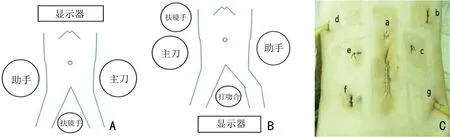
图1 胃癌站位、乙状结肠癌站位及整体戳卡布局
术后的观察指标主要为手术时间,术中出血量,术后住院天数,术后病理分期,住院治疗费用,术后30 d内的并发症。出院后通过随访观察短期有无复发及转移。
1.3 统计学分析
采用SPSS 26.0 软件对数据进行分析。正态分布的计量资料采用表示,采用配对t检验;偏态分布的计量资料采取中位数表示,采用符号秩和检验。以P<0.05 为差异具有统计学意义。
2 结果
11 例患者中胃癌合并结、直肠癌3 例,结肠癌合并直肠癌5 例,结肠癌合并结肠癌2 例,小肠癌合并结肠癌1 例。共有10 例患者进行了同期双原发癌切除的腹腔镜治疗,无中转开腹,1 例患者由于局部分期较晚,先行胃癌根治术,术后化疗5 个月后再次行直肠癌根治术。有1 例患者在术后第2 天肛门内有大量鲜血流出,并出现心律加快,血压减低的表现,急诊给予内镜下见吻合口出血,给予结扎止血,患者术后第6 天平稳出院。所有患者的手术时间为(317±141)min,术中出血量(70±39)mL,术后住院时间(10.7±3.9)d,住院治疗费用61 291(39 767~117 196)元。11 例患者术后随访3~42 个月,根据患者术后病理分期提示所有患者均需术后化疗,目前有5 例患者接受化疗,1例患者在术后6 个月发现肿瘤局部复发,其余患者无明显转移性病灶(表2)。

表2 11 例患者诊疗情况
3 讨论
3.1 多原发癌的流行病学及发病因素
1889 年,奥地利医生Christian Billroth 首次描述了多发性原发性恶性肿瘤。美国国家癌症研究所数据统计美国MPMT 的诊断率为0.52%~3.66%,其他国家MPMT 的诊断率为0.73%~11.70%[7]。为此,通过对本研究中原发性消化道肿瘤的患者共计1 247 例住院患者进行单中心数据统计发现,同时性双原发癌的患者共计11 例,占比0.88%,与美国国家癌症研究所数据相接近。研究显示,双原发癌是MPMT 中最常见的类型,妇科肿瘤、乳腺癌和头颈癌是最常见的首发原发性恶性肿瘤,肺癌、乳腺癌、胃癌和结直肠癌是随后最常见的第二种原发性恶性肿瘤[8]。在双原发癌中,消化道的双原发病灶需引起医师重视。日本的一项研究表明,在1 111 例结直肠癌患者中,117 例(10.5%)发现了结肠外部位的多原发恶性肿瘤,其中胃癌的发病率为44.4%(52/117),是研究中最常见的多原发恶性肿瘤的合并类型[9]。黎琪等[10]亦发表过相同的观点,认为胃是结直肠外肿瘤的高发部位。国内一项单中心研究对15 321 例恶性肿瘤患者进行分析[11],MPMT 的患病率为1.09%,同时性消化道多原发癌较为罕见。目前多原发癌的病因尚不明确,但主要与遗传、基因突变、生活方式和环境影响有关[12]。吸烟和饮酒是导致多种癌症发生的常见危险因素,治疗相关的医用射线造成基因突变及染色体缺失同样是致癌风险的相关因素[13]。Wang 等[14]通过对病变的多原发结直肠手术肿瘤样本进行了全外显子组测序,发现APC、KRAS、TP53 和PIK3CA 经常发生突变。Zhao 等[15]对239 例多原发性结直肠癌患者的队列研究发现,患者中的缺陷错配修复/高度微卫星不稳定性频率明显高于单原发性结直肠癌。日本一项研究表明,微卫星的不稳定性和TP53 的易位、老化以及幽门螺旋杆菌感染是胃癌合并结直肠癌的双原发癌的危险因素[9]。本研究中患者均未行完整的基因检测,关于消化道多原发癌的发病因素仍需要进一步的研究。
3.2 多原发癌的诊断及治疗策略
消化道的多原发癌早期往往无特异表现,疾病进展后会出现腹胀、恶心呕吐、排便习惯改变及体质量减轻等相关症状。医生需仔细询问病史,避免只注意主要症状而忽略次要症状,造成漏诊误诊,耽误患者的最佳治疗时机。内镜下的病理活检是消化道肿瘤诊断的金标准。增强CT 及MRI 是辅助诊断的消化道肿瘤的必备手段,还可以观察是否有明显的淋巴结转移等[16]。对于难以判断的病灶应行PET-CT 或者有创检查,明确患者的诊断。多原发癌的治疗目前尚缺乏统一共识,当患者同时诊断出两种活动性恶性肿瘤时,找到一种抗癌治疗策略是临床面临的最大挑战。Fang等[17]认为手术干预是治疗消化道多原发癌的首选方式,但与单一癌症的手术切除相比,同时手术切除显示出更多的困难和更高的手术风险,其手术结果术中出血量为(56.7±25.2)mL、术后住院时间(12.3±2.1)d,与本研究结果相似。邱敏等[6]发现部分患者可以采取中西医结合的治疗方法,手术切除后辅助中药治疗。何玥等[18]对23 例患者分析发现,针对多原发癌的治疗与单发癌相同,但需考虑不同肿瘤的特点。手术是主要的治疗方式,而放化疗则起着重要的辅助作用。
本研究中有2 例胃癌患者是以消化道症状为首要表现而就诊,在增强CT 的影像学下并未见到胃壁明显强化的提示。但在住院期间通过询问病史,发现具有上腹部不适的伴随症状,考虑到有双原发癌病灶的可能性,再行胃镜检查发现均为T1 期胃癌。1 例患者在术中见直肠癌病灶与周围组织有侵犯并且黏连致密,仅先完成了胃癌根治,化疗5 个月后再次行腹腔镜直肠癌手术。因此,在临床工作中应该意识到MPMT 的存在性,早诊断早治疗,对消化道肿瘤患者进行全面的胃镜及肠镜检查。对患者应采取个体化治疗方案,不可轻易因发生远处转移使患者而失去手术机会。
3.3 同时性多原发癌手术的可行性和安全性
研究报道,同时性多原发癌的中位总生存期为32 个月,95%CI 为0~109 个月,而异时性多原发癌为284 个月,95%CI 为209~359 个月;同时性多原发癌组的1、2 和10 年生存率分别为0.70、0.59 和0.24[19]。既往研究显示,2 例结直肠多原发癌患者实施腹腔镜下肿瘤根治术+末端回肠造瘘术,结果患者均在术后3 d 出院,30 d 内未出现并发症,均完成回瘘手术[20]。Li[21]对28 例同步切除结直肠癌的患者进行分析,结果表明所有患者在术后30 d 内未发现重大并发症,仅部分患者出现了轻度肠梗阻的症状,经过保守治疗后均出院。本研究中,有1 例患者在第2 天发现术后吻合口出血,通过内镜下进行止血,在术后6 天成功出院,所有患者无吻合口瘘、吻合口狭窄、切口感染、切口疝等相关并发症的发生。目前关于手术对消化道多原发癌的治疗均为小样本量报道[17-18,20-22],结合对患者实施的治疗,通过运用腹腔镜给予双癌切除似乎是可行的,并且对患者的二次打击减小。相比较单原发肿瘤的切除[23],多原发癌肿瘤的切除在手术时间有所增加,而在手术出血量与术后住院时间上无显著性差异。本研究认为对于消化道多原发癌的预后主要与恶性程度最高的肿瘤相关,与肿瘤的数量无关。肿瘤数量增多意味着手术风险增加,手术难度加大,切除范围广泛。只要在早期可以发现病灶,采取规范的切除标准,即使是患有多个肿瘤,同样可以获得较好的治疗效果。
综上所述,在临床工作中,应对消化道多原发肿瘤提高诊断意识,对胃癌及结直肠癌患者行充分检查,避免漏诊。对同期双原发癌的患者进行术前多学科联合讨论,制定个体化的治疗方案。在患者无明显手术禁忌证的前提下,尽量对病灶进行腹腔镜下的同期的切除,避免患者遭受二次手术打击,同时还可以降低治疗费用及术后住院时间,为患者的后续治疗争取时间。腹腔镜下的消化道双原发癌根治术是可行、安全的,但需要经验足够丰富的外科医生实施手术。本研究患者数量较少,且为回顾性研究,存在偏倚,未来将继续随访并扩大患者数量,提供长期生存和肿瘤复发相关数据。
本文无影响其科学性与可信度的经济利益冲突。

