Eu3+掺杂诱导CsAgCl2相变及其光学温度传感性质
赵梦真,李 超*,张 凤,万柄亿,李 冰,刘 洁,王飞久,2
(1.河南大学 未来技术学院,光伏材料省重点实验室,河南 开封 475001;2.河南大学 拓扑功能材料研究中心,河南 开封 475001)
1 引言
近年来,金属卤化物因其优异的光电性能而受到越来越多的关注。其中,铅卤钙钛矿材料因其优异的光物理性能而在多种金属卤化物中脱颖而出,但是铅具有的毒性和铅卤钙钛矿材料在潮湿环境中的不稳定性是该领域亟待解决的重要问题[1-5]。因此,人们致力于开发具有更高稳定性的环保型无铅金属卤化物[6]。
ⅠA 族和ⅠB 族卤化物形成的金属卤化物材料具有优异的光电性能,它们分子之间形成的低维结构增强了电子-声子之间的相互作用,将激子更局域化[7-8]。为了寻找铅基金属卤化物的替换材料,ⅠB 族的一价银离子被引入来代替二价铅离子,形成新型的低维金属卤化物。将ⅠB 族过渡金属中较大离子半径的Ag+引入到卤化铯中,有助于容纳所有卤化离子,并且还能够调整发射波长从紫外光区到可见光区以及近红外光区(390~820 nm)[9]。
除了光学性质外,金属卤化物晶体的物相转变也是近年来研究的热门方向。晶体物相转变是一种有趣的现象,在开关和传感器等分子器件中具有潜在的应用价值[10]。物相转变通常包括由金属配位数变化、缩合反应、化学键重排、溶剂的去除或交换引起的晶体中原子的微小运动。它们通常伴随着磁性、导电性、发光等性质的变化[10-13]。物相转变是调节金属卤化物材料性能的一种有效方法,在介电、光电和光致发光等领域得到了广泛的应用[14-17]。有许多因素可以引起相变,如杂质掺杂剂的引入、压力、无序、缺陷和温度[15,18-22]。但在同一种物质中通过不同途径实现物相转变的研究报道较少。
目前,银基纯无机金属卤化物CsAgCl2因其独特的光电性能、稳定性和环保性能而备受关注。1983 年,Hoppe 等首次报道了正交相CsAgCl2[23]。Hull 等通过固相反应制备了CsAgCl2,并研究了该物质正交相和四方相之间的物相转变[24]。2020年,Zhang 等利用球磨法制备了正交相的CsAgCl2,其光致发光量子效率(PLQY)高达68%,在空气和水中都具有较好的稳定性[9]。2021 年,Wu 等通过反溶剂法合成正交相的CsAgCl2,并研究了其PL性能和光催化CO2还原性能[25]。2022 年,Wang 等通过溶解蒸发法制备正交相CsAgCl2,并研究了其超宽带暖白光发射和LED 应用[26]。对于CsAgCl2,它已被多种方法合成,其光学和光电性质也已得到研究,但关于它的的水热合成仍未见报道。稀土离子作为一种常见的激活剂离子,可以有效地扩展金属卤化物的发光波长范围以及颜色调控,但在CsAgCl2体系关于Eu3+掺杂的报道较少。一些光学材料可以通过它们的发射光谱位置、荧光强度变化、荧光光谱半高宽和荧光寿命等随温度的变化而变化来探测温度;但目前关于CsAgCl2的光学温度传感应用也未见报道。
水热合成法有助于制备多相材料的亚稳相和中间相,且有助于研究相变[27-29]。本文采用水热法制备了未知相CsAgCl2。并通过升温以及Eu3+掺杂实现了CsAgCl2从未知相到正交相的物相转变,并且研究了Eu3+掺杂的CsAgCl2的光学温度传感特性,实现了高灵敏度的温度检测。本工作为研制超高灵敏度光学温度探测器开辟了一条有效途径。
2 实 验
2.1 原料与试剂
氯化银(AgCl)和氯化铯(CsCl)均购买于上海麦克林生化科技有限公司,纯度均为99.5%;分析纯浓盐酸(HCl)购买于洛阳昊华化学试剂有限公司;氧化铕(Eu2O3)购买于上海阿拉丁生化科技股份有限公司,纯度为99.9%。
2.2 样品制备
2.2.1 未知相CsAgCl2制备
将CsCl(1.2 mmol)和AgCl(1.2 mmol)按照量比1∶1 放入50 mL 的聚四氟乙烯内胆中,然后加入1 mL 浓度为12 mol/L 的浓盐酸。将装有药品的内胆放入反应釜中。将反应釜放入烘箱中,加热至455 K,保温15 h,再缓慢降温至室温。将样品取出后烘干得到浅白色样品,再进行研磨,用于测试。
2.2.2 正交相CsAgCl2制备
2.2.2.1 升温诱导正交相CsAgCl2
将2.2.1 中制备的未知相CsAgCl2取出、烘干,然后在干燥箱中加热至555 K,保温3 h,再缓慢降温至室温。将样品取出后烘干得到浅白色样品,再进行研磨,用于测试。
2.2.2.2 Eu3+掺杂诱导正交相CsAgCl2
Eu3+掺杂CsAgCl2的制备与合成未知相CsAg-Cl2的操作过程相同。不同之处在于原料中增加了0.036 mmol Eu2O3。

图1 CsAgCl2合成示意图Fig.1 Synthesis schematic diagram of CsAgCl2
2.3 测试与表征
本文使用X 射线粉末衍射(XRD)(D8 Advance,Bruker AXS,德国)和Cu-Kα 辐射(λ=0.154 145 nm)分析样品的物相纯度。通过扫描电子显微镜(SEM,JSM 7001F 仪器(JEOL,日本)采集样品的SEM 图像。通过扫描电子显微镜(SEM)对样品形貌进行测试;使用SEM 配套的能量色散X 射线光谱仪(EDX)分析了样品的元素组成。通过NETZSCH DSC 200 F3 对样品进行差示扫描量热测试,测试气氛是氮气,升温速率为2 K·min-1。在型号为ZRPY-1000 的热膨胀测试仪上测量线性热膨胀系数,测试之前将样品压缩为直径10 mm、长度5 mm 的圆柱体。通过FLS 1000(爱丁堡,英国)荧光光谱仪研究了样品的荧光光谱以及荧光衰减曲线。荧光光谱测试采用的灯源是450 W Xe900 氙气灯;荧光衰减曲线测试采用的灯源是100 W·µF2微秒闪光灯。通过与荧光仪配套的TAP-02 高温荧光控制器(天津东方科捷科技有限公司)采集了与温度相关的荧光光谱和衰减曲线。
3 结果与讨论
3.1 未知相CsAgCl2的制备
本文采用水热法合成CsAgCl2。当CsCl 和AgCl 的量比为1∶1 时,得到的样品呈浅白色。利用XRD 对制备的样品进行了物相分析。结果显示样品的所有衍射峰与未知相CsAgCl2(PDF#28-337)有很好的匹配(图2(a))。采用SEM 对该样品形貌进行测试,样品为不规则形貌(图2(b))。元素Mapping 测试结果表明,制备的样品中含有Cs、Ag 和Cl 元素,它们均匀地分布在样品颗粒中。元素比例Cs∶Ag∶Cl=25.7∶26.7∶47.6,Cs∶Ag∶Cl接近化学计量比1∶1∶2,进一步证实了CsAgCl2化合物的形成。

图2 (a)CsCl 和AgCl 量比为1∶1 且浓盐酸的量为1 mL 时得到样品的XRD 图谱;(b)未知相CsAgCl2 的SEM 图像和mapping 图像。Fig.2 (a)The XRD spectrum of the sample was obtained when the molar ratio of CsCl to AgCl was 1∶1 and the amount of concentrated hydrochloric acid was 1 mL.(b)SEM and element mapping images of unknown phase CsAgCl2.
3.2 升温诱导CsAgCl2相变
升高温度是实现多相材料相变的常用方法[15,22]。将制备的未知相CsAgCl2加热到555 K 并保温3 h。对加热前后的样品分别进行了XRD 测试。加热后样品的所有衍射峰和正交相CsAgCl2(PDF#76-2238)的衍射峰有较好的匹配(图3(a))。结果表明,所制备的未知相CsAgCl2在高温555 K加热后完全转变为正交相CsAgCl2。对制备的未知相CsAgCl2样品测试了TG-DSC 曲线。从室温一直升温到675 K,样品没有明显的重量损失(图3(b)),但在526 K 时观察到一个明显的放热异常峰,表明有相变发生。结合图2(a)的XRD 测试结果可知,未知相是低温相,而正交相是高温相和热力学稳定相。热膨胀测量法是探测各种相变的有力工具[30]。对制备的未知相CsAgCl2进行了线性热膨胀ΔL/L测试(图3(c))。ΔL/L转变温度出现在535 K 处,接近DSC 曲线中的放热异常温度,进一步证实了相变发生。

图3 (a)CsAgCl2 在555 K 加热3 h 前后的XRD 图;(b)未知相CsAgCl2 样品的TG-DSC 曲线;(c)未知相CsAgCl2 样品的线性热膨胀ΔL/L 随温度的函数;(d)加热后CsAgCl2的激发光谱和发射光谱。Fig.3 (a)XRD patterns of CsAgCl2 before and after heating at 555 K for 3 h.(b)TG-DSC curve of unknown phase CsAgCl2 sample.(c)Linear thermal expansion of unknown phase CsAgCl2 samples ΔL/L as a function of temperature.(d)Excitation and emission spectra of CsAgCl2 after heating.
对加热后制备的正交相CsAgCl2进行了荧光光谱测试。如图3(d)所示,左侧为CsAgCl2的激发光谱(PLE),只有一个激发峰,激发峰位置大约在260 nm;右侧为在255~269 nm 不同激发波长下的发射光谱(PL)。PL 光谱只有一个发射峰,表现出宽带发射,发射峰覆盖范围为460~850 nm,半峰宽为240 nm;发射峰位于620 nm,表明其斯托克斯(Stokes)位移可高达360 nm。这种大斯托克斯位移以及宽带发射说明正交相CsAgCl2发光属于自陷激子发射[31]。在不同波长的激发下,发射光谱的形状完全相同。这种光谱现象表明CsAg-Cl2的宽带发射源于相同的自陷激子中心。
3.3 Eu3+掺杂诱导CsAgCl2相变
掺杂工程已成为诱导结构相变的一种有效方法[18,32-34]。本文通过水热合成法得到掺杂3%Eu3+以及不掺杂3%Eu3+的CsAgCl2样品,如图4(a)所示,对它们进行XRD 测试。通过对比PDF 卡片库,不掺杂Eu3+的CsAgCl2样品为未知相(图2(a)),掺杂Eu3+的CsAgCl2样品与正交相CsAgCl2(PDF#76-2238)的X 射线衍射峰有较好的匹配,说明Eu3+掺杂的样品为正交相CsAgCl2。该结果表明Eu3+掺杂可以诱导CsAgCl2从未知相向正交相转变。对Eu3+掺杂的样品进行SEM 能谱测试,元素mapping 图(图4(b))显示制备的样品中含有Cs、Ag、Cl、Eu 元素,且元素呈现均匀分布的形态,进一步证实Eu3+被掺杂到CsAgCl2基质中。
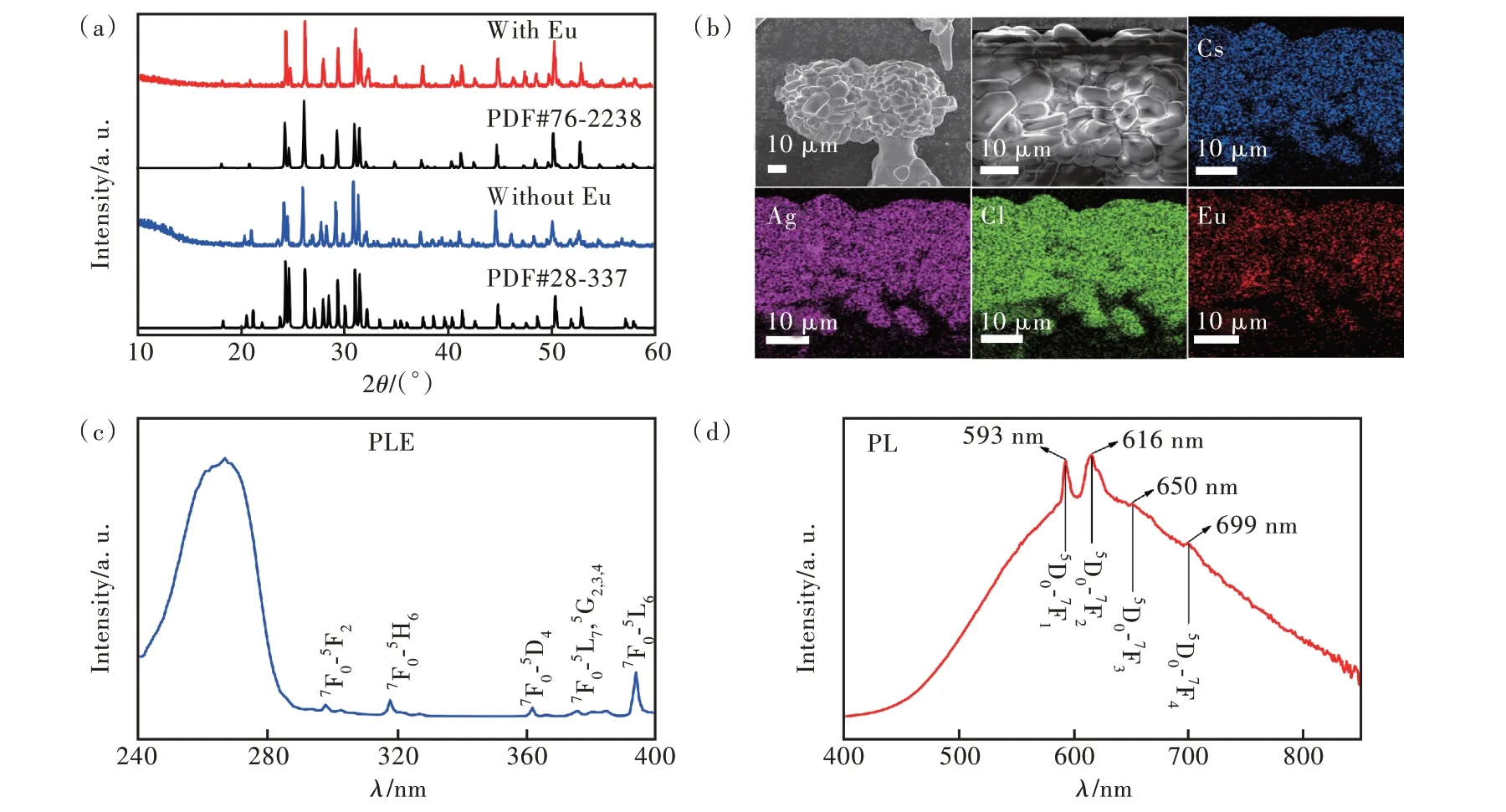
图4 (a)Eu3+掺杂CsAgCl2前后的XRD 图;(b)CsAgCl2∶3%Eu3+的SEM-mapping 图像;(c)CsAgCl2∶3%Eu3+的激发光谱(λem=620 nm);(d)CsAgCl2∶3%Eu3+的发射光谱(λex=260 nm)。Fig.4 (a)XRD patterns of CsAgCl2 before and after doping Eu3+.(b)SEM-element mapping images of CsAgCl2∶3%Eu3+.(c)Excitation spectrum of CsAgCl2∶3%Eu3+(λem=620 nm).(d)Emission spectrum of CsAgCl2∶3%Eu3+(λex=260 nm).
对Eu3+掺杂诱导的正交相CsAgCl2进行了荧光光谱测试。图4(c)为PLE 光谱,主要由位于240~290 nm 范围的宽激发带和290~400 nm 范围的线状激发峰组成。其中前者源于正交相CsAg-Cl2(图3(d));后者线状激发峰的位置分别是298,318,362,376,380,385,394 nm,归属于Eu3+的特征激发,分别对应于Eu3+基态电子的7F0→5F2、7F0→5H6、7F0→5D4、7F0→5G2、7F0→5G3、7F0→5G4和7F0→5L6跃迁[35-36]。图4(d)为PL 光谱,表现出宽带发射,发射峰覆盖范围为400~850 nm,其中在593,616,650,699 nm 处的线状发射峰归属于Eu3+的特征发射,分别对应于Eu3+激发态电子的5D0→7F1、5D0→7F2、5D0→7F3、5D0→7F4跃迁[35-36]。荧光光谱测试结果进一步表明Eu3+被掺杂到CsAgCl2的晶格中。
3.4 Eu3+掺杂的CsAgCl2光学温度传感
目前,关于CsAgCl2在光学温度传感中的应用尚未见报道。为了探索CsAgCl2在光学温度传感中的潜在应用,对Eu3+掺杂的CsAgCl2的温度相关的PL 发射光谱进行测试。图5(a)为Eu3+掺杂的CsAgCl2在260 nm 波长激发下随温度变化(从300 K 升高到525 K)的发射光谱。PL 发射光谱的最大荧光峰位于616 nm,发射光谱覆盖范围较宽,其范围为400~850 nm。在592 nm 和616 nm 处有两个明显的PL 发射峰,这属于Eu3+的特征发射峰。如图5(b)所示,随着温度的升高,PL 荧光强度出现了明显的下降。这可能是由于随着温度的升高,非辐射复合过程增大,荧光强度发生热猝灭,从而导致发射强度降低。相对灵敏度Sr是温度传感性能的重要参数之一。为了评估荧光强度模式的温度传感性能,对其进行荧光温度灵敏度计算,荧光强度随温度变化的相对灵敏度可定义为[37]:

图5 (a)CsAgCl2∶3%Eu3+在260 nm 激发下的变温荧光发射光谱;(b)CsAgCl2∶3%Eu3+的荧光积分强度与温度的依赖性关系,温度范围为300~525 K;(c)CsAgCl2∶3%Eu3+基于积分荧光强度的相对灵敏度对温度的依赖关系。Fig.5 (a)Temperature dependent fluorescence emission spectra of CsAgCl2∶3%Eu3+ under 260 nm excitation.(b)The relationship between relative integral intensity and temperature with a temperature range of 300-525 K for CsAgCl2∶3%Eu3+.(c)The dependence of relative sensitivity of integrated fluorescence intensity on temperature for CsAgCl2∶3%Eu3+.
其中I为积分发射强度,积分范围为400~850 nm,T为绝对温度。图5(c)为Eu3+掺杂的CsAgCl2的相对灵敏度与温度之间的点线图。在300~525 K的温度范围内,325 K 时相对灵敏度Sr最大,可高达3.63%·K-1。
为了进一步探究CsAgCl2在光学温度传感中的应用,研究了荧光寿命模式下Eu3+掺杂的CsAg-Cl2的光学温度传感性能。Eu3+掺杂CsAgCl2的荧光寿命可以采用二级指数函数来拟合,具体计算公式如下:
其中,I为发光强度,A1和A2为常数,t为时间,τ1和τ2为发光衰减寿命,平均荧光寿命τ*可以采用以下公式计算:
对Eu3+掺杂的CsAgCl2进行了变温荧光寿命测试(图6(a))。随着温度从300 K 升高到475 K,Eu3+掺杂的CsAgCl2的平均荧光寿命从1.96 µs 降低到0.99 µs。但随着温度进一步升高到525 K,PL平均荧光寿命明显提高到2.97 µs(图6(b))。为了评估荧光寿命模式的温度传感性能,对其进行荧光温度灵敏度计算,PL 荧光寿命随温度变化的相对灵敏度可定义为[35]:
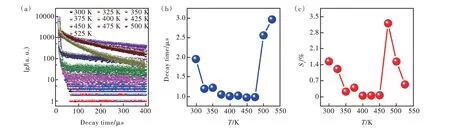
图6 (a)CsAgCl2∶3%Eu3+在激发波长为260 nm、发射波长为620 nm 下的变温荧光衰减光谱;(b)CsAgCl2∶3%Eu3+的荧光寿命(τ)与温度(T)的关系,T 取值范围为300~525 K;(c)CsAgCl2∶3%Eu3+基于荧光寿命的相对灵敏度对温度的依赖关系。Fig.6 (a)The temperature dependent fluorescence lifetime decay spectra of CsAgCl2∶3%Eu3+ under excitation at 260 nm and an emission at 620 nm.(b)The relationship between fluorescence lifetime(τ)and temperature(T)for CsAgCl2∶3%Eu3+with a range of 300-525 K.(c)The dependence of relative sensitivity of fluorescence lifetime on temperature for CsAgCl2∶3%Eu3+ .
其中,τ为荧光寿命,T为绝对温度。相对灵敏度Sr与温度之间的关系如图6(c)所示。在300~525 K 的温度范围内,475 K 时的相对灵敏度Sr最大,可高达3.20%·K-1。温度分辨率δT是表征光学温度传感性能的另一个重要参数,其计算公式如下[38]:
其中,Sr是相对灵敏度,是测定温度参数值的相对误差。通过计算,在450 K时,Eu3+掺杂CsAgCl2的温度分辨率有最大值0.11 K。其温度分辨率数值较小,说明其有较好的温度传感分辨能力。
4 结论
本文通过水热反应在455 K 温度下合成了未知相CsAgCl2。对未知相CsAgCl2在555 K 温度下进行了加热处理。PXRD 测试、TG-DSC 和热膨胀测量证实了CsAgCl2从未知相转变成正交相,且未知相是低温相,正交相是高温相和热力学稳定相。在制备未知相CsAgCl2时通过掺入Eu3+可以实现CsAgCl2从未知相到正交相的物相转变。对Eu3+掺杂的CsAgCl2进行了双模式光学温度传感研究。在300~525 K 的温度范围内,基于荧光强度模式Eu3+掺杂的CsAgCl2的温度传感相对热灵敏度Sr最大值可达3.63%·K-1,基于荧光寿命模式Eu3+掺杂的CsAgCl2的温度传感相对热灵敏度Sr最大值可达3.20%·K-1。本研究为探索相变和新的光学温度传感介质方面提供了新的思路。相变策略有望扩展到其他系统,并促进高灵敏度光学温度传感材料的开发。
本文专家审稿意见及作者回复内容的下载地址:http://cjl.lightpublishing.cn/thesisDetails#10.37188/CJL.20230129.

