胶原蛋白肽联合海藻酸钠通过下调NLRP3 炎症小体表达改善小鼠宫腔粘连
程怡怡赵伟伟宋振峰童福雯刘刚张花施磊磊郭志坤王现伟潘莹*孙永琨*
(1. 新乡医学院第三附属医院,河南新乡 453003;2. 新乡医学院基础医学院,河南新乡 453003;3. 新乡医学院三全学院,河南新乡 453003;4. 河南省医用组织再生重点实验室,河南新乡 453003;5. 南通业盟新材料股份有限公司,江苏南通 226000)
育龄期女性子宫内膜在性激素的作用下经历周期性的脱落、修复和再生,其中子宫内膜修复不会形成瘢痕[1]。 然而当子宫内膜基底层损伤后易导致子宫内膜修复障碍从而形成宫腔内粘连[2-3]。宫腔粘连(intrauterine adhesion,IUA)是女性生殖系统中常见的一种子宫内膜纤维化疾病,主要因子宫内膜损伤或感染引起子宫内膜基底层损伤,诱发异常的炎症反应,造成大量胶原纤维沉积在子宫腔内,导致子宫内膜纤维化,主要表现为宫腔堵塞、盆腔疼痛、月经紊乱、闭经、继发性不孕、妊娠异常等,严重影响女性的身心健康[4-5]。 目前,尚缺乏有效治疗IUA 的方法,因此有效预防IUA,减少IUA 并发症,对提高IUA 患者的生活质量具有重要的临床意义[6]。 NLRP3 炎症小体是涉及免疫调节和炎症反应的蛋白质复合物,主要是由NLRP3 受体蛋白、凋亡相关的斑点样蛋白(apoptosis-associated specklike protein containing a CARD,ASC)和效应蛋白半胱氨酸的天冬氨酸酶-前体(Pro-caspase-1)3 种不同类型的蛋白质组成,在机体免疫和疾病发生过程中起到重要作用[7-8]。 研究发现NLRP3 炎症小体参与肾、肝、肺等多器官纤维化的发生发展,而抑制NLRP3 炎症小体活化可减轻炎症反应和纤维化程度[9-11]。 然而,NLRP3 炎症小体在IUA 中的作用尚未见报道。 研究显示胶原蛋白肽(collagen peptide,CP)和海藻酸钠(sodium alginate,SA)具有抗炎、促进创面的愈合等功能[12-14],但其对IUA 的作用机制还需要进一步的研究。 因此,本研究将CP 和SA 应用于损伤后的小鼠子宫内膜,探讨其对IUA 形成的影响,为临床防治IUA 提供新的治疗思路。
1 材料与方法
1.1 材料
1.1.1 实验动物
48 只SPF 级性成熟且未交配雌性C57BL/6N小鼠,9 ~12 周龄,体重19 ~24 g,购于河南斯克贝斯生物科技股份有限公司动物实验中心【SCXK(豫)2020-0005】。 每笼5 只,饲养环境:温度20 ~26℃,湿度40% ~70%,光照明暗时间为12 h/12 h,循环照明,饲养期间各组小鼠自由获取标准鼠食和水,饲养于新乡医学院实验动物中心SPF 级环境【SYXK(豫)2020-0011】,常规适应1 周后用于实验。实验中所涉及操作均符合新乡医学院第三附属医院实验动物伦理学的相关要求(K2021-033-01)。
1.1.2 主要试剂与仪器
胶原蛋白肽和海藻酸钠(南通业盟新材料股份有限公司,中国),异氟烷(深圳市瑞沃德生命科技有限公司,中国),多聚甲醛(国药集团化学试剂有限公司,中国),HE 染色试剂盒(Beyotime,C105S,中国),改良Masson 三色染色试剂盒(Solarbio,G1345,中国),NLRP3/NALP3(Adipogen,AG-20B-0014-C100,美国),ASC(ABclonal,A11433,中国),Anti-Caspase-1(Abcam,ab138483,英国),Anti-IL-1β(Abcam,ab9722,英国),IL-18(ABclonal,A20473,中国),GAPDH(Proteintech,6004-1-l,中国),β-Actin(Beyotime,AF5003,中国),辣根酶标记山羊抗兔(ZSGB-BIO,ZB-2301,中国),辣根酶标记山羊抗小鼠(ZSGB-BIO,ZB-2305,中国),小鼠IL-1β ELISA试剂盒(CUSABIO,CSB-E08054m,中国),小鼠IL-18 ELISA 试剂盒(MULTI SCIENCES,EK218-96,中国)。 小动物呼吸麻醉机(瑞沃德,中国),研究级正置多功能显微镜(Nikon NI-U,日本),小型垂直电泳转印系统(Bio-Rad,美国)。
1.2 方法
1.2.1 小鼠IUA 模型的建立
本模型的构建以95%乙醇作用于子宫内膜引起子宫内膜化学性损伤、炎症反应及纤维化为基础,构建稳定且有效的小鼠IUA 模型[15-16]。 选取正常发情周期的小鼠,于动情期造模,操作步骤如下:使用小动物呼吸麻醉机进行麻醉,令小鼠吸入2%~3%浓度的异氟烷麻醉剂诱导麻醉后,将小鼠置于小动物操作台上给予持续吸入1.5% ~2.5%异氟烷维持麻醉,再使用连接注射器的灌胃针探查宫颈口,经宫颈注入95%乙醇直至观察到有乙醇从阴道口流出,维持1 min,再经宫颈注射0.9%生理盐水2 mL 冲洗子宫腔内残余的乙醇。
1.2.2 实验动物分组及处理
将48 只小鼠随机分为3 组,分别为假手术组、模型组和治疗组(CP +SA),每组16 只。 模型组按上述方法经小鼠子宫颈宫腔注射95%乙醇进行子宫内膜损伤,制备IUA 模型。 假手术组经小鼠子宫颈向宫腔注射0.9%生理盐水。 治疗组(CP +SA)经小鼠子宫颈向宫腔注射95%乙醇进行造模后再向宫腔注射5%CP +2.5%SA 混合液。 各组小鼠造模后均饲予正常食物和水。
1.2.3 样本取材及处理
造模7 d 后每组随机取8 只小鼠取材,采用2%~3%异氟烷吸入麻醉,取血后,离心,取上层血清冻存,用于ELISA 实验。 取子宫组织,部分置于-80℃保存备用,用于蛋白含量测定;部分置入新鲜配置的4%多聚甲醛液中固定,常规石蜡包埋切片,用于后续组织形态学染色以及改良Masson 三色染色。
1.2.4 生殖能力检测
剩余各组小鼠于造模7 d 后按照雄鼠与雌鼠比例1 ∶2于20:00 合笼,第2 天8:00 阴道涂片检查,以显微镜下见精子记为妊娠第1 天,观察小鼠怀孕情况,记录各组妊娠小鼠数量,于妊娠第14 天处死妊娠小鼠,记录胚胎数量。
1.2.5 苏木素-伊红(HE)染色观察子宫内膜形态学变化
子宫组织切片常规脱蜡至水,苏木素染色5 min,浸入流动自来水中冲洗约10 min,伊红染色1 min,脱水透明,中性树胶封固,随后在10 × 4 倍和10 × 20 倍显微镜下观察子宫内膜病理形态学变化并拍照,用Image J 软件计数子宫内膜腺体数量。
1.2.6 改良Masson 三色染色观察子宫内膜纤维化程度
子宫组织切片常规脱蜡至水,切片入Bouin 液媒染2 h,天青石蓝染色2 min,Mayer 苏木素染色2 min,酸性乙醇分化液分化10 s,磷钼酸溶液处理10 min,苯胺蓝染色5 min,弱酸处理2 min,脱水透明,中性树胶封片后,在显微镜下观察子宫内膜纤维化程度,10 × 4 倍和10 × 20 倍显微镜下拍照,用Image J 软件分析各组子宫内膜纤维化程度。
1.2.7 Western Blot 检测各组子宫组织NLRP3、ASC、Caspase-1、IL-1β、IL-18 蛋白表达情况
将各组小鼠子宫组织匀浆后,提取蛋白后测定蛋白浓度,依次进行配胶、上样、电泳、电转、封闭,分别孵育对应的一抗和二抗,洗膜后在Azure 电化学发光成像系统显影,用Image-Pro Plus 软件分析计算目的蛋白及内参蛋白的灰度值。
1.2.8 ELISA 检测血清IL-1β 和IL-18 的含量
取各组小鼠血清,严格按照ELISA 检测试剂盒的操作流程,检测各组小鼠血清IL-1β 和IL-18 的含量,以标准品浓度作纵坐标,以OD 值作横坐标,作标准曲线,计算各血清样本中所测指标的水平。
1.3 统计学分析
本研究数据以平均值± 标准差(±s)表示,采用Image J、Image pro-plus 进行定量分析,采用GraphPad Prism 8.0 进行统计学分析作图。 多组间数据比较采用单因素方差分析(One way-ANOVA)和多重比较检验进行分析。 以P<0.05 表示差异具有显著性。
2 结果
2.1 小鼠子宫组织HE 染色形态学观察
由图1 可见,与假手术组相比,模型组子宫内膜变薄、破坏,子宫腔上皮消失,子宫内膜腺体数量减少,差异具有显著性(P<0.001),并伴有较多炎性细胞浸润。 与模型组相比,治疗组子宫内膜损伤程度明显改善,子宫内膜厚度较前增加,炎性细胞浸润减轻,子宫内膜腺体数量也相应增加,差异具有显著性(P<0.05)。
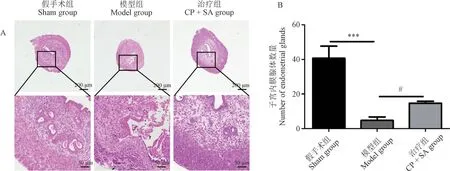
注:A:HE 染色评估子宫组织形态学变化;B:用Image J 定量子宫内膜腺体数量;与假手术组相比,***P <0.001;与模型组相比,#P <0.05。 (下图同)图1 子宫组织横切形态学观察Note. A. HE staining was used to evaluate the morphological changes of uterine tissues. B. Image J was used to quantify the number of endometrial glands. Compared with sham group,***P <0.001. Compared with model group,#P <0.05. (The same in the following figures)Figure 1 Morphological observation of transverse section of uterine tissue
2.2 小鼠子宫组织改良Masson 三色染色结果
由图2 可见,与假手术组相比,模型组显示子宫组织内可见蓝染面积明显增加,提示胶原纤维增多,差异具有显著性(P<0.001)。 子宫内膜间质细胞和胶原纤维排列紊乱,分布不均,且胶原纤维与肌层粘连,子宫腔内炎性细胞浸润增多,提示小鼠宫腔粘连造模成功。 与模型组相比,CP +SA 治疗组子宫组织内蓝染胶原纤维面积明显减少,差异具有显著性(P<0.001)。
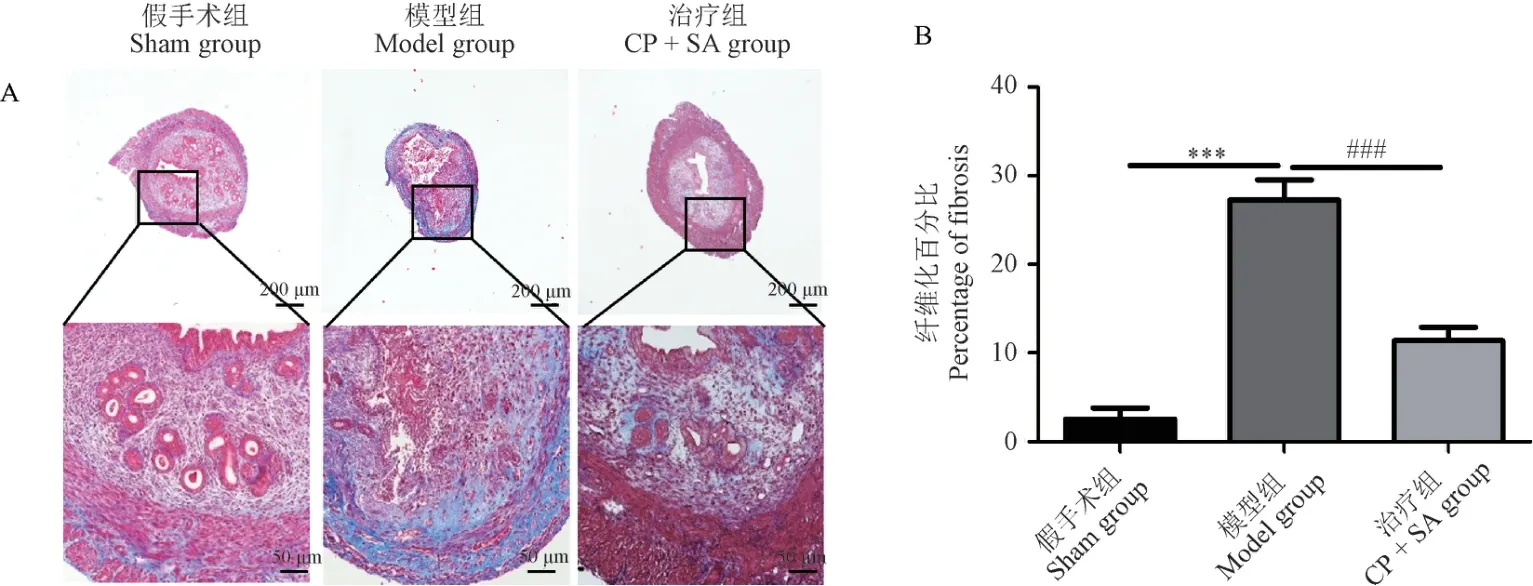
注:A:改良Masson 三色染色评估纤维化程度,胶原纤维被染成深蓝色,肌纤维被染成红色;B:用Image J 定量子宫内膜纤维化面积;与模型组相比,###P <0.001。 (下图同)图2 子宫组织横切纤维程度观察Note. A. Modified Masson tri-color staining was used to assess the degree of fibrosis. The collagen fibers were dyed blue and the muscle fibers were dyed red. B. Image J was used to quantify the area of endometrial fibrosis. Compared with the model group,###P <0.001. (The same in the following figures)Figure 2 Observation of the degree of transverse fibrosis in uterine tissue
2.3 Western Blot 检测小鼠子宫组织中NLRP3、ASC、Caspase-1、IL-1β、IL-18 蛋白表达量
由图3 可见,与假手术组相比,模型组小鼠子宫组织NLRP3、ASC、Caspase-1、IL-1β、IL-18 蛋白相对表达量均明显升高,差异具有显著性(P<0.001,P<0.01 或P<0.05)。 与模型组相比,CP +SA治疗组小鼠子宫组织NLRP3、ASC、Caspase-1、IL-1β、IL-18 蛋白相对表达量均明显降低,差异具有显著性(P<0.001 或P<0.01)。

注:与假手术组相比,*P <0.05,**P <0.01;与模型组相比,##P <0.01。 (下图同)图3 各组子宫组织NLRP3、ASC、Caspase-1、IL-1β、IL-18 的蛋白表达Note. Compared with sham group,*P <0.05,**P <0.01. Compared with the model group,##P <0.01. (The same in the following figures)Figure 3 Protein expression electrophoresis of NLRP3,ASC,Caspase-1,IL-1β and IL-18 in uterine tissues of each group
2.4 小鼠血清中IL-1β 和IL-18 炎性因子分泌水平的影响
由图4 可见,与假手术组相比,模型组小鼠血清中IL-1β 和IL-18 的水平均明显升高,差异具有显著性(P<0.01 或P<0.001)。 与模型组相比,治疗组小鼠血清中IL-1β 和IL-18 的水平均明显降低,差异具有显著性(P<0.01 或P<0.001)。
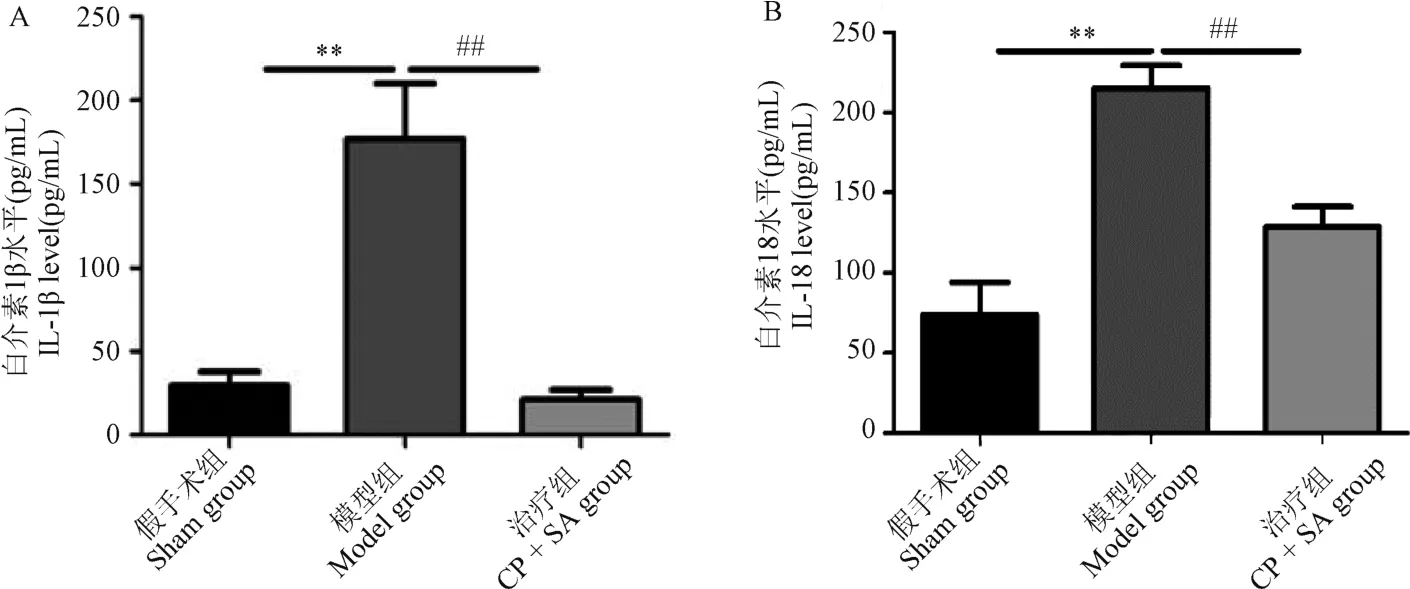
注:A:血清中IL-1β 的分泌水平;B:血清中IL-18 的分泌水平。图4 各组小鼠血清中IL-1β 和IL-18 的分泌水平Note. A. Serum IL-1β secretion level. B. Serum IL-18 secretion level.Figure 4 Secretion levels of IL-1β and IL-18 in serum of mice in each group
2.5 小鼠生殖能力检测
由图5 可见,与假手术组相比,模型组小鼠妊娠能力下降,子宫呈现不同程度受损,子宫内妊娠胚胎数量也相应降低,差异具有显著性(P<0.01)。与模型组相比,CP +SA 治疗组小鼠妊娠能力改善,子宫内妊娠胚胎数量明显升高,差异具有显著性(P<0.01)。

注:A:小鼠妊娠数量;B:妊娠后胚胎数量量化图。图5 各组小鼠妊娠情况Note. A. Number of pregnancies in mice. B. Quantitative map of number of embryos after pregnancy.Figure 5 Pregnancy of mice in each group
3 讨论
IUA 是多种子宫手术或感染后的严重并发症,最终引起子宫腔内异常纤维化。 患有IUA 的女性可伴有因月经不调引起的周期性盆腔疼痛、月经过少、闭经,甚至出现月经逆行导致子宫内膜异位症的发生,还会出现不孕不育或反复流产,导致胎儿宫内生长受限和胎盘植入[6,17]。 目前在临床上对于IUA 的预防措施,主要包括术后宫腔内放置节育器、子宫球囊支架、生物屏障、干细胞移植以及药物综合治疗等[18]。 其中生物屏障因其刺激性小、可降解性、低毒性、低免疫原性等优点,在IUA 的防治中发挥着重要作用。 CP 是从动物组织中提取的一种具有抗氧化特性的生物活性肽,具有较高的营养价值、良好的保湿性能、良好的生物相容性和生物降解性等特性,可促进成纤维细胞的生长和透明质酸的合成,减轻炎症反应,从而促进伤口的愈合,在制药、保健和食品保鲜等方面应用广泛[19-20]。 SA 作为一种从褐藻中获得的天然存在的阴离子多糖聚合物,能与阳离子接触形成凝胶,在制药中得到了广泛的应用。 因其具有低毒、低成本、良好的生物相容性和生物降解性而成为创面敷料的首选材料[13,21]。
因此,在本研究中,通过制备了一种由CP 和SA 组成的可注射混合液,作用于受损后的小鼠子宫内膜,观察CP 和SA 联合应用对子宫内膜修复的影响。 结果显示,与假手术组相比,模型组小鼠子宫内膜明显受损,子宫内膜腺体数量减少,子宫内膜呈现纤维化改变,符合临床IUA 特征。 与模型组相比,CP 和SA 治疗组小鼠子宫内膜损伤程度明显改善,子宫内膜腺体数量明显增加,且子宫内膜纤维化程度减轻。 提示CP 和SA 联合应用对IUA 的形成有明显的改善作用。
以往研究表明,炎症反应与组织再生修复过程密切相关,如皮肤再生修复、血管再生修复和神经再生修复[22-24]。 多种生物材料,如CP、SA 等,已被证明能够调节伤口愈合中的炎症反应[14,25]。 胶原蛋白肽混合物可通过降低炎症因子IL-1β 和IL-18的水平促进糖尿病小鼠的创面愈合[14]。 载药SA 水凝胶可通过抑制巨噬细胞的聚集降低炎症反应[26]。本研究结果显示,CP 和SA 联合应用可减少由95%乙醇诱导的IUA 所产生的炎症反应。
NLRP3 炎症小体信号通路在炎症过程中发挥重要作用。 NLRP3 炎症小体是由NLRP3、ASC 和Pro-caspase-1 组成的多蛋白质复合体。 正常情况下,NLRP3 炎症小体处于抑制状态,当机体受到炎症等刺激后,NLRP3 与ASC 之间相互作用,ASC 与Pro-caspase-1 之间相互作用,激活Caspase-1 诱导自我切割,促进促炎症细胞因子的成熟和分泌,如IL-1β 和IL-18[27]。 本研究显示,与假手术组相比,IUA模型小鼠子宫组织中NLRP3、ASC、Caspase-1、IL-1β和IL-18 蛋白表达水平显著升高,血清中IL-1β 和IL-18 的水平也显著升高。 与模型组相比,CP 和SA治疗组小鼠子宫组织中NLRP3、ASC、Caspase-1、IL-1β 和IL-18 蛋白表达水平不同程度降低,血清中IL-1β 和IL-18 的水平也显著降低。 此外,还检测了造模后小鼠的生殖能力,发现模型组小鼠妊娠数量及妊娠后胚胎数量下降,而CP 和SA 治疗组小鼠妊娠数量及妊娠后胚胎数量明显高于模型组,提示CP和SA 联合应用可有效改善小鼠生殖能力。 以上研究表明,CP 和SA 联合应用明显抑制NLRP3、ASC、Caspase-1、IL-1β 和IL-18 的表达,提示CP 和SA 联合应用可能通过抑制NLRP3 炎症小体,进而抑制了IL-1β 和IL-18 炎症因子的分泌,减轻了产生的炎症级联反应,促进子宫内膜修复,从而提高小鼠生殖能力。
综上所述,CP 和SA 联合应用可有效抑制子宫内膜损伤后的炎症反应,加速子宫内膜修复,改善小鼠生殖能力。 其作用机制可能与下调NLRP3 炎症小体表达有关。 CP 和SA 联合应用有助于改善受损后子宫内微环境,提高其在子宫内膜损伤中的治疗效果,为预防IUA 的发生提供了一种新的途径。

