早期食管癌及癌前病变内镜黏膜下剥离术术后疼痛的危险因素研究
贾冬梅 郜元军 童强 李胜保 金曙 刘晓波
内镜黏膜下剥离术(ESD)出现于20世纪90年代,被广泛应用于早期食管癌及癌前病变的治疗[1]。在许多研究中(发表了970多个案例)证明了ESD用于早期食管癌的安全性和有效性,技术成功率为99%[2-3]。虽然ESD对于早期食管癌是一种非常有效的技术,但食管管腔较窄、管壁较薄,由于器械设备、内窥镜技术、操作者的操作经验、患者的全身状况等因素仍然存在相对较高的并发症发生率[4-5]。食管ESD常见并发症有出血(0~5.2%)[6-8]、穿孔(0~6.9%)[3,6,8-9]及狭窄(6.8%~17.2%)[8,10-11],除这些常见并发症外,ESD术后还经常出现疼痛、发热等并发症,有效预防和治疗并发症是早期食管癌内镜治疗的关键。目前关于ESD术后疼痛发生的危险因素相关研究较少,本研究回顾性分析湖北医药学院附属太和医院2014年1月~2021年5月因食管病变行ESD治疗的患者,以探究食管ESD术后疼痛发生的危险因素,为临床进一步制定防治措施提供参考和依据。
对象与方法
1.对象:纳入2014年1月~2021年5月湖北医药学院附属太和医院因食管病变而施行ESD治疗的患者311例,其中男231例、女80例,年龄37~86岁,平均年龄(59.74±8.30)岁。按照术后是否需要止痛药物缓解疼痛,将所有患者分为无痛组(250例)和疼痛组(61例)。纳入标准:(1)均成功完成ESD;(2)均通过术后病理证实为早期食管癌或癌前病变;(3)临床及内镜资料完整。排除标准:(1)单纯食管病变且为多病灶;(2)食管分段切除;(3)术后有明显的纵隔或皮下气肿,经影像学检查证实为穿孔;(4)食管和胃同时行ESD;(5)术后病理诊断为食管平滑肌瘤、黏膜慢性炎症或角化不良等。本研究经湖北医药学院附属太和医院伦理委员会审核批准,所有患者均签署知情同意书。
2.方法
(1)ESD过程:①病灶识别和标记;②黏膜下注射;③边缘切开;④黏膜下剥离;⑥标本处理:将切下的病变用大头针固定于平板上,中性甲醛液固定送病理检查,标注口侧缘、肛侧缘及距门齿距离用于病理检查以评估水平和垂直边缘[12]。所有ESD过程均由本院2名高年资医师进行操作。术后所有患者均禁食、禁水3天,同时接受静脉注射质子泵抑制剂、抗生素或止血药物等治疗。术后对患者密切监测,记录不良事件发生情况。体温(腋下)每天测量3次,直到出院。
(2)术后组织学评估:切除的标本固定在福尔马林溶液中,并以2 mm的间隔连续垂直切片,进行组织病理学评估,包括肿瘤侵犯深度、组织学类型、垂直和水平切除边缘状态及淋巴血管侵犯情况。ESD术后标本面积以病理报告为准,所有术后标本都类似于椭圆形,故标本面积(cm2)=[π×标本长径(cm)×标本短径(cm)]/4。环周大小为ESD术后标本横径占食管环周横径的比例。目前国内较为公认的早期食管癌定义指病灶局限于黏膜层和黏膜下层,不伴有淋巴结转移的食管癌[12]。低级别上皮内瘤变(LGIN)相当于轻、中度异型增生,高级别上皮内瘤变(HGIN)则相当于重度异型增生及原位癌[12]。浸润深度分为M1(局限于黏膜上皮层)、M2(局限于黏膜固有层)、M3(限于黏膜肌层)及SM(达到黏膜下层),SM又可分为SM1(黏膜下浸润深度≤200 μm)和SM2(黏膜下浸润深度>200 μm)[13]。
(3)观察指标:收集所有患者的一般临床资料、病理资料及并发症发生情况。切除标本的水平和垂直切缘均为阴性称为完全切除[2]。水平切缘和垂直切缘阴性且没有淋巴管和血管侵犯的标本为治愈性切除,否则为非治愈性切除[12],此外,超出ESD适应证的病变亦认为是非治愈性切除[14]。ESD术后72 h内需要任何镇痛药(如非甾体类抗炎药物或阿片类止痛药物等)治疗胸骨后疼痛的患者定义为ESD术后疼痛阳性[15](需排除其他原因所致的疼痛,且不考虑使用止痛药物的次数及止痛药物的种类)。ESD术后72 h内体温>37.3 ℃为定义为ESD术后发热。

结 果
1.早期食管癌及癌前病变ESD术后患者临床病理特征:本研究311例患者,病变面积0.31~20.03 cm2,平均病变面积(5.779±3.981)cm2;完全切除率93.6%(291/311),治愈性切除率92.6%(288/311)。病变位置:胸上段27例(8.68%)、胸中段195例(62.70%)、胸下段89例(28.62%);病理类型:LGIN 45例(14.47%)、HGIN 205(65.92%)、鳞状细胞癌61例(19.61%);浸润深度:M1 228例(73.31%)、M2 37例(11.90%)、M3 25例(8.04%)、SM 21例(6.75%);环周大小:<50% 278例(89.39%)、50%~70% 11例(3.54%)、>70% 22例(7.07%)。
2.早期食管癌及癌前病变ESD术后患者疼痛的危险因素分析:单因素分析结果显示,患者年龄、病变位置、病变面积、环周大小均是ESD术后疼痛的影响因素(P<0.05),见表1。进一步行多因素logistic回归分析,结果显示患者年龄、病变位置位于胸下段均是ESD术后疼痛发生的独立危险因素(P<0.05)。见表2。
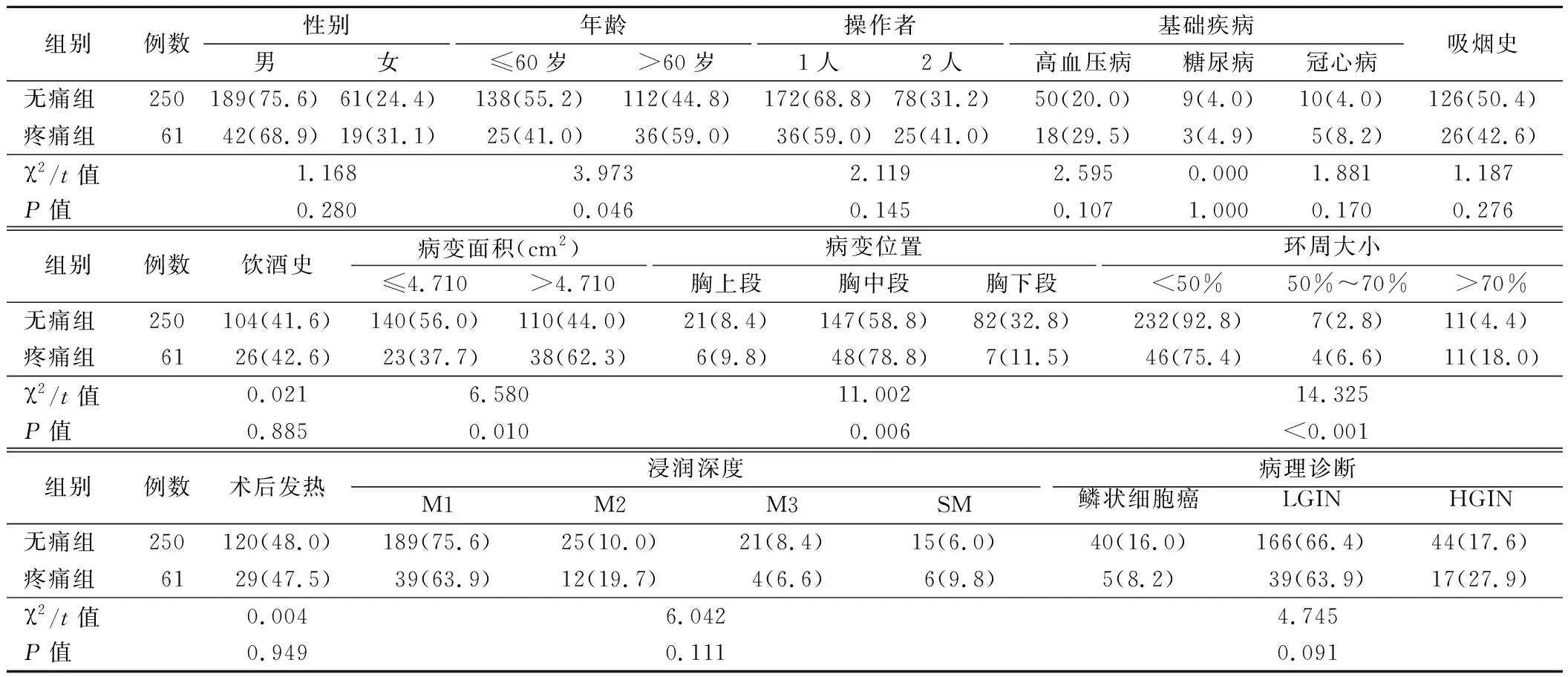
表1 早期食管癌及癌前病变ESD术后患者疼痛的单因素分析[例,(%)]
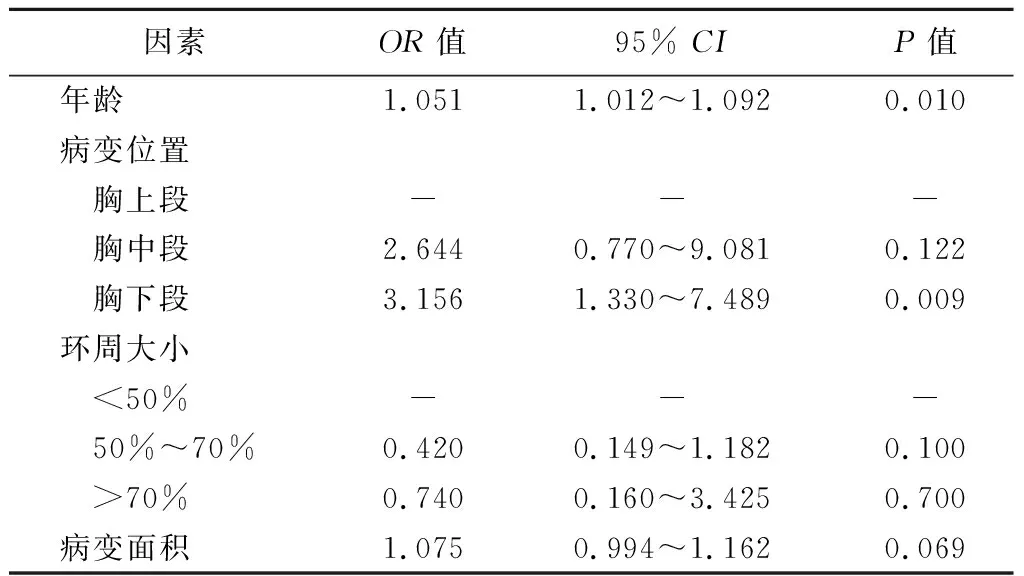
表2 早期食管癌及癌前病变ESD术后患者疼痛的多因素logistic回归分析
讨 论
疼痛是人体感觉神经系统损伤或异常刺激导致大脑不愉快的情绪反应,是人体自我保护的重要机制和正常生理特征,而术后疼痛是一类特殊类型的疼痛[16]。
本研究中食管ESD术后疼痛发生率为19.61%。Choi等[17]的一项研究结果显示,98%的患者在胃ESD术后感到疼痛。Jung等[18]的一项研究结果显示,胃ESD术后需要止痛药的中重度疼痛发生率为53.8%。Sakai等[15]的一项研究结果显示,食管ESD术后胸痛发生率为35.7%。上述研究中ESD术后疼痛发生率明显高于本研究结果,造成此差异的原因之一可能是ESD术后疼痛没有一个明确的定义及判断标准,且人体对疼痛的敏感性及特异性均存在较大的个体差异。另一原因可能是手术器官不同,上述研究器官多数为胃,而本研究则是食管,不同器官其疼痛传导的机制有所不同。但是,总体来说ESD术后疼痛的发生率并不低,应该引起临床医生的注意。
有研究表明,ESD术后有电凝综合征(PEECS)并发症的发生,可导致发热和腹痛[19-20]。PEECS的发生是由于浆膜烧伤或透壁烧伤,即在内镜治疗过程中,热通过高频设备传输时,肌肉层或浆膜烧伤[21-22]。还有多项研究表明,透壁烧伤和漏气[22-23]、对酸过敏[18]、严重的炎症反应[24]、炎症组织的收缩[18]、气体膨胀[25]等可能是ESD术后疼痛发生的相关机制。在临床工作中,我们发现食管ESD术后的患者在做吞咽动作时会加剧疼痛,因此,我们猜测食管运动可能与食管ESD术后疼痛有关,当然这需要进一步的研究来证明。基于上述机制,一些研究者研究了局部[26]和全身[27]使用类固醇类激素、在ESD期间或术后使用利多卡因[28]或芬太尼贴片[17]、预防性使用质子泵抑制剂[18]、围术期采用系统性联合个体化干预[29]、术后使用掀针联合化瘀止痛贴[30]等方法来缓解ESD术后疼痛。上述方法均能达到一定的效果,但未能得到最有效的方法,仍需要进一步研究探讨最佳减轻疼痛的方法。
本研究表明年龄、病变位置位于胸下段是早期食管癌及癌前病变ESD术后患者疼痛发生的独立危险因素。有研究表明,胃远端肿瘤和基线消化不良症状的患者在胃ESD术后更易出现疼痛[18]。另一项研究证明,女性、肿瘤位置和手术时间与胃EMR和ESD术后疼痛显著相关[25]。而本研究中男性占大多数,且性别与ESD术后疼痛无相关性,与上述研究存在一定的差异,可能与食管癌发病率的男女差异有关,且男性患者对疼痛的耐受能力普遍较高。另一项小样本研究表明,食管ESD术后疼痛的发生仅与术后第1天WBC计数升高有关[15],与患者一般临床病理特征无关,这与本研究结果也有一定的差异,可能与上述研究样本量较小有关。最近一项研究表明,食管ESD术后出现胸痛的独立危险因素是既往手术史和术后发热[31],而本研究结果显示ESD术后发热与术后患者病痛无相关性,这可能是由于本研究中所有患者术后均常规使用抗生素预防性抗感染治疗,故术后发热率所有降低,因此与上述研究存在一定差异。我们的研究证明病变位置位于食管胸下段是食管ESD术后疼痛的独立危险因素,其原因可能是食管胸下段手术会破坏食管下段括约肌及对食管动力产生影响[32],因此出现胃酸返流,胃酸刺激伤口引起剧烈疼痛。此外,本研究还证明年龄是食管ESD术后疼痛的独立危险因素,且从单因素分析可见,疼痛组患者年龄大于无痛组;出现上述差异可能是由于高龄患者易对手术及疾病产生恐惧及焦虑,对疼痛更敏感,故高龄患者术后疼痛发生率更高。
剧烈的疼痛往往会给患者的心理和生理带来极大的负面影响,其会影响患者对手术的满意度和术后的生活质量、延长住院时间、增加医疗成本[16,33],因此我们不仅要关注患者的疾病治疗,更要关注患者的预后和就医体验,有效的疼痛预防和管理可提高患者满意度和依从性。关于食管ESD术后疼痛发生的危险因素相关研究较少且尚未达成一致的意见,这仍然需要进一步研究。
综上所述,年龄越大、病变位置位于胸下段的早期食管癌及癌前病变患者在ESD术后更容易发生疼痛。对于存在上述危险因素的患者应提前采取相关措施来预防术后疼痛。
本研究存在以下局限:(1)为单中心、回顾性研究,具有选择和回忆偏倚。(2)对于ESD术后疼痛的定义没有一个明确的评估标准,仅被定义为需要止痛药。(3)疼痛的发生具有很大的个体差异性。因此,需要进一步的大样本、多中心研究来证明我们的结果。

