LAMC2 通过PI3K/Akt 信号通路调控胃癌细胞增殖的研究
王文博,汪清云,郭 卫,夏 泠*
(1.武汉大学中南医院腹部肿瘤放化疗科,武汉 430071;2.武汉大学泰康医学院(基础医学院)病理教研室,武汉 430071)
胃癌(gastric cancer)是常见的恶性消化道肿瘤之一,是全球癌症相关死亡的重要原因[1]。 虽然目前的诊断手段上有较大的改进,但大部分胃癌发病比较隐匿,确诊时,患者已处于中晚期,这是导致胃癌患者生存率低、预后差的主要原因[2-3],因此,筛选胃癌早期诊断标志物仍是胃癌的研究热点[3-4]。层粘连蛋白γ2(laminin subunit gamma 2,LAMC2)是异三聚体糖蛋白层黏连蛋白332(laminin-332,Ln-332)的γ2 亚基,是上皮基底膜的基本成分,调节细胞粘附、运动,但越来越多的研究发现LACM2 与肿瘤的发生及进展关系密切[5]。 LAMC2 在胰腺导管癌、卵巢癌、喉癌及肺癌等多种肿瘤中均高表达,促进细胞增殖、上皮-间质转化(epithelial-mesenchymal transition,EMT),降低肿瘤细胞对化疗药物的敏感性,已成为多种肿瘤的候选诊治靶标[6-9]。 但目前,LAMC2 的表达是否影响胃癌细胞的增殖,目前报道较少。 本研究利用肿瘤基因图谱(cancer genome atlas,TCGA)、基因表达综合数据库(gene expression omnibus,GEO)等数据库,结合细胞生物学的检测手段,观察LAMC2 的表达对人胃癌细胞增殖的影响及可能调控机制。
1 材料和方法
1.1 细胞
人胃癌细胞(HGC-27、NCI-N87、SNU-1)均购自于国家模式与特色实验细胞资源库,由本实验室保存;GES-1 人胃黏膜上皮细胞购自于赛百慷(上海)生物技术股份有限公司。
1.2 主要试剂与仪器
RPMI 1640 细胞培养基(货号:11875101)及优质胎牛血清(货号:16000-044)购自于美国Gibco 公司; LipofectamineTM3000 转 染 试 剂 盒( 货 号:L3000015)购自美国Thermo Fisher 公司;RIPA 裂解液(货号:LS-W-03268)、PBS(货号:LS-P-0106)、甲醇(货号:LS-H-0248)、结晶紫染色液(货号:LS-H-012)、4%多聚甲醛(货号:LS-P-113)及Western blot试剂盒(货号:LS-H-128)购自于武汉灵思生物技术有限公司;LAMC2(货号:ab274376)、PCNA (货号:ab29)、PI3 Kinase p85 α (phospho Y607)(货号:ab182651)、 pan-AKT ( 货 号: ab8805) 及 AKT(phospho T308)(货号:ab38449)抗体购自于英国Abcam 公司;CyclinD1(货号:26939-1-AP)、GAPDH(货号:60004-1-Ig)、c-Myc(货号:10828-1-AP)及辣根过氧化物酶(HRP) 标记的二抗(货号:APC-65210)购自于武汉三鹰生物技术有限公司;细胞培养所需6 孔板、25 cm2培养瓶、96 孔板及15 mL 离心管购自美国Corning 公司。 阴性对照及LAMC2敲减siRNA 由广州锐博生物科技有限公司设计及合成,序列参考课题组前期研究[9]。
BB150 型CO2细胞培养箱购自美国Thermo Fisher 公司;Lightcycler480 型荧光定量PCR 仪购自美国罗氏公司;DM3000 正置荧光显微镜购自德国莱卡;Varioskan LUX 酶标仪购自美国Thermo Fisher公司;Mini Gel Tank 型垂直电泳槽购自美国Thermo Fisher 公司。
1.3 实验方法
1.3.1 胃癌差异表达的基因筛选
基于| logFC |>2 及P<0.05 标准,edgeR R分析TCGA 及GEO 数据库中GSE122530 数据,获得胃 癌 差 异 表 达 基 因[9]。 通 过 CTD 数 据 库(comparative toxicogenomics database,CTD,http:/ /ctdbase.org/) 检索与细胞增殖相关的基因。 将TCGA、GEO 所获得的差异基因与CTD 数据库所检索得到的细胞增殖相关基因联合分析,以TCGA 及GEO 中上调倍数最大的基因为候选基因。 利用UALCAN(http:/ /ualcan.path.uab.edu/index.html)及Kaplan Meier plotter 数据库(http:/ /kmplot.com/analysis/)分析候选基因表达与胃癌临床特征的关系。
1.3.2 细胞复苏及培养
GES-1、HGC-27、NCI-N87 及SNU-1 细胞复苏后,均利用含有10%胎牛血清及1%双抗(青霉素100 U/mL,链霉素100 μg/mL)的RPMI 1640 培养基,置于37℃,5% CO2的细胞培养箱中培养,正常更换培养基,待细胞数量铺满培养瓶80%左右时,按照1 ∶2~3 的比例传代。
1.3.3 Western blot 检测LAMC2 在人胃癌细胞中的表达
参考课题组前期文献方法[9],收集GES-1 细胞及人胃癌细胞(HGC-27、NCI-N87、SNU-1),RIPA 裂解液(RIPA Lysis Buffer)裂解,提取总蛋白,BCA 蛋白定量试剂盒定量后,每组细胞按照20 mg 蛋白样品进行SDS-PAGE 电泳,电泳完成后转印至PVDF膜上,以GAPDH(1 ∶10 000)为对照,LAMC2(1 ∶800)抗体4℃孵育过夜,TBST 漂洗3 次,每次5 min,加入HRP 标记的兔抗二抗(1 ∶1000),37℃孵育2 h,TBST 漂洗,加入ECL 发光液,凝胶成像系统拍照,ImageJ 2x 软件分析各细胞中LAMC2 及GAPDH 的灰度值,以LAMC2 灰度值/GAPDH 灰度值的比值代表各细胞中LAMC2 的相对表达量。
1.3.4 LAMC2 敲减胃癌细胞模型构建
按照1×105/孔处于对数生长期的胃癌细胞(HGC-27、NCI-N87)接种于6 孔板中,待细胞铺满6孔板底部时,参照LipofectamineTM3000 转染试剂盒的说明书,Control 组给予4 μL LipofectamineTM3000+196 μL OptiRPMI 处理;转染组处理如下:4 μL LipofectamineTM3000+196 μL Opti-MEM 孵育5 min后,将其分别加入40 μL si-NC siRNA+60 μL Opti-MEM 和40 μL si-LAMC2 siRNA+60 μL Opti-MEM的混合液中,混合后静置30 min,将混合液分别添加至对应的6 孔板中,6 h 更换成新的完全培养基。 转染24 h 后,参考文献[10],Western blot 检测LAMC2的表达,与Control 组、si-NC 组比较,LAMC2 表达差异有统计学意义,表示LAMC2 敲减胃癌细胞模型构建成功;同时,比较si-LAMC2-1#及si-LAMC2-2#的敲减效率,筛选敲减效果最明显的siRNA 进行后续实验。
1.3.5 EdU 检测胃癌细胞增殖能力
按照1×105/孔处于对数生长期的胃癌细胞(HGC-27、NCI-N87)接种于6 孔板中,将胃癌细胞分成:Control 组、si-NC 组及si-LAMC2 组;各组细胞处理参照1.3.4,24 h 后,每孔细胞中加入总浓度为20 μmol/L 的EdU 工作液,置于细胞培养箱中继续培养2 h 后,吸去培养基,37℃预热PBS 漂洗3 次,每次3 ~5 min,4%多聚甲醛室温固定20 min,荧光显微镜拍照,计算每组细胞中阳性细胞占总细胞数百分比。
1.3.6 平板克隆实验检测胃癌细胞克隆形成能力
取对数生长期的胃癌细胞(HGC-27、NCIN87),按照1×103/孔接种于6 孔板中,分组同1.3.5。 细胞培养2 周后,观察到每组培养孔形成团状细胞时,PBS 清洗3 次,5 min/次,4℃预冷甲醇固定细胞20 min,结晶紫染色1 h,超纯水漂洗后晾干,倒置显微镜拍照,计数每组细胞中的总克隆数。
1.3.7 Western blot 检测胃癌细胞增殖相关蛋白表达
取对数生长期的胃癌细胞(HGC-27、NCIN87),按照1×104/孔接种于6 孔板中,分组同1.3.5。 24 h 后,参考文献[9],以GAPDH(1:10 000)为对照,PCNA(1 ∶800)、CyclinD1(1 ∶800)及c-Myc(1 ∶1000)为一抗,Western blot 检测,凝胶成像系统拍照,ImageJ2x 软件分析各组细胞中各目的蛋白(PCNA、CyclinD1、c-Myc)及GAPDH 的灰度值,以各目的蛋白灰度值/GAPDH 灰度值的比值分别代表各目的蛋白相对表达量。
1.3.8 Western blot 检测胃癌细胞PI3K/Akt 通路激活情况
取对数生长期的胃癌细胞(HGC-27、NCIN87),按照1×104/孔接种于6 孔板中,分组同1.3.5。 参考文献[9], PI3Kp85(1 ∶1000)、PI3Kp85(phospho Y607)(1 ∶500)、Akt(1 ∶1000)及AKT(phospho T308)(1 ∶800)为一抗,Western blot 检测各 组 胃 癌 细 胞 中 PI3Kp85、 PI3Kp85 ( phospho Y607)、Akt 及AKT(phospho T308)的相对表达量,评价各组细胞PI3K/Akt 通路激活情况。
1.4 统计学方法
GraphPad Prism 6.0 进行数据统计及绘图,所有实验数据重复3 次,数据以平均数±标准差(±s)表示,多组间比较利用单因素方差分析(One-way ANOVA),组间两两比较采用LSD-t检验。 以P<0.05 表示差异有统计学意义。
2 结果
2.1 LAMC2 在胃癌细胞中的表达
TCGA 及GSE122530 数据联合分析发现,9 个基因与细胞增殖相关,其中LAMC2 上调倍数最大(图1A),为此,LAMC2 为研究的候选基因。 胃腺癌是胃癌主要病理表现形式[1-3],利用UALCAN 及Kaplan Meier plotter 数据库分析发现,LAMC2 在胃腺癌中的表达显著升高(P<0.01),见图1B。LAMC2 表达与胃腺癌的分期(P<0.01)、分级(P<0.01)及生存密切相关(P<0.05),如图1C ~1E。Western blot 检测发现,胃癌细胞中(HGC-27、NCIN87、SNU-1)中LAMC2 的表达显著高于GES-1 细胞(F=93.780,P=0.000),如图1F、1G。 其中,HGC-27 细胞中LAMC2 表达量最低,NCI-N87 细胞中LAMC2 表达量最高,同时,参考文献[11-12]及中国科学院典型培养物保藏委员会细胞库及本实验室胃癌细胞种源保藏情况,后续实验选用HGC-27 及NCI-N87 细胞进行研究。
2.2 LAMC2 在si-LAMC2 组中胃癌细胞中的表达
Western blot 检测发现,在HGC-27 细胞中,si-NC 组中LAMC2 的表达与Control 组无显著变化(t=0.379,P=0.724);si-LAMC2-1#、si-LAMC2-2#胃癌细胞中LAMC2 的表达均显著低于si-NC 组(t=6.774、16.290,P=0.002、0.000);与si-LAMC2-1#比较,si-LAMC2-2#中LAMC2 蛋白表达显著降低(t=13.610,P=0.000),如图2A 所示。 在NCI-N87 细胞中,得到类似的结果。 同时,在HGC-27 及NCIN87 细胞中,si-LAMC2-2#具有更高的抑制效率,后续实验采用si-LAMC2-2#构建LAMC2 敲减胃癌细胞模型。 如图2 所示。
2.3 LAMC2 对胃癌细胞增殖的影响
HGC-27 细胞中,si-NC 组细胞EdU 阳性率与Control 组无显著差异(t=1.549,P=0.196);si-LAMC2 组细胞EdU 阳性率较si-NC 组显著减少(t=6.540,P=0.002)。 NCI-N87 细胞中,si-NC 组细胞EdU 阳性率与Control 组无显著差异(t=0.126,P=0.906);si-LAMC2 组细胞EdU 阳性率较si-NC 组显著降低(t=8.352,P=0.001)。 以上暗示抑制LAMC2 后,可显著抑制胃癌细胞增殖。 见图3,表1。
表1 各组EdU 阳性细胞比例(±s)Table 1 Edu-positive cells rate in each group

表1 各组EdU 阳性细胞比例(±s)Table 1 Edu-positive cells rate in each group
注:HGC-27 细胞中,与阴性对照组比较, **P<0.01;NCI-N87 细胞中,与阴性对照组比较, ##P<0.01。Note.In HGC-27 cells, compared with si-NC group, **P<0.01.In NCIN87 cells, compared with si-NC group, ##P<0.01.
组别Groups HGC-27 EdU 阳性率(%)Edu positive cell rate NCI-N87 EdU 阳性率(%)Edu positive cell rate空白对照组Control group 71.12±6.55 66.34±6.56阴性对照组si-NC group 63.00±6.08 65.33±6.43 LAMC2 敲减组si-LAMC2 group 30.67±6.03** 25.67±5.13##F 35.280 43.380 P 0.000 0.000
2.4 LAMC2 对胃癌细胞克隆形成能力的影响
通过细胞克隆数量检测分析:HGC-27 细胞中,si-NC 组细胞克隆数与Control 组比较,无显著变化(t=0.519,P=0.631);与si-NC 组比较,si-LAMC2组较si-NC 组,细胞克隆数显著减少(t=11.420,P<0.01)。 NCI-N87 细胞中,si-NC 组细胞克隆数与Control 组比较,无显著变化(t=0.484,P=0.654);si-LAMC2 组细胞克隆数较si-NC 组,显著降低(t=12.760,P<0.01)。 见图4,表2。
表2 各组细胞克隆数量(±s)Table 2 Number of cell clones in each group
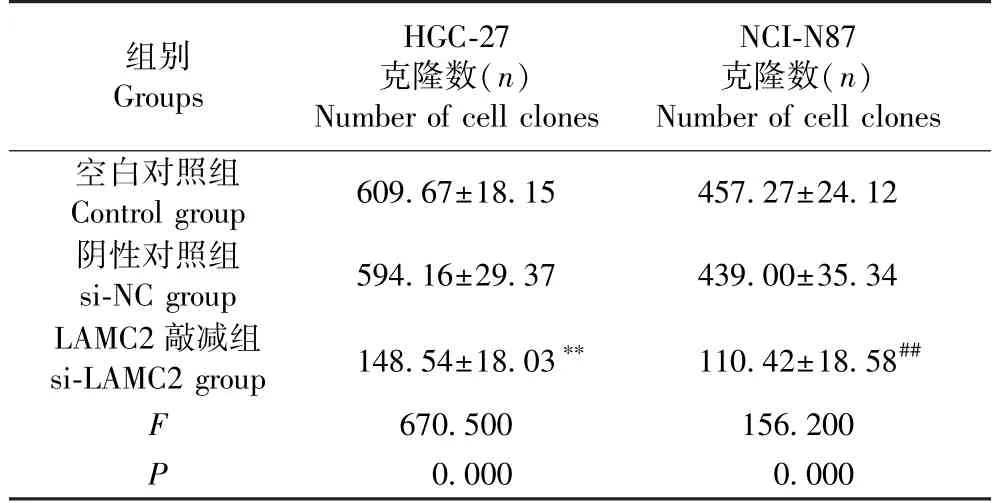
表2 各组细胞克隆数量(±s)Table 2 Number of cell clones in each group
注:HGC-27 细胞中,与阴性对照组比较, **P<0.01;NCI-N87 细胞中,与阴性对照组比较, ##P<0.01。Note.In HGC-27 cells, compared with si-NC group, **P<0.01.In NCIN87 cells, compared with si-NC group, ##P<0.01.
组别Groups HGC-27克隆数(n)Number of cell clones NCI-N87克隆数(n)Number of cell clones空白对照组Control group 609.67±18.15 457.27±24.12阴性对照组si-NC group 594.16±29.37 439.00±35.34 LAMC2 敲减组si-LAMC2 group 148.54±18.03** 110.42±18.58##670.500 156.200 P 0.000 0.000 F

图4 克隆形成能力检测胃癌细胞增殖Figure 4 Proliferation of gastric cancer cells detected by clone formation ability
2.5 LAMC2 对胃癌细胞增殖蛋白表达的影响
Western blot 检测发现:HGC-27 细胞中,Control组PCNA、CyclinD1 及c-Myc 的表达分别为(0.58±0.05)、(0.68 ± 0.03)、 (0.66 ± 0.03), si-NC 组CyclinD1、PCNA 及c-Myc 的表达分别为(0.59±0.02)、(0.67±0.03)、(0.65±0.03),si-LAMC2 组CyclinD1、PCNA 及c-Myc 的表达分别为(0.35±0.02)、(0.26±0.01)、(0.32±0.04),与si-NC 组比较,si-LAMC2 显著抑制CyclinD1(t=27.630,P<0.01)、PCNA(t=11.340,P<0.01)及c-Myc(t=11.340,P<0.01)的表达。 NCI-N87 细胞中得到类似的结果。 见图5。

注:HGC-27 细胞中,与阴性对照组比较, **P<0.01;NCI-N87 细胞中,与阴性对照组比较, ##P<0.01。图5 Western blot 检测细胞增殖相关蛋白表达Note.In HGC-27 cells, compared with si-NC group, **P<0.01.In NCI-N87 cells, compared with si-NC group, ##P<0.01.Figure 5 Expression of proliferation-related proteins detected by Western blot
2.6 LAMC2 对胃癌细胞PI3K/Akt 通路激活的影响
如图6 所示,Western blot 检测发现:HGC-27 细胞中,Control 组PI3Kp85(phospho Y607) 及Akt(phospho T308)的表达分别为(0.66±0.02)、(0.56±0.04);si-NC 组PI3Kp85(phospho Y607)及Akt(phospho T308)的表达分别为(0.65±0.01)、(0.54±0.06);si-LAMC2 组PI3Kp85(phospho Y607)及Akt(phospho T308)的表达分别为(0.24±0.03)、(0.18±0.04),与Control 组比较,si-NC 对PI3Kp85(phospho Y607) (t=1.331,P=0.254) 及Akt(phospho T308)(t=0.308,P=0.773)的表达无显著影响。 与 si-NC 组 比 较, si-LAMC2 显 著 抑 制PI3Kp85(phospho Y607)(t=20.570,P<0.01)及Akt(phospho T308)(t=8.437,P<0.01)的表达显著降低。 NCI-N87 细胞中得到类似的结果。

注:HGC-27 细胞中,与阴性对照组比较, **P<0.01;NCI-N87 细胞中,与阴性对照组比较, ##P<0.01。图6 Western blot 检测胃癌细胞中p-PI3K、p-Akt 表达Note.In HGC-27 cells, compared with si-NC group, **P<0.01.In NCI-N87 cells, compared with si-NC group, ##P<0.01.Figure 6 Expression of p-PI3K and p-Akt in gastric cancer cells detected by Western blot
3 讨论
胃癌是常见恶性消化道肿瘤之一,是引起全球范围内癌症相关死亡的主要恶性肿瘤,严重影响人类的身体健康和生活质量[1,13-14]。 我国是胃癌发病率较高的国家之一,约占全球病例的40%[12]。 手术切除和/或化疗是胃癌目前临床主要治疗策略,但由于胃癌确诊时已处于中晚期,导致胃癌患者5 年总生存率仍低于20%,并出现远端转移,预后较差[15-17]。 因此,深入探讨胃癌发生及进展的分子机制,筛选胃癌早期诊断靶标,对胃癌患者的诊治均具有重要意义。
LAMC2 是laminins 家族成员,作为Ln-332 的γ2 亚基,参与细胞增殖、侵袭、粘附及迁移等生物学的过程[18]。 但越来越多的研究发现,LACM2 单亚基与肿瘤的发生及进展关系密切[5]。 LAMC2 在喉癌中的表达显著升高,其表达量与喉癌患者的TNM分期、淋巴结转移、分化程度和总生存期相关,LAMC2 可显著促进喉癌细胞增殖[19]。 在卵巢癌中,LAMC2 的表达较癌旁组显著升高,抑制LAMC2的表达显著降低卵巢癌细胞的增殖及侵袭;作为miR-5580-3p 的靶基因,LAMC2 的表达可被miR-5580-3p 显著抑制[20]。 阴茎鳞状细胞癌患者肿瘤组织及血清中LAMC2 的表达均显著升高,LAMC2 可影响细胞的迁移、侵袭和EMT,进而促进肿瘤进展,LAMC2 可作为阴茎鳞状细胞癌潜在的诊治靶标[21]。 LAMC2 在口腔鳞状细胞癌中的表达显著升高,沉默LAMC2 可抑制口腔鳞状细胞癌细胞增殖,促进细胞凋亡,上调N-cad、vimentin,下调E-cad 蛋白表达,抑制上皮间质转化(Epithelial-mesenchymal transition,EMT)过程[22]。 多组学联合分析发现,LAMC2 在多种肿瘤的表达显著上高,LAMC2 的表达不利于泛癌的临床预后,并跟多种肿瘤免疫浸润相关[23]。 课题组前期研究发现,抑制LAMC2 后,胃癌细胞的侵袭、迁移能力被显著抑制[9]。 本研究首先通过TCGA、GEO 及介导细胞增殖相关基因联合分析筛选影响胃癌增殖的相关差异表达的候选基因,结果发现LAMC2 在胃癌中的表达显著升高,与胃癌患者的分级、分期及生存等临床病理相关;体外实验分析发现,LAMC2 的表达与胃癌细胞的增殖关系密切。
磷脂酰肌醇3-激酶(Phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(Portein kinase B,PKB)信号通路在胃癌、肝癌、肺癌等肿瘤中均被显著激活,参与肿瘤的发生及进展[24]。 PI3K/Akt 通路激活与肿瘤细胞的发生、增殖、凋亡、侵袭及转移、EMT、免疫微环境和耐药密切相关,该通路抑制剂可显著抑制肿瘤的进展[25-26]。 PI3K/Akt 通路可促进CyclinD1、p21、PCNA、c-Myc 等相关蛋白的表达,继而促进细胞增殖[27-29]。 LAMC2 可通过激活PI3K/Akt 通路促进口腔鳞状细胞癌中肿瘤干细胞的侵袭及迁移,进而导致肿瘤的增殖及复发[30];LAMC2 可通过integrinβ1/FAK/Src 激活AKT 促进喉鳞状细胞癌细胞增殖、侵袭和迁移[31];LAMC2 可通过EGFR/ERK1/2 通路激活Akt,导致胰腺导管癌的进展[32];LAMC2 可激活PI3K/Akt 通路促进卵巢癌细胞增殖,抑制其对吉西他滨的敏感性[33]。 以上研究说明LAMC2 可通过直接或者间接激活PI3K/Akt 通路,参与肿瘤的进展。 本研究检测发现,抑制LAMC2的表达后,胃癌细胞中PI3K/Akt 通路被显著抑制,降低PCNA、CyclinD1 及c-Myc 等细胞增殖等相关蛋白的表达,抑制胃癌细胞增殖,初步说明,LAMC2可通过激活PI3K/Akt 促进胃癌细胞增殖。
综上所述,初步说明LAMC2 在胃癌中的表达显著上调,与胃癌的分期、分级及生存等临床组织病理相关,LAMC2 可通过激活PI3K/Akt 通路促进细胞增殖。 但本研究仅局限于细胞水平,后续还需利用动物及临床水平深入研究LAMC2 与胃癌细胞增殖的关系及其影响PI3K/Akt 的具体作用机制。

