基于临床、影像组学开发并验证用于预测肺磨玻璃结节浸润性的Nomogram模型*
包陈政任 张 榕 陈新杰 刘子蔚 胡秋根,*
1.南方医科大学顺德医院附属陈村医院(佛山市顺德区第一人民医院附属陈村医院)放射科 (广东 佛山 528313)
2.南方医科大学顺德医院(佛山市顺德区第一人民医院)放射科 (广东 佛山 528308)
肺癌是全球癌症发病率第二、死亡率最高的肿瘤,其中肺腺癌是最常见的病理组织学类型[1]。根据2021年WHO肺肿瘤最新分类,将肺腺癌分为腺体前驱病变和浸润性肺腺癌,其中前者包括不典型腺瘤样增生(atypical adenomatous hyperplasia,AAH)和原位癌(adenocarcinoma in situ,AIS),后者包括微浸润性肺腺癌(minimally invasive adenocarcinoma,MIA),浸润性肺腺癌(invasive nonmucinous adenocarcinoma,IAC)[2]。不同病理组织学亚型,临床处理方式不同,腺体前驱病变预后良好,主要以随访监测为主[3]。MIA具有微浸润性,IAC患者的复发率较高,预后较差,两者通常采用肺叶切除术治疗[4-6],因此,术前区分腺体前驱病变与浸润性肺腺癌可以帮助临床医生对肺磨玻璃结节(ground glass nodule,GGN)进行评估,以改善临床决策并避免过度治疗或治疗不足。
影像学特征(如分叶征、毛刺征、空气支气管征、胸膜牵拉征、月牙征[7]、微血管穿行征等)与GGN的浸润性有关[8-9],这些都为主观特征,个人诊断水平及临床经验对GGN的评估存在差异性,并且对于较小的GGN,影像征象不显著。影像组学是指从影像图像中提取大量图像特征的高通量,并可以通过机器学习方法,以量化肿瘤组织的特征,并提供肿瘤详细和全面的影像组学特征[10-11]。与传统的生物标志物相比,基于影像组学是三维特征,图像采集过程易于执行,无创且成本低[12]。一些研究表明,基于影像组学的特征通过使用不同的医学成像方式,如:CT,磁共振成像(MRI)和正电子发射断层扫描(PET-CT)来区分肿瘤亚型的价值[13-16]。
本研究的目的是探讨基于CT影像组学特征区分腺体前驱病变与浸润性肺腺癌的能力,并开发一种结合CT影像组学和临床放射学特征的Nomogram图,以提供个性化、术前评估GGN患者的无创预测工具。
1 资料和方法
1.1 临床资料回顾性收集在南方医科大学顺德医院2018年5月2022年7月经手术后的219例GGN患者临床、影像及病理资料。
纳入标准:GGN<30mm;术前常规做胸部CT检查;具有完整的影像、临床及病理资料。排除标准:图像显示不清,病理不明确;术前经过肺结节治疗(如放化疗、靶向药物等肿瘤相关性治疗);存在其他肿瘤患者。该研究得到了南方医科大学顺德医院医学伦理委员会批准。
1.2 图像采集所有患者都进行全肺CT扫描,扫描仪器为Toshiba Aquilion Prime 80排、Siemens Smoatom Definition AS 64排和Siemens Smoatom Definition Flash 64排多层螺旋CT扫描仪。扫描方式:所有患者扫描前进行呼吸训练,深吸气后屏住气进行全肺扫描。扫描参数如下:管电压:120KV,管电流:250~300mA,FOV:350~400mm,螺距:0.81.0,准直:0.6×128,重建厚度:0.6mm~1mm,扫描结束后进行图像多平面重建,并将图像传输至PACS系统。
1.3 图像分析及影像组学特征提取由两位具有15年影像诊断经验的高级职称医师进行双盲法阅片,并记录肺结节的影像学特征,如GGN的大小、GGN的密度,分叶征、胸膜牵拉征、毛刺征、微血管穿行征、空泡征、空气支气管征、月牙征,遇到分歧时,由第三位具有20年影像诊断经验的高级职称医师进行阅片,协商一致方式解决。
肺结节靶区勾画由具有15年影像诊断经验的医师使用深睿软件(https://keyan.deepwise.com/login)进行感兴趣区(volume of interesting,VOI)半自动勾画,使用方法如下:将影像图像(DICOM格式)传输至深睿软件系统,并在肺结节每个层面沿边缘进行勾画,避开血管、支气管、心脏、胸膜等区域,并由另一位具有20年影像诊断经验的高级职称医师进行确认,肺结节感兴趣区勾画后,使用开源PyRadiomics软件包从每个结节中提取了总共2107个影像组学特征。
1.4 影像组学模型构建按照7:3的比例随机分为训练组和验证组。为了避免模型拟合过度和提高模型的泛化性,我们对提取的影像组学特征进行了由粗到细的特征筛选。首先,使用组内及组间相关系数法进行特征筛选;其次,进行独立样本T检验或秩和检验,选择两组之间的显著特征,以P<0.05为显著,保留1381个显著特征。随后,进行Pearson或Spearman相关性分析,以降低特征之间冗余度,删除相关性大于0.6的特征,最终保留45个低相关的特征。最后,为了防止模型出现过度拟合的现象,我们利弹性网络用(Elastic net)-logistic算法对重要建模特征进行筛选,具体公式如下:
Note:λ控制惩罚项的大小,α控制两种误差项(L1和L2)的权重。
进一步得到影像组学特征的最优子集,此为AAH/AIS和MIA/IAC的评估构建影像组学特征。每个GGN的影像组学得分(Radscore)是通过所选特征的线性组合计算的,这些特征由各自的系数加权,并根据Logistic回归算法,建立最终的影像组学模型(Radiomic model)(图1A、C)。
1.5 临床特征筛选及模型构建采用单因素Logistic回归筛选P<0.05的临床-影像特征,再根据赤池信息量准则(akaike information criterion,AIC),通过向前/向后逐步Logistic回归得到AIC最小的临床模型。
1.6 构建联合模型及模型性能评估采用Logistic回归算法,将重要的临床特征和Radscore整合,构建临床-放射组学联合模型(combined model),并使用ROC曲线评估模型性能。
1.7 统计分析计量资料符合正态分布采用()表示,计数资料采用百分比(%)表示。连续变量采用独立样本T检验或秩和检验,分类变量采用卡方检验。采用受试者工作特征(ROC)曲线下面积(AUC)评价模型的性能。所有统计分析均使用R语言(4.2.1)软件进行。P<0.05为差异具有统计学意义。
2 结果
2.1 临床资料和放射学特征比较本研究纳入了南方医科大学顺德医院的219例单发GGN患者的术前资料,其中男性52例(23.74%),女性167例(76.26%)。两组之间性别、年龄、空泡征、空气支气管征、瘤肺边界、微血管穿行、GGN密度、GGN位置均无统计学意义(P>0.05),月牙征、分叶征、毛刺征、胸膜牵拉征、GGN长度和CT值具有统计学意义(P<0.05)(表1)。
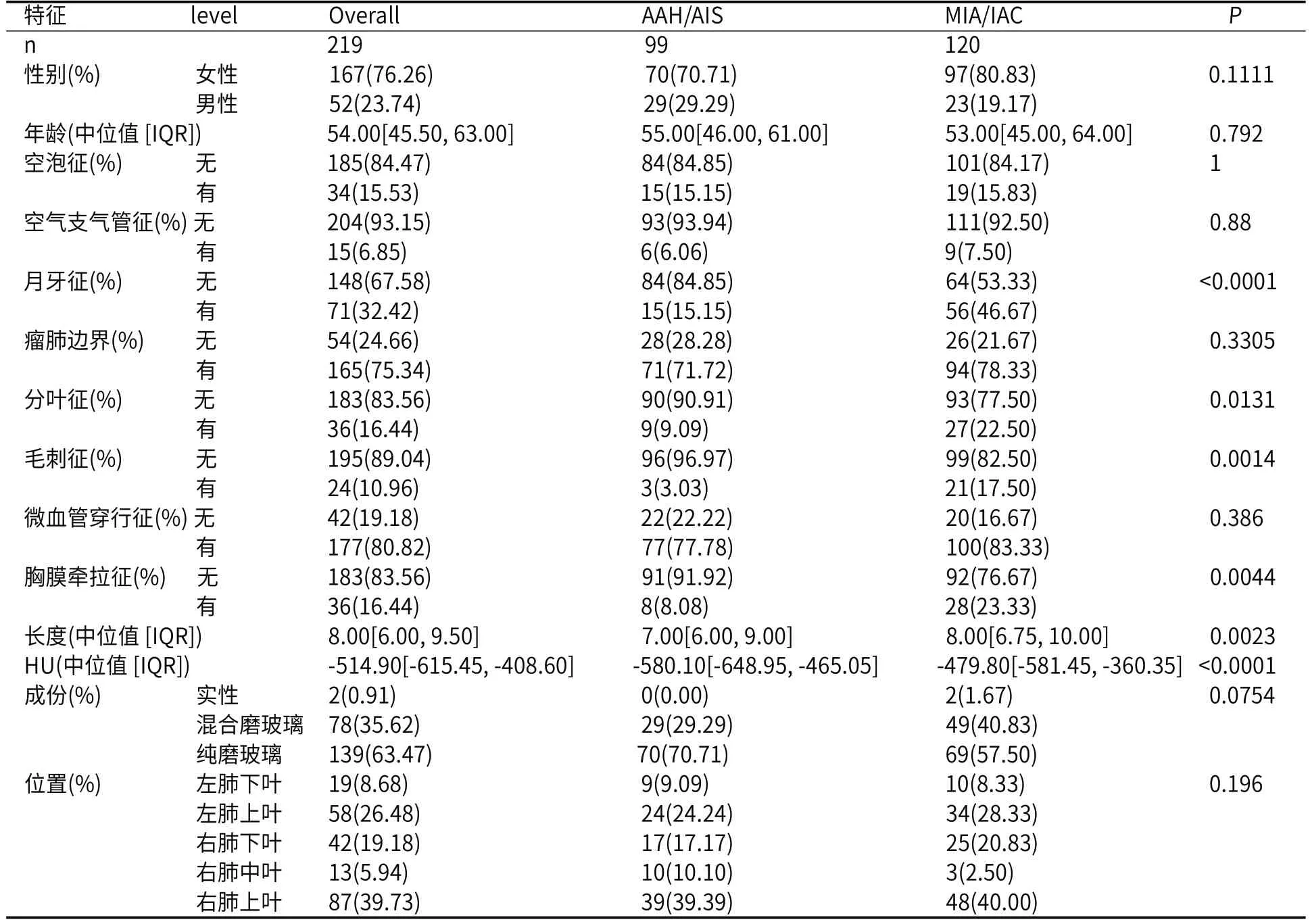
表1 两组GGN患者影像特征及临床资料比较
2.2 影像组学特征筛选和影像组学得分建立经过从粗到细的特征筛选,共获得9个非零系数特征,根据公式计算每位患者的Radscore,(Radscore=0.1689×log.sigma.4.0.mm.3D_glszm_SmallAreaEmphasis+0.0321×log.sigma.5.0.mm.3D_glszm_SmallAreaEmphasis+0.1981×lbp.3D.k_firstorder_Skewness-0.0812×lbp.2D_firstorder_10Percentile-0.1195×bp.3D.k_glcm_Imc2-0.0896×log.sigma.2.0.mm.3D_firstorder_90Percentile-0.0770×log.sigma.2.0.mm.3D_glszm_SmallAreaLowGrayLevelEmphasis-0.0579×square_glszm_GrayLevelNonUniformityNormalized-0.0632×wavelet.LLL_gldm_LargeDependenceLowGrayLeve lEmphasis),并构建最终的影像组学模型(Radiomic model),模型在训练组中的AUC为0.806(95% CI:0.7350.874),验证组中AUC为0.814(95% CI:0.7030.913)(图2A、B)。
2.3 临床模型的建立由单因素Logistic分析可知,GGN长度,CT值、毛刺征、月牙征、胸膜牵拉征等临床和影像学特征与肺结节病理侵袭性显著相关(P<0.05)。然后,通过基于AIC的向前/向后逐步回归分析,得到最优临床模型(clinical model)(表2)。临床模型在训练组中的AUC为0.753(95% CI:0.6740.828),验证组中模型的AUC为0.742(95% CI:0.6210.851)(图2A、B)。

表2 基于AIC准则的逐步回归分析结果
2.4 联合模型建立、性能评估及临床应用结合临床-影像独立危险因素和radscore,运用Logistics算法构建临床-放射组学联合模型(combined model)。Combined model模型在训练组中的AUC为0.843(95% CI:0.8040.898),验证组中AUC为0.869(95%CI:0.8480.927)(图2A、B),这表明combined model模型预测GGN的病理浸润性比radiomic model、clinical model具有更好的鉴别性能。同时采用Nomogram图(图2C)可视化该模型,nomogram图包括radscore和CT值、胸膜牵拉征、月牙征。校准曲线显示预测概率与实际概率关系密切(图3A、B),表明预测的可靠性高。临床决策曲线(DCA)表明,使用combined model预测GGN病理浸润性比其它两个模型具有更多收益。
3 讨论
近年来,肺磨玻璃结节的检出率大幅提高,但其良恶性鉴别仍存在较大的困难,特别是对浸润性的评估仍然是一个难点。为了更精准地评估肺磨玻璃结节的浸润性,并能用于个体化术前预测,本研究基于临床、影像组学开发并验证了一个包含影像组学特征和临床-放射学特征的nomogram模型,结果表明,该模型的鉴别性能良好,可为术前准确评估GGN的病理浸润性提供一个无创、迅捷工具,有利于临床对GGN治疗及管理。
肿瘤的浸润性可以引起GGN形态学的改变,如肿瘤的长度、CT值、分叶征、毛刺征等,我们的nomogram最终纳入了9个影像组学特征和3个临床-放射学特征,在我们的研究中,CT值、胸膜牵拉征、月牙征被证明是预测GGN病理浸润性的独立危险因素。AAH和AIS是以纯磨玻璃结节为主,随着浸润性的增加,GGN的密度也逐渐的增加,IAC的平均CT值最高,我们的研究与She[17]的一致,表明平均CT值的增加反应了GGN的异质性增加,实质成分的增加表明肿瘤向浸润性转变的可能性大[18]。IAC中胸膜牵拉征出现频率高与其内部实性成分收缩相关,Lee等[19]的研究显示分叶和胸膜凹陷可以鉴别浸润性和浸润前病变,本研究与Huang[20]等研究相似。俞慧波[7]等研究发现,月牙征是预测纯磨玻璃肺结节浸润性的重要征象,其病理是次级小叶间隔在肺内分布很多,组织学上是横向排列的疏松结缔组织,早期肺腺癌难以突破次级小叶间隔,肿瘤细胞从间隔不完整的肺组织附壁生长,受到小叶间隔阻挡及内部的收缩力牵拉形成凹陷,浸润性腺癌对周围间质、脉管等浸犯较腺体前驱病变更加显著,此征象对GGN的浸润性评估具有较高特异性,需在CT横轴面、冠状面及矢状面多平面重组图像上连续观察,在我们的研究中,月牙征为预测GGN的独立危险因素,并纳入了nomogram模型中。肿瘤大小一直是评估GGN浸润性的一个重要的征象,但是在我们的研究中不是独立危险因素,我们分析其原因可能是因为我们研究的GGN较小,测量存在误差,也有研究认为,鉴别浸润前肺腺癌与浸润性肺腺癌的诊断阈值尚无统一定论。部分学者指出,瘤肺边界在AAH/AIS组和MIA/IAC组间无显著差异[21-22],在本研究中,瘤肺边界不是作为评估GGN病理浸润性的独立危险因素,后续需进一步扩大样本来证实瘤肺边界在与GGN病理浸润性之间的关系。空泡征、空气支气管征、毛刺征及微血管穿行征不是预测GGN病理浸润性的独立危险因素,GGN都是圆形、类圆形,因此存在毛刺征较少,其在预测GGN浸润性存在一定的商议,也有研究认为[23-24],空泡征、空气支气管征和毛刺征不足以作为GGN浸润性的特异性征象。有研究表明[25],GGN内血管的发生率主要与其大小及结节与胸膜的距离有关,而与其病理性质无关,早期肺腺癌中微血管的存在,不是其浸润性的一个特异特征。
本研究中影像组学模型由9个影像学特征组成,包括纹理特征及一阶特征,纹理特征描述了VOI内像素强度的空间关系,并进一步分为灰度区域大小矩阵(GLSZM,n=4)、灰度共生矩阵(GLCM,n=1)、灰度依赖矩阵(GLDM,n=1),它们都是二阶及高级纹理特征,这些特征能够反应图像体素之间空间排列关系,既往有研究表明纹理特征对GGN轮廓的变化表现最稳定,可用于区分浸润前病变和浸润性肺腺癌[26-27],CT像素灰度强度与GGN浸润性具有相关性,像素越高,表明纹理的异质性越大。Firstorder是一阶特征,其描述VOI的强度直方图特征,在我们的研究中存在4个一阶特征,表明其对GGN的浸润性敏感度较高。利用ROC曲线下面积评估三个模型的性能,联合模型预测GGN病理浸润性具有更好的鉴别性能,在训练组中AUC为0.843(95% CI:0.804~0.898),验证组中AUC为0.869(95% CI:0.848~0.927),我们使用nomogram图对模型的变量进行可视化,从而可以协助临床医生更易理解模型,并确定是否需要手术治疗或随访监测,为诊断GGN是否存在浸润性提供辅助参考意见。
本研究具有一定的局限性。首先,本研究中的GGN来自三个不同的扫描仪器,由于扫描参数不同,可能会存在潜在的影响。其次,对GGN进行感兴趣区勾画,部分血管、支气管等不可避免的包括在内,从而对影像组学特征提取可能存在一定影响。第三,本研究为回顾性研究,收集数据具有一定偏倚。
综上所述,本研究开发并验证了一个nomogram模型,结合了临床及影像组学特征,可以有效评估GGN的病理浸润性,nomogram模型可以作为指导临床医生个体诊断和选择最佳干预措施的潜在工具。

