Pickering乳液聚合法原位制备杂化乳胶粒子
谢志扬,孙冠卿,刘 仁
(江南大学 化学与材料工程学院/合成与生物胶体教育部重点实验室, 江苏 无锡 214122)
1 前 言
近年来,设计和制备纳米有机-无机杂化粒子已受到越来越多的关注。有机-无机杂化乳胶粒子可以将有机粒子和无机粒子的优异性能复合,使聚合物的性能得到大幅提升,在涂料[1]、电子[2]、催化[3]和医疗[4]等领域具有广泛的应用前景。
杂化乳胶粒子可以通过异相聚合[5-6]、静电吸附[7]和逐层自组装[8-9]等方法制备。目前,异相聚合是制备杂化乳胶粒子最常用的方法,易于进行工业化放大生产。在该方法中,通过悬浮聚合[10]、乳液聚合[11-12]和细乳液聚合[13-14,37],在无机粒子存在的条件下以水相为连续相进行聚合来制备有机-无机杂化乳胶粒子,可以得到具有核壳型[15-16,38]、树莓型[17-19]、凹陷型[20]等各种形态的杂化乳胶粒子。然而,通过细乳液聚合等方法制备杂化粒子需要用到大量表面活性剂和强力分散设备,这一方面会降低涂层的耐水性能,同时也提高了生产成本。因此,近年来以固体纳米粒子来代替小分子表面活性剂或其他两亲性聚合物进行乳液聚合,即Pickering乳液聚合,可以大幅降低表面活性剂的使用,制备出结构可控的有机-无机杂化乳胶粒子。
固体颗粒用于稳定乳液液滴的现象首先由Ramsden[21]和Pickering[22]在上世纪初进行报道,之后的研究者因而使用Pickering稳定化这一术语来描述固体粒子稳定的油水分散体系。1923 年,Finkle等[23]指出,Pickering乳液的稳定性高度依赖于固体粒子的润湿性能。固体粒子只有被两相同时润湿才能有效地稳定两相界面。固体粒子在两相界面上的接触角(θ)是影响分散体系稳定性的重要因素,决定了Pickering稳定性和乳液类型。迄今为止,各种各样的固体粒子,如二氧化硅粒子[24]、Laponite粘土[25]、磁性粒子[26]、纳米纤维素[27]和氧化石墨烯片[28]等已被成功地用于稳定乳液液滴,并通过Pickering乳液聚合来制备杂化乳胶粒子。Percy等[29]报道了二氧化硅纳米粒子和4-乙烯基吡啶在水相中的自由基聚合,发现分散在聚(4-乙烯基吡啶)基质中的二氧化硅纳米粒子可以形成有机-无机杂化乳胶粒子。如果聚合体系没有二氧化硅纳米粒子,聚合体系会快速凝聚,从而清楚地表明了二氧化硅纳米粒子在聚合体系中发挥了稳定作用。Tissot等[30]报道了一种合成二氧化硅包覆的乳胶粒子的制备途径,该技术途径分为两步,首先将γ-甲基丙烯氧基丙基三甲氧基硅烷(MPS)分子溶入聚苯乙烯乳胶粒子中,然后通过水溶液中的四乙氧基硅烷在胶粒表面水解形成二氧化硅层,成功合成了具有核壳结构的杂化乳胶粒子。Chen等[18]在2005 年报道了由二氧化硅纳米颗粒包裹的聚甲基丙烯酸甲酯乳液的合成,他们使用了一种阳离子辅助单体2-甲基丙烯酰氧基乙基三甲基氯化铵(MTC),认为带负电荷的二氧化硅粒子和带正电荷的MTC之间的静电相互作用使二氧化硅纳米粒子锚定在乳胶粒子的表面。他们提出,经MTC 改性的二氧化硅颗粒在乳液聚合中起到稳定剂的作用。在某种程度上,MTC 调整了二氧化硅粒子的润湿性,以促进其在乳胶粒子表面的粘附。Bon等[31]通过Pickering乳液聚合,以甲基丙烯酸甲酯和甲基丙烯酸乙酯作为单体,用未改性二氧化硅纳米粒子作为Pickering乳液聚合的稳定剂,在不添加辅助单体、表面活性剂和阳离子引发剂的情况下合成了杂化乳胶粒子。研究表明,只有在pH 值为5.5附近,才能得到有机-无机杂化乳胶粒子。当使用苯乙烯或甲基丙烯酸正丁酯时,二氧化硅纳米粒子无法吸附在聚合物乳胶粒表面,会产生裸乳胶粒,而二氧化硅纳米粒子则大量残留在了水相中。因此,Pickering乳液聚合的反应机制和稳定机制可能与Pickering乳液的稳定机制是不同的[32]。迄今为止,对于Pickering乳液聚合的影响因素和聚合机制仍然缺乏系统的研究,以Pickering 乳液聚合制备杂化乳胶粒子仍然具有挑战性。
本研究使用溶胶凝胶法制备了直径为50 nm 的二氧化硅纳米粒子,将其以粉末形式和溶胶形式分别引入到甲基丙烯酸甲酯和苯乙烯的无皂乳液聚合体系中,用作Pickering乳液聚合的稳定剂,系统探讨了单体和引发剂种类、体系pH 值等因素对制备的杂化乳胶粒子形貌的影响。
2 实验材料与方法
2.1 主要原料和试剂
正硅酸四乙酯、氨水、无水乙醇、苯乙烯、过硫酸钾均为分析纯;苯乙烯(St)、甲基丙烯酸甲酯(MMA)为化学纯;2,2-偶氮二异丁基脒二盐酸盐(≥99.0%);超纯水。
2.2 样品制备
2.2.1 二氧化硅纳米粒子的制备 采用经典的Stöber法[33]制备二氧化硅纳米粒子。首先,将6 mL超纯水,120 mL无水乙醇和2 mL 氨水均匀混合,将其放置在室温下,300 rpm 的转速下搅拌5 min混合均匀。然后再向该混合液中加入5 mL TEOS,室温下反应5 h。然后将反应混合液使用乙醇进行离心、洗涤三次后加入去离子水,并通过旋蒸除去多余水分,即可得到二氧化硅纳米溶胶分散液,即二氧化硅溶胶。最后将该分散液旋蒸和抽滤分离,并通过真空干燥,得到固态二氧化硅粉末。
2.2.2 Pickering乳液聚合法制备二氧化硅杂化乳胶粒子 (a).以二氧化硅纳米粒子粉末作为Pickering稳定剂:称取0.5 g 二氧化硅粉末与30 mL超纯水混合均匀,滴加1 M HCl(aq)调节至所需pH值,然后将溶液转移至150 mL 三口烧瓶中搅拌均匀。加入1 g 单体(MMA 或者St)继续搅拌。称取0.02g KPS溶于1 mL 超纯水中,使之充分溶解。搅拌均匀后,通氮气30 min 除去氧气,向体系中加入引发剂KPS溶液,升温至65℃,聚合反应进行12 h。(b).以二氧化硅纳米粒子溶胶分散液作为Pickering稳定剂:称取40 g 二氧化硅粒子溶胶分散液(1 wt%)于150 mL三口烧瓶中,向体系中滴加1 M HCl(aq)调节至所需pH 值。称取0.05 g KPS溶于1 mL 超纯水中,使之充分溶解。向150 mL 三口烧瓶中加入1 g 单体继续搅拌,通氮气30min以除氧,加入引发剂KPS溶液,升温至65℃,聚合反应进行12 h。
2.3 测试及表征
使用电位及纳米粒度分析仪(ZetaPALS Zeta)进行二氧化硅的粒径及其粒径分布检测,原理是通过测定粒子在 90 °方向的散射光强,分析其时间相关函数得到相关数据。具体方法是将0.1 g二氧化硅纳米粒子分散在 10 mL水中,使之充分分散,并持续稀释,得到质量分数为0.1%的二氧化硅分散液。取2 mL 待测液加入到塑料比色皿中进行测试,每次测试时间为2 min,循环测试3次,最终得到粒径及其分布曲线,通过ZetaPALS Particles Sizing 软件进行数据拟合,得到二氧化硅粒径及其分布结果。
使用透射电子显微镜(JEM-2100plus,TEM)对二氧化硅纳米粒子的形貌进行表征。取10 mg二氧化硅粉末,将其分散在10 mL无水乙醇中,使之充分分散,得到0.1 wt%的分散液。将20 μL 分散液滴在300目纯铜碳膜上,待其自然晾干后,采用透射电子显微镜在200 kV、105 Pa真空度的条件下对其进行测试。
使用场发射扫描电子显微镜(S-480,SEM)表征乳胶粒子的形貌。取少量含有杂化乳胶粒子的分散液,用超纯水稀释至浓度小于1 wt%,将20 μL 分散液滴在硅片上,待其自然晾干。在测试之前,向样品上喷适量的金来增加其导电性,采用扫描电子显微镜在3 kV、10 μA 的条件下进行测试。
使用电位及纳米粒度分析仪(ZetaPALS Zeta)测定二氧化硅纳米粒子的Zeta电位。将二氧化硅纳米粒子溶胶分散液稀释至1.0 wt%,取1.5 mL 待测液加入到塑料比色皿中,分散液pH 值控制在3~9的范围内,每次测试时间为2 min,循环测试3次,最终得到纳米粒子的Zeta电位数值。
使用力学法全自动表面张力仪(K100C),通过DuNoüy环法测定反应单体与水之间的界面张力。取35.5 mL待测单体加入到玻璃样品容器中,通过调节升降按钮使铂金丝环悬停在液面上方,测量拉破液膜时的张力来测定界面张力;随后量取35.5 mL超纯水于玻璃容器中,使用相同方法测量水与空气之间的界面张力(即水的表面张力)。将15.4 mL 单体液体缓慢倾倒至装有超纯水的玻璃容器中,拉动铂金丝环测量单体与水两相间的界面张力,当连续五次测量的界面张力标准偏差小于2%时停止测试,界面张力数值通过KRÜSS ADVANCE软件计算得到。
3 结果与讨论
3.1 二氧化硅粒径分析
通过纳米粒度分析仪和TEM 对二氧化硅纳米粒子的粒径及其形貌进行表征,结果如图1所示。从通过动态光散射得到的粒径分布曲线可知,二氧化硅粒子的粒径为49 nm,而且粒径分布极窄。二氧化硅纳米粒子的TEM 图片也与纳米粒度仪的测试结果相符。

图1 二氧化硅粒子的粒径分布及TEM 图像(插图)Fig.1 Size distribution and TEM (inset) image of silica particles
3.2 Pickering乳液聚合—以粉末形式引入二氧化硅纳米粒子
3.2.1 体系pH 值对乳胶粒子形貌的影响 实际生产中若以固体粉末方式直接加料具有操作便利性,因此首先探究了以粉末形式将二氧化硅纳米粒子引入到聚合体系:使用二氧化硅纳米粒子粉末作为Pickering乳液聚合的稳定剂,MMA 作为反应单体,在pH 值 1.5到5范围内进行了Pickering乳液聚合。具体实验条件如表1所示。
根据蔡颖莹等[34]的研究,通过Stöber法制备得到的二氧化硅纳米粒子的Zeta电位数值与体系pH值有关,当pH 值为2时二氧化硅胶体粒子达到等电点,在pH 值低于或高于2时,二氧化硅粒子表面分别带正电和负电。因此,将聚合体系的pH 值调节至3以下进行实验。根据静电相互作用理论,当体系pH值小于2时,二氧化硅颗粒表面带有的正电荷能够促进其在初始MMA 乳胶上的吸附。而从图2(a)中可以看出,当pH=3.05时,只观察到裸露的PMMA 胶粒,并且在SEM 图像中观察到大量团聚的二氧化硅,说明粉末状的二氧化硅纳米粒子无法较好分散。当调节体系的pH 值至2以下,pH=1.83和pH=1.93时(图2(b)和2(c)),PMMA 大量团聚到一起,能看到一些裸露的PMMA 胶粒。当pH 值持续降低至1.54时,PMMA 胶粒相互粘结在一起,二氧化硅纳米粒子仍然没有吸附到乳胶粒表面 (图2(d))。从图2的实验结果可以看出,当调节体系的pH 值至二氧化硅等电点pH=2以下时依然无法促进二氧化硅粒子在聚合物颗粒表面的吸附。为了探究其原因,将二氧化硅纳米粒子分散在水中,测量二氧化硅溶胶在不同pH值下的Zeta电位数值,结果如图3所示。测得的Zeta电位数据显示,当pH=1时二氧化硅粒子的Zeta电位数值为-18.6 mV,此时二氧化硅粒子依然带负电荷,因此无法通过静电作用吸附在聚合物颗粒表面。此外,极低的pH 值可能会影响乳液聚合的动力学,导致聚合产物出现聚集。然而,在几乎所有的pH 值条件下,在电镜照片中均可观察到聚集的二氧化硅粒子,甚至在低pH 值下会影响聚合反应的进行。因此直接加入粉末态粒子虽然具有操作便利性,但是聚合体系的稳定性却难以得到控制。

图2 在(a)pH=3.05,(b)pH=1.83,(c)pH=1.93,(d)pH=1.54条件下进行Pickering乳液聚合得到产物的SEM 图像Fig.2 SEM images of latexes from Pickering emulsion polymerization carried out under the conditions of pH=3.05(a), pH=1.83(b),pH=1.93(c), and pH=1.54(d)
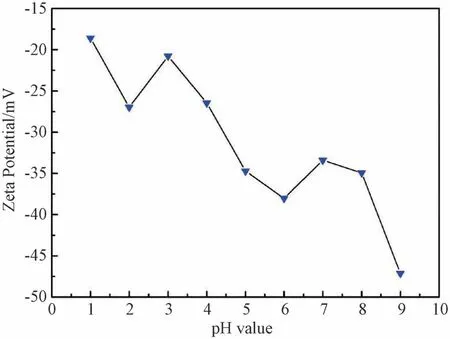
图3 二氧化硅溶胶在不同pH 值下的Zeta电位Fig.3 Zeta potential of silica sol at different pH values
3.2.2 阳离子引发剂对乳胶粒子形貌的影响 鉴于二氧化硅纳米粒子在整个pH 范围内均带负电荷,因此使用带正电荷的2 2-偶氮二异丁基脒二盐酸盐(AIBA)作为引发剂,以促成带负电荷的二氧化硅粒子静电吸附在聚合物颗粒的表面,形成杂化乳胶粒子。Schmid 等[35]使用AIBA 作为阳离子引发剂,通过Pickering乳液聚合成功制备了二氧化硅吸附的聚苯乙烯颗粒。因此本研究使用AIBA 作为引发剂、MMA 作为反应单体进行Pickering乳液聚合制备杂化粒子,实验条件如表2。从图4中可以看出,通过该法得到的产物均无法观察到其明显的杂化粒子结构,并且背景中仍然有大量的二氧化硅粒子团聚。AIBA作为阳离子引发剂,虽然带有正电荷,理论上可以通过静电吸附使二氧化硅纳米粒子吸附在乳胶粒表面,但是实验结果表明AIBA 也会导致二氧化硅纳米粒子的团聚,反而阻碍了杂化乳胶粒子的形成。
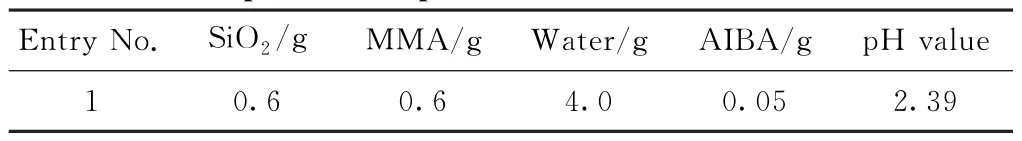
表2 AIBA作为引发剂的实验参数Table 2 Experimental parameters when AIBA as initiator.

图4 使用AIBA 作为引发剂进行Pickering乳液聚合得到的产物的SEM 图像Fig.4 SEM image of latexes from Pickering emulsion polymerization initiated by AIBA
3.3 Pickering乳液聚合—以二氧化硅纳米粒子溶胶作为稳定剂
根据上述实验结果,发现使用二氧化硅纳米粒子粉末进行乳液聚合时,二氧化硅的分散性很差,在SEM 图像中经常观察到大量二氧化硅团聚物,因此预先改善二氧化硅的分散性将有利于杂化粒子的合成,故而采用二氧化硅纳米粒子溶胶进行相应的聚合研究。
3.3.1 体系pH 值对乳胶粒子形貌的影响 配置质量分数为 1.0 wt% 的二氧化硅纳米粒子溶胶,在体系pH=2.7~10范围内进行了Pickering乳液聚合,具体实验条件如表3。
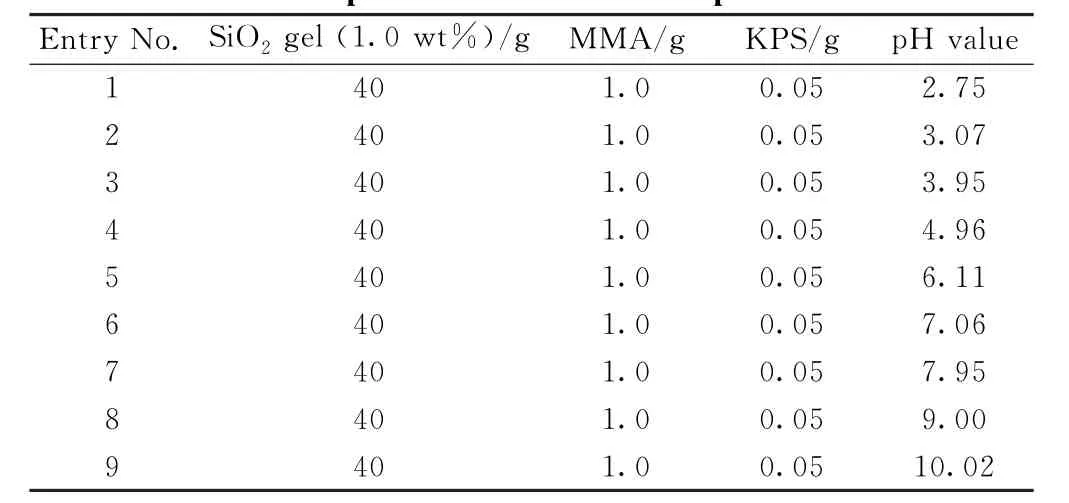
表3 不同pH 值条件下的Pickering乳液聚合实验参数(以二氧化硅纳米粒子溶胶作为稳定剂)Table 3 Pickering emulsion polymerization in the presence of silica nanoparticle sol at different pH conditions
从图5可以看出,只在一些乳胶粒表面有二氧化硅纳米粒子沉积,但是在一系列的pH 梯度下都无法观察到杂化粒子的产生。随着pH 值的增加,PMMA逐渐出现团聚倾向,最后粘附在一起,这说明在高pH值条件下MMA 的聚合动力学受到了影响。PMMA表面的二氧化硅覆盖率随着pH 值的增加有所增加,但是乳胶粒的形貌无法维持。虽然无法观察到杂化粒子的产生,但背景中的二氧化硅团聚体减少了,说明使用二氧化硅溶胶进行乳液聚合能够有效地改善二氧化硅粒子的分散性。
3.3.2 苯乙烯作为聚合单体 苯乙烯是乳液聚合的常用单体,在常见的乳液聚合物中广泛使用,因此研究苯乙烯作为反应单体探究它对于制备杂化乳胶粒子的影响,具有重要的意义。以二氧化硅溶胶为稳定剂进行Pickering乳液聚合,在不同pH 值2.8~9.0范围内进行聚合反应,实验条件如表4。
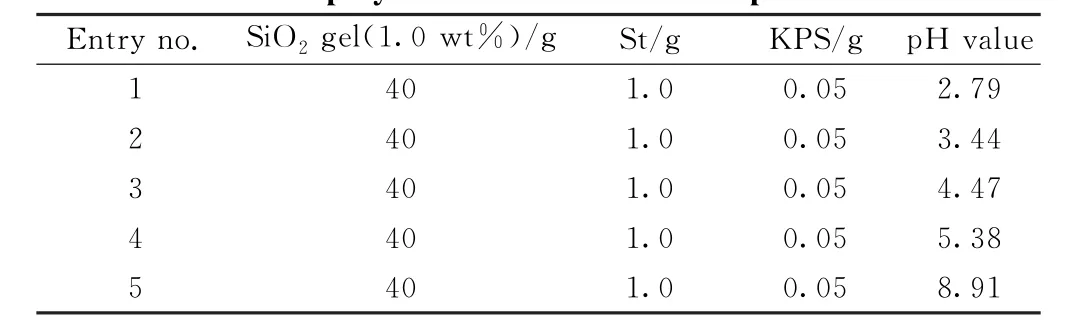
表4 在体系不同pH 值下苯乙烯Pickering乳液聚合的实验参数Table 4 Experimental parameters of styrene Pickering emulsion polymerization at different pH values
从图6可以看出,当体系pH 值过高(图6(e))或过低(图6(a)&(b))时,聚苯乙烯(PS)颗粒的表面都是光滑的,在pH=3.44和pH=5.38时,可以看到一些被二氧化硅包覆的PS粒子(图6(c)&(d))。而使用MMA 作为单体进行Pickering乳液聚合制备的乳胶粒子表面几乎没有二氧化硅粒子的吸附,说明分别使用苯乙烯与MMA 作为反应单体进行Pickering乳液聚合时所得到的产物形貌区别较大,推测可能与单体和水之间的界面张力的影响有关,因此需要分别对苯乙烯和MMA 与水之间的界面张力进行测定(表5)。根据吸附能理论公式(1):

表5 MMA和St分别与水之间的界面张力数据Table 5 Interfacial tension of MMA and St between water

图6 使用二氧化硅溶胶在体系不同pH 值下进行苯乙烯Pickering乳液聚合产物的SEM 图像:(a)pH=2.79,(b)pH=3.44,(c)pH=4.47,(d)pH=5.38,(e)pH=8.91Fig.6 SEM images of styrene Pickering emulsion polymerization latexes using silica sol at different pH.(a)pH=2.79, (b)pH=3.44, (c)pH=4.47, (d)pH=5.38, (e)pH=8.91
可以看出,固体粒子在两相界面上的吸附与粒子半径R、单体与水两相间的界面张力γOW及接触角θ有关[36]。而分别使用苯乙烯和MMA 作为反应单体进行Pickering乳液聚合时,用作Pickering乳液聚合稳定剂的二氧化硅纳米粒子粒径相同,因此单体与水两相间的界面张力对二氧化硅粒子在聚合物表面的吸附有着很大的影响。而通过表5中数据可以看出,苯乙烯与水之间的界面张力为31.7 mN/m,而MMA 与水之间的界面张力仅为13.3 mN/m,二氧化硅更容易吸附在苯乙烯聚合物颗粒的表面(图5(b)&(d))。同时,当二氧化硅分散在水中时其电负性较强,通过测量显示,pH=9 时的二氧化硅溶胶的Zeta 电位为-47.12 mV(图3),此时的二氧化硅粒子可以认为是亲水的。当pH=3 和pH=5 时二氧化硅在水中的Zeta电位值分别为-20.78 mV 和-35 mV,与二氧化硅粒子直接分散在水中时相比,二氧化硅粒子的电负性有所下降,此时二氧化硅粒子的疏水性有所增加,所以会有较多的二氧化硅可以出现在两相界面上,因此此时二氧化硅吸附在聚苯乙烯颗粒表面的几率也会提高。
4 结 论
本研究通过溶胶凝胶法成功制备了粒径均一的纳米二氧化硅粒子,并且将二氧化硅纳米粒子用于Pickering乳液聚合,以制备杂化乳胶粒子。研究发现,向聚合体系中直接加入二氧化硅粉末作为稳定剂,聚合体系中出现一定程度的团聚,且无法通过调节体系的pH 值和引入阳离子引发剂得到杂化乳胶粒子。当使用纳米二氧化硅溶胶作为稳定剂进行聚合,二氧化硅粒子的聚集体明显减少,由此证实了使用二氧化硅溶胶能够提高二氧化硅纳米粒子在水中的分散性。使用苯乙烯作为聚合单体、二氧化硅溶胶为稳定剂进行Pickering乳液聚合时,在体系pH 值为3~5的条件下能观察到部分PS颗粒表面吸附有二氧化硅纳米粒子,通过分别测量苯乙烯和甲基丙烯酸甲酯与水之间的界面张力得知苯乙烯与水之间的界面张力较大,二氧化硅纳米粒子的吸附会大幅降低两相之间的界面能,因此能促进有机-无机杂化胶粒的生成。以上研究表明,二氧化硅纳米粒子在聚合体系中的分散性会对Pickering乳液聚合产生积极影响,无机纳米粒子在水中的高分散性有利于杂化乳胶粒子的形成;并且反应单体与水间的界面张力也会影响无机纳米粒子在聚合物乳胶粒子表面的吸附,界面张力大的单体更有利于无机纳米粒子在聚合物乳胶粒表面的吸附。

