氰戊菊酯过度激活Ca2+/CaM/CaMKⅡ信号通路诱发线粒体损伤干扰TM3细胞睾酮合成
姚金玲,李廷兵,胡 静,万小榆,孔德营
(遵义医科大学 基础医学院生理学教研室,贵州 遵义 563099)
氰戊菊酯(fenvalerate,Fen)属Ⅱ型拟除虫菊酯类农药杀虫剂,可干扰男性的睾酮(testosterone,T)合成,进而阻碍精子发生,导致生殖损伤[1-2]。雄性哺乳动物体内的睾酮合成是在下丘脑-腺垂体-睾丸轴的调控下由睾丸间质细胞经过一系列酶促反应完成的。下丘脑合成的促性腺激素释放激素(gonadotropin releasing hormone,GnRH)作用于腺垂体使之释放促黄体生成素(luteinizing hormone,LH),LH作用于睾丸间质细胞的LH受体,活化胞内的腺苷酸环化酶(adenylate cyclase,ACs),催化ATP使之转化为cAMP,激活cAMP/蛋白激酶A(protein kinase A,PKA)信号通路,调控睾酮合成所需的多种蛋白和酶的表达[3]。在这一过程中,ATP是必不可少的上游信号分子。ATP主要产生于线粒体呼吸链的氧化磷酸化,所以,正常的线粒体功能是睾丸间质细胞中睾酮合成的重要保障。
研究表明,睾丸组织活性氧(reactive oxygen species,ROS)激增是杀虫剂等外源性毒物导致睾酮合成障碍的重要诱因[1, 4-6]。线粒体膜通透性转运孔(mitochondrial membrane permeability transport pore, mPTP)是ROS的作用靶点。ROS通过诱导mPTP持续开放,引起线粒体膜电位(mitochondrial membrane potential,MMP)下降,从而引发线粒体损伤,但具体分子机制尚不清楚[7-8]。本课题组前期研究结果显示,ROS诱导TM3细胞mPTP开放是在胞浆Ca2+的协同作用下完成的[9]。也有研究认为,ROS诱导mPTP开放的过程中,胞浆Ca2+稳态失衡是必不可少的中间状态与介导因素[10-11],但Ca2+调控mPTP开放的具体分子机制目前鲜有报道。胞内Ca2+的信号调控主要依赖Ca2+/钙调蛋白(calmodulin,CaM)/钙调蛋白激酶(calmodulin kinases,CaMKs)系统[12],但是该信号系统是否在胞内Ca2+稳态失衡后的mPTP开放过程中发挥作用还有待明确。因此,本研究拟通过急性离体染毒实验分析探明Ca2+/CaM/CaMKⅡ信号系统在Fen诱发TM3细胞线粒体损伤进而导致睾酮合成障碍中的作用和机制。
1 材料与方法
1.1 主要试剂与仪器 DMEM-F12培养基(BasalMedia,中国);胎牛血清、青链霉素、胰蛋白酶(Hyclone,美国);CaM阻断剂三氟拉嗪(Trifluoperazine,TFP)和氰戊菊酯(Sigma-Aldrich,美国);BAPTA-AM胞内Ca2+离子螯合剂(med chem express,中国);钙荧光探针Flou-4/AM(thermo fisher scientific,美国);线粒体膜电位检测试剂盒JC-1(Yeasen,中国);小鼠睾酮ELISA和小鼠环磷酸腺苷(cAMP)ELISA试剂盒(Meimian,中国);ATP含量检测试剂盒(Aifang,中国);CCK-8试剂盒(索莱宝,中国);GAPDH、CYP11A1、StAR、CaM、Bcl-2、Bax、CaMKⅡγ和CaM抗体(Proteintech,中国);3β-HSD抗体(SANTA,美国);p-CaMKⅡ抗体(Affinity,中国);COXIV(亚科因生物公司,中国);激光共聚焦显微镜(Airyscan,美国);二氧化碳恒温培养箱(Thermo Fisher Scientific,美国);凝胶成像仪(Syngene,美国);PAC1000电泳仪、电转仪、酶标仪(Bid-Rad,美国)。
1.2 小鼠睾丸间质细胞培养与处理 小鼠睾丸间质细胞Fen暴露毒性模型的建立:小鼠睾丸间质细胞系(TM3细胞,购自上海生命科学研究院)置于加入DMEM-F12培养液(含10 %胎牛血清)的96孔板,于37 ℃细胞培养箱培养(2.5×104个/孔)。TM3细胞急性染毒实验分组如下:对照组(0 μmol/L Fen)、Fen暴露组(25 μmol/L Fen)、Fen + BAPTA-AM组(25 μmol/L Fen + 5 mmol/L BAPTA-AM)、Fen + TFP组(25 μmol/L Fen + 10 μmol/L TFP),BAPTA-AM和TFP的孵育时长为24 h,收集TM3细胞或细胞培养液用于后续检测。
1.3 ELISA法检测TM3细胞睾酮分泌水平 将标准品按梯度浓度稀释,绘制标准曲线;收集上述细胞培养液上清,经加样、温浴、洗涤、加酶、显色等步骤,记录酶标仪于波长为450 nm处的OD值,根据试剂盒提供的计算公式计算各组TM3细胞的睾酮分泌水平。
1.4 ELISA法检测TM3细胞内cAMP含量 将标准品按梯度浓度稀释,绘制标准曲线;收集上述各组TM3细胞,加入PBS进行超声破碎,低温离心(4 ℃,2 000~3 000 r/min)20 min,取上清,经加样、温浴、洗涤、加酶、显色等步骤,记录酶标仪450 nm处的OD值,根据试剂盒提供的计算公式计算TM3细胞的cAMP含量。
1.5 化学比色法检测TM3细胞内ATP含量 将标准品按梯度浓度稀释,绘制标准曲线;收集上述各组TM3细胞,加入1 mL提取液,超声破碎,低温离心(4 ℃,12 000 r/min)10 min,取上清,按照ATP检测试剂盒说明书说明依次加入对应试剂,读取酶标仪340 nm的吸光度(OD值),依次记录A1和A2值,ΔA=A2-A1,根据试剂盒提供的计算公式计算TM3细胞的ATP含量。
1.6 钙荧光探针Flou-4/AM检测胞内Ca2+浓度 TM3细胞以2.5×104个/孔接种至20 mm的共聚焦皿,药物处理24 h后,弃除培养液,PBS清洗细胞,重复3次,加入含有Flou-4/AM探针(4 μmol/L)的DMEM-F12染液,于二氧化碳细胞细胞培养箱中孵育45 min,激光共聚焦显微镜观察TM3细胞内Ca2+水平并采集图像,ZEN 2.3软件分析平均荧光强度,荧光强度(绿光)与Ca2+浓度成正比。
1.7 JC-1荧光探针检测线粒体膜电位(MMP) TM3细胞以2.5×104个/孔接种至20 mm共聚焦皿,药物处理24 h后,弃去培养液,PBS清洗细胞,加入1 mL的JC-1染色工作液,于二氧化碳细胞培养箱37 ℃中避光孵育20 min,弃去染液,JC-1缓冲液清洗细胞,加入细胞培养液2 mL并在激光共聚焦显微镜下观察。在高MMP细胞中JC-1以多聚体(aggregate,红色荧光)形式存在;在低MMP细胞中JC-1以单体(monomer,绿色荧光)形式存在。ZEN 2.3软件分析平均荧光强度,分析TM3细胞线粒体膜电位(红色荧光强度越高代表MMP越高,绿色荧光强度越高代表MMP越低)。
1.8 Western blot检测TM3细胞CYP11A1、3β-HSD、StAR、CaM、CaMKⅡγ、p-CaMKⅡ、Bcl-2、Bax蛋白水平 收集各组细胞,提取线粒体总蛋白及细胞总蛋白并测定蛋白浓度(BCA法),SDS-PAGA电泳(10%和12%分离胶),转膜,5%脱脂奶粉封闭2 h,加入目的一抗StAR(1∶500)、3β-HSD (1∶500)、CYP11A1(1∶500)、CaMKⅡγ(1∶2 000)、CaM (1∶2 000)、p-CaMKⅡ(1∶1 000)、Bcl-2(1∶1 000)、Bax(1∶3 000),4 ℃孵育12 h,TBST洗涤3次(5 min/次),抗兔HRP-IgG(1∶5 000)二抗室温孵育45 min,凝胶成像仪采集ECL发光图像,分别选用GAPDH和COXIV作为检测细胞总蛋白和线粒体蛋白的内参抗体,Image J 2.30软件分析各目的蛋白的相对表达水平。
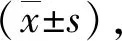
2 结果
2.1 Fen暴露对TM3细胞睾酮合成的影响 ELISA测定结果表明,Fen暴露后TM3细胞睾酮合成能力明显降低(P<0.01);共孵育BAPTA-AM(Ca2+螯合剂)或TFP(CaM阻断剂)后,TM3细胞的睾酮合成能力均有所回升(P<0.01,图1)。提示Fen干扰了TM3细胞的睾酮合成,BAPTA-AM胞内Ca2+螯合剂和CaM阻断剂TFP可抑制Fen对TM3细胞睾酮合成的阻碍作用。
**:与对照组比较,P<0.01;##:与Fen暴露组比较,P<0.01;n=3。图1 Fen暴露后不同处理组TM3细胞的睾酮分泌水平变化
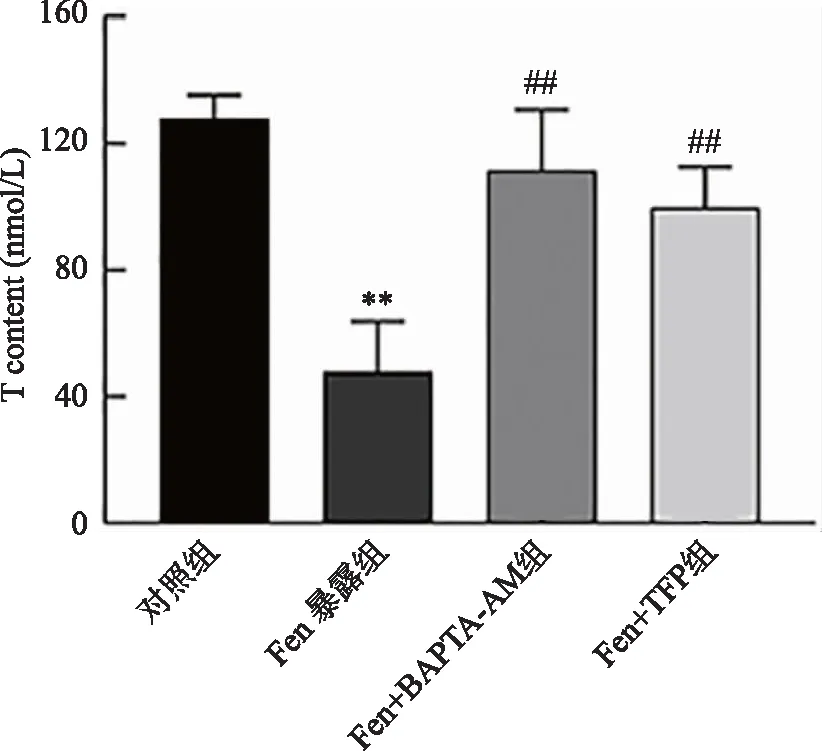
2.2 Fen暴露对TM3细胞CYP11A1、3β-HSD 和StAR蛋白表达水平的影响 蛋白免疫印迹结果表明,Fen暴露后TM3细胞的CYP11A1、3β-HSD 和StAR蛋白表达水平明显降低(P<0.01);共孵育BAPTA-AM(Ca2+螯合剂)或TFP(CaM阻断剂)后,TM3细胞的CYP11A1、3β-HSD 和StAR和蛋白表达水平均明显升高(P<0.01,图2)。提示,Fen通过抑制合成睾酮相关蛋白和酶的表达进一步干扰TM3细胞的睾酮合成,BAPTA-AM和TFP可抑制Fen对TM3细胞合成睾酮相关蛋白和酶的表达抑制作用。
A:代表性蛋白条带;B:蛋白条带定量统计结果;**:与对照组比较,P<0.01;##:与Fen暴露组比较,P<0.01;n=3。图2 Fen暴露后TM3细胞合成睾酮关键蛋白、酶水平表达的变化
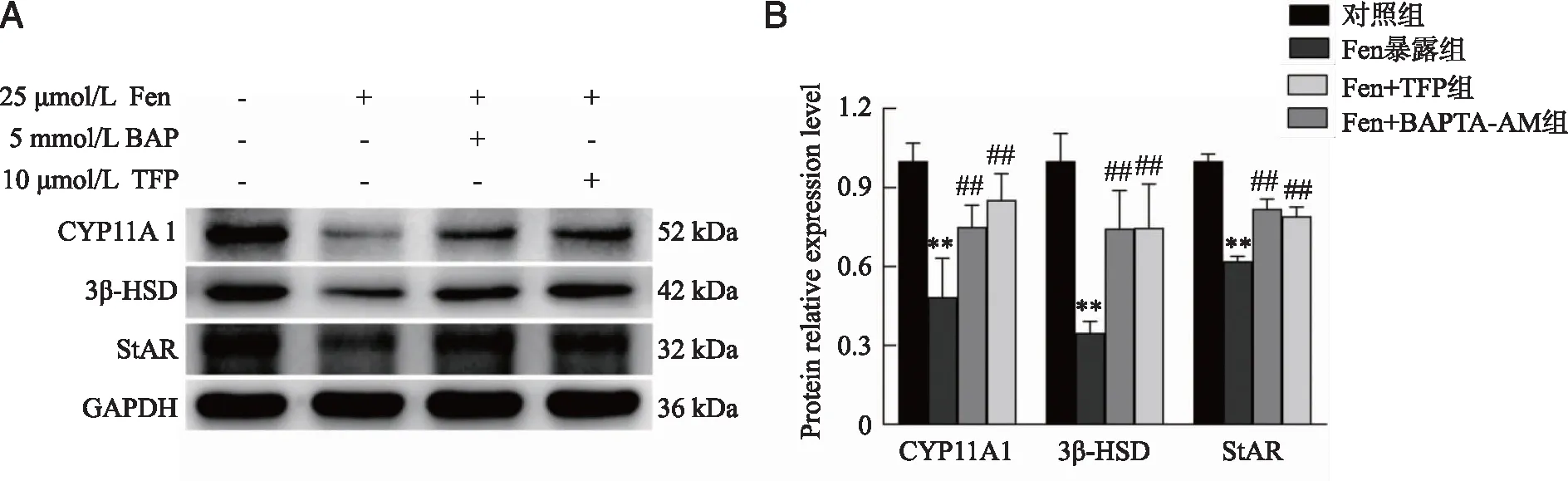
2.3 Fen暴露后TM3细胞cAMP和ATP合成水平的变化 ELISA和化学比色法检测结果显示,Fen暴露后TM3细胞内的cAMP和ATP含量明显减少(P<0.01);共孵育BAPTA-AM(Ca2+螯合剂)或TFP(CaM阻断剂)后,TM3细胞内的ATP和cAMP含量明显增加(P<0.01,图3)。提示Fen阻碍了TM3细胞内的cAMP与ATP合成,BAPTA-AM和TFP可缓解Fen对TM3细胞cAMP和ATP合成的抑制作用。
A:ATP;B:CAMP;**:与对照组比较,P<0.01;##:与Fen暴露组比较,P<0.01;n=3。图3 Fen暴露后TM3细胞内ATP与cAMP含量的变化
2.4 Fen暴露对TM3细胞MMP水平的影响 JC-1染色检测法结果表明,Fen暴露后TM3细胞的MMP水平明显降低(P<0.01);共孵育BAPTA-AM(Ca2+螯合剂)或TFP(CaM阻断剂)后TM3细胞的MMP水平明显升高(P<0.01,图4)。提示Fen暴露引起了TM3细胞线粒体损伤,BAPTA-AM和TFP可改善Fen暴露引起的TM3细胞线粒体损伤。
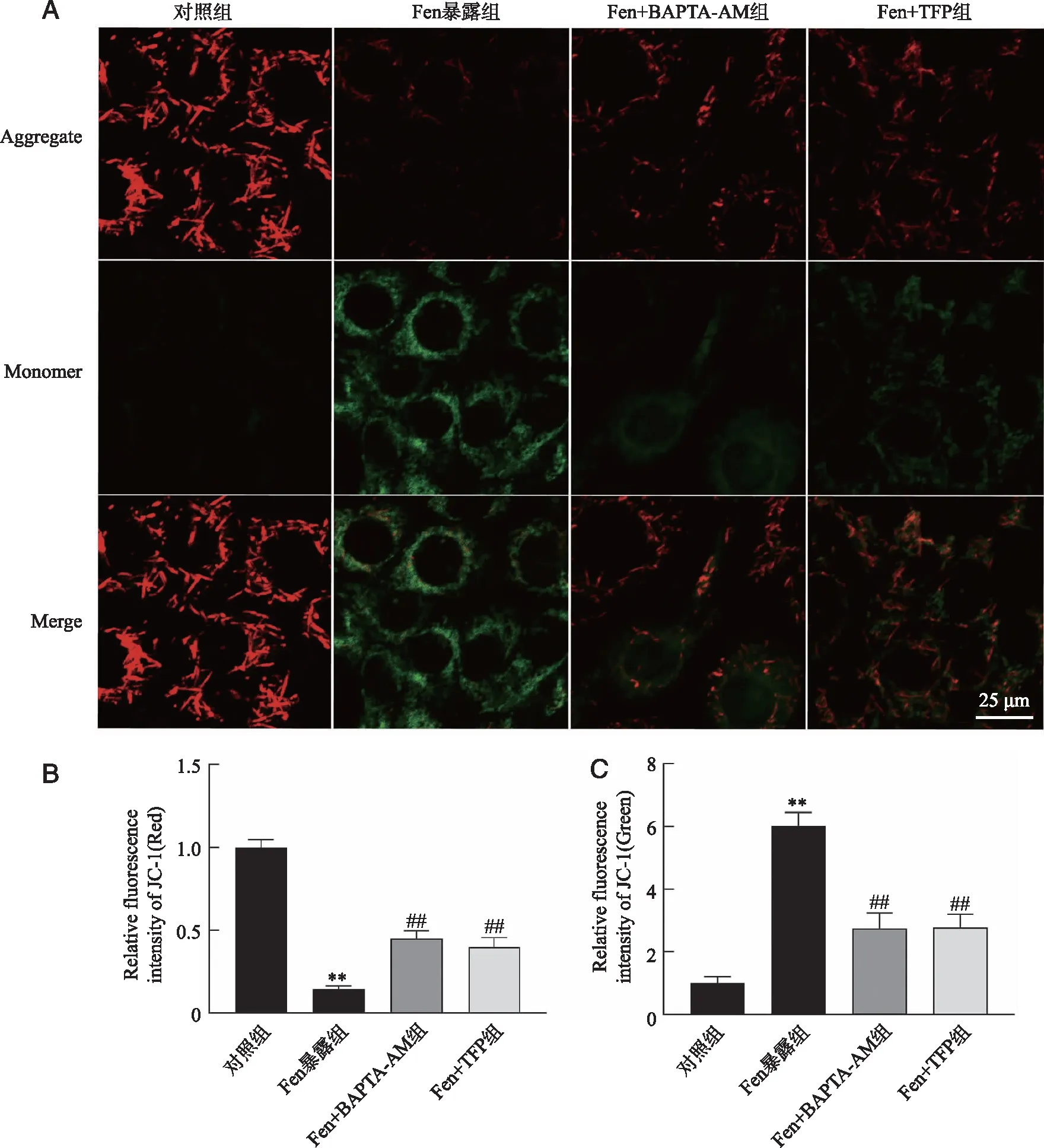
A:JC-1染色结果;B:红色荧光染色结果统计;C:绿色荧光染色结果统计;**:与对照组比较,P<0.01;##:与Fen暴露组比较,P<0.01;n=3;标尺为25 μm。图4 Fen暴露后TM3细胞后MMP的变化
2.5 Fen暴露后TM3细胞胞内Ca2+水平的变化 胞内Ca2+荧光探针Flou-4/AM的检测结果表明,Fen暴露后TM3细胞的胞质Ca2+水平增加(P<0.01);共孵育BAPTA-AM或TFP后TM3细胞胞浆Ca2+水平显著下降(P<0.01,图5)。提示Fen暴露引起TM3细胞胞浆Ca2+超载,BAPTA-AM和TFP有助于维持Fen暴露后TM3细胞胞浆的Ca2+稳态。
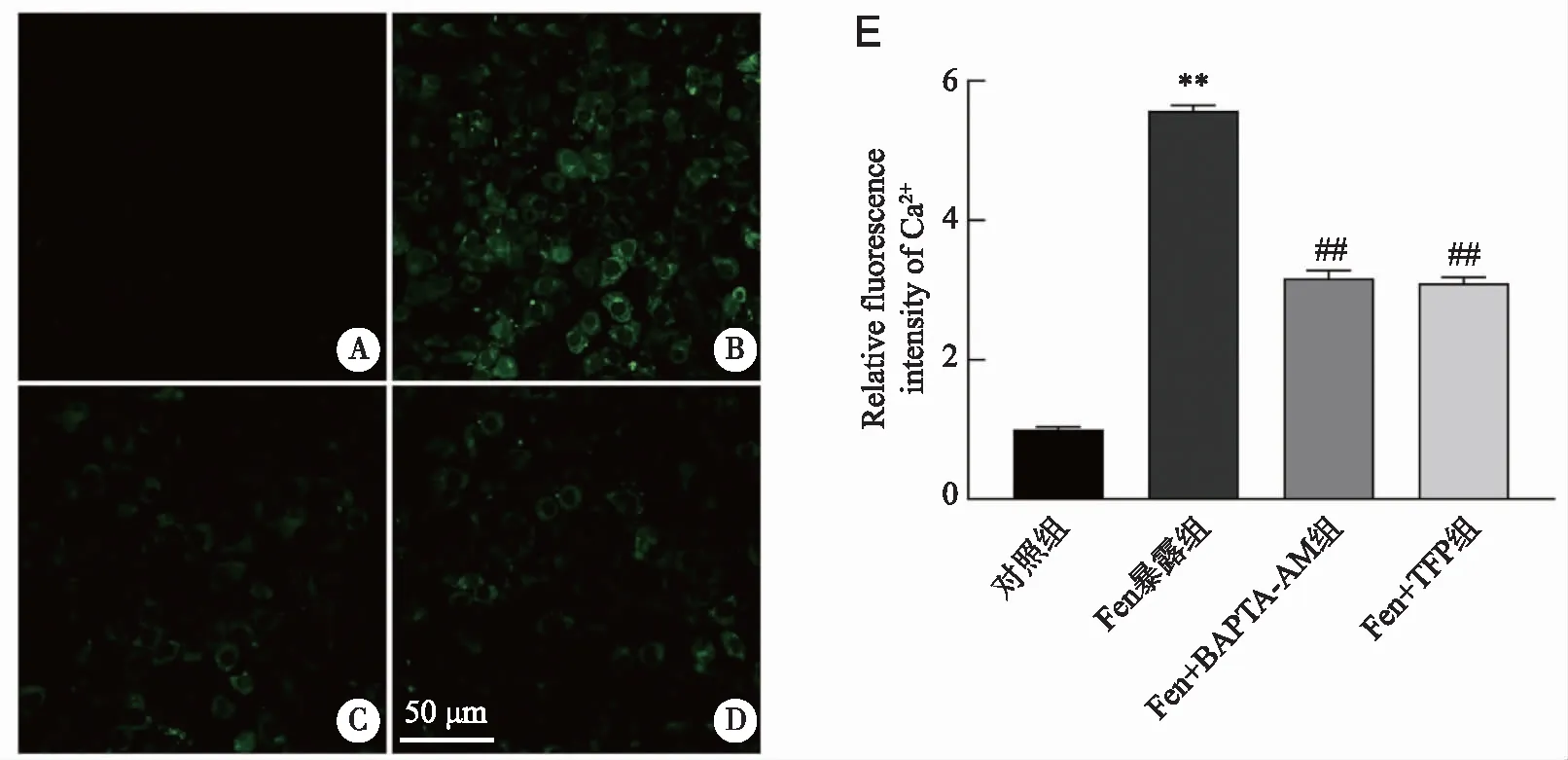
A:对照组;B:Fen暴露组;C:Fen+BAPTA-AM组;D:Fen+TFP组;标尺为50 μm;E:Ca2+统计结果;**:与对照组比较,P<0.01;##:与Fen暴露组比较,P<0.01;n=3。图5 Fen暴露后TM3细胞的胞浆Ca2+浓度变化
2.6 Fen暴露对TM3细胞CaM/CaMKⅡ通路的影响 蛋白免疫印迹检测结果表明,Fen暴露后TM3细胞的CaM和p-CaMKⅡ/CaMKⅡ蛋白表达明显增加(P<0.01);共孵育BAPTA-AM或TFP后,TM3细胞的CaM和p-CaMKⅡ/CaMKⅡ表达均明显减少(P<0.01,图6)。提示Fen暴露激活了TM3细胞Ca2+/CaM/CaMKⅡ信号通路,BAPTA-AM和TFP缓解了Fen对TM3细胞Ca2+/CaM/CaMKⅡ信号系统的激活作用。

A:代表性蛋白条带;B:蛋白定量统计结果;**:与对照组比较,P<0.01;##:与Fen暴露组比较,P<0.01;n=3。图6 Fen暴露后TM3细胞CaM/CaMKⅡ信号通路相关蛋白表达的变化
2.7 Fen暴露对TM3细胞mPTP结构成分蛋白Bcl-2和Bax表达的影响 TM3细胞Fen暴露后,提取线粒体总蛋白,检测mPTP结构成分蛋白Bcl-2和Bax表达水平的变化。蛋白免疫印迹结果表明,Fen暴露后TM3细胞的Bcl-2表达水平下降(P<0.01),Bax表达水平上升(P<0.01);共孵育BAPTA-AM或TFP后,TM3细胞的Bcl-2表达水平显著上升,Bax表达水平显著下降(P<0.01,图7)。提示Fen暴露引起了TM3细胞mPTP结构成分蛋白表达水平的改变,BAPTA-AM和TFP可缓解Fen暴露后TM3细胞mPTP结构成分蛋白表达的变化。
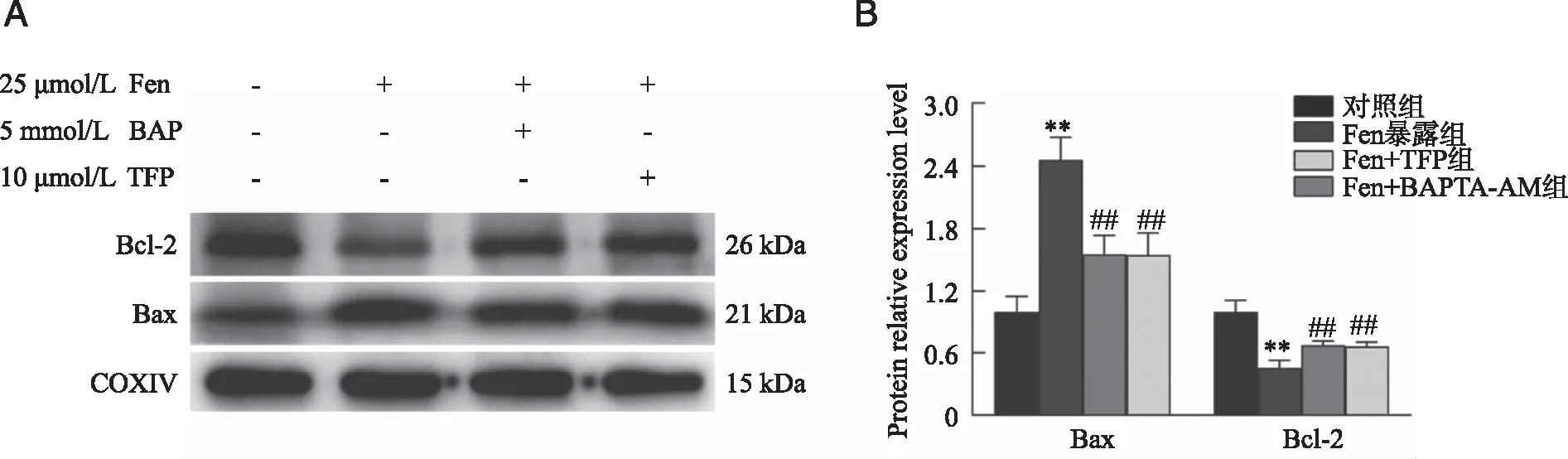
A:代表性蛋白条带;B:蛋白定量统计结果;**:与对照组比较,P<0.01;##:与Fen暴露组比较,P<0.01;n=3。图7 Fen暴露后TM3细胞mPTP结构成分蛋白Bcl-2和Bax表达水平的变化
3 讨论
随着社会工业化程度的不断提高,人类生育能力有逐渐下降的趋势,环境污染的持续加重是人类生育能力下降的重要诱因。在各类环境污染物中,农药杀虫剂占有重要地位。许多研究已证实,农药污染引起的男性生殖障碍与农药杀虫剂的生殖内分泌干扰作用有关[13-15]。
睾酮是雄性体内最重要的生殖激素,高浓度睾酮环境是曲细精管内生精细胞分化、成熟以及精子发生得以维持的基本保障。睾酮的合成过程有两个关键限速步骤:一是在类固醇激素合成急性调节蛋白(steroidogenic acute regulatory protein,StAR)的作用下,胆固醇从线粒体外膜经亲水的线粒体膜间隙转运至内膜,启动睾酮的合成;二是经细胞色素P450胆固醇侧链裂解酶(cytochrome P450 scc,CYP11A1)催化生成并转运至内质网的孕烯醇酮在3β-羟类固醇脱氢酶(3beta-hydroxysteroid delhyrogemase,3β-HSD)的作用下转化为孕酮,决定睾酮的最终合成[16-17]。Habotta等[18]研究报道,新烟碱类杀虫剂噻虫嗪在体给药后,雄性大鼠睾丸间质细胞StAR、3β-HSD和CYP11A1表达下调,大鼠睾酮合成能力也随之下降。本研究通过TM3细胞Fen离体暴露实验也得到了类似的结果。同时,胞内Ca2+螯合剂BAPTA-AM和CaM阻断剂TFP均可逆转Fen暴露对TM3细胞的毒性作用。提示Fen对TM3细胞睾酮合成的抑制作用与干扰TM3细胞StAR、3β-HSD和CYP11A1的表达有关,并且这一系列过程有Ca2+/CaM信号系统的参与。
StAR和3β-HSD等睾酮合成所需关键蛋白和酶的表达依赖cAMP/PKA信号通路的调节。Yan等[19]和Kong等[6]的研究表明,有机锡化合物(OTs)和杀虫剂啶虫脒暴露引起的睾酮合成酶表达水平下降均与cAMP/PKA信号抑制有关。与上述研究结果相似,本研究结果显示,Fen暴露后TM3细胞cAMP含量减少,BAPTA-AM和TFP可改善Fen暴露后TM3细胞的cAMP合成能力。提示cAMP/PKA信号紊乱是Fen抑制TM3细胞睾酮合成的重要机制,同时,Fen暴露引起的TM3细胞cAMP合成障碍与Ca2+/CaM信号系统有关。
在睾酮合成过程中,睾丸间质细胞内的cAMP是ACs以ATP为底物催化所得的产物。ATP主要产生于线粒体,线粒体ATP的合成依赖于线粒体内膜两侧的跨膜质子势能(即MMP)[20-21],后者的维持依赖于线粒体内膜的完整性。目前,线粒体损伤的发生机制尚未明确,但有许多研究表明,mPTP异常开放是线粒体损伤的重要标志[22-23]。本研究结果显示,Fen暴露后TM3细胞ATP含量减少,MMP水平下降,孵育BAPTA-AM和TFP后,TM3细胞ATP含量和MMP水平均有所上升。这些结果提示Fen暴露引起了TM3细胞mTPT的持续开放,线粒体内膜受损,TM3细胞MMP水平和ATP含量也因此而下降,并且Fen暴露引起的TM3细胞mPTP开放与Ca2+/CaM信号系统关系密切。
目前的主流观点认为,病理性因素刺激引起的ROS激增是细胞mPTP异常开放和线粒体损伤的主要诱因[23-24]。但有报道表明,胞浆Ca2+超载也是引发mPTP开放的重要因素[25],同时也是ROS诱导mPTP开放必不可少的中间状态[11],但细胞的Ca2+稳态失衡引发mPTP开放的具体机制仍不清晰。
Ca2+是细胞生物活动过程中重要的第二信使,胞内Ca2+主要依赖Ca2+/CaM/CaMKs信号系统发挥生物学作用[26]。CaM是真核生物细胞普遍存在的Ca2+受体蛋白,被认为是所有真核细胞Ca2+依赖性信号传导的主要调节因子,CaM与Ca2+结合后形成Ca2+/CaM复合物,进一步激活CaMKs,参与并调节细胞的增殖、分化和凋亡等生物活动[27]。CaMKs是一类具有丝氨酸/苏氨酸蛋白激酶活性的激酶家族,主要包括CaMKI、CaMKⅡ、CaMKⅡI和CaMKⅣ 4种家族成员,其中以CaMKⅡ的研究最为广泛。CaMKⅡ包括四种不同的亚型(α、β、δ、γ),并且与CaM的亲和力各不相同(亲和力依次为γ >β >δ >α)[28],其中α和β亚型在神经组织中高度富集,δ和γ亚型普遍表达于各种组织[29]。在基础条件下,CaMKⅡ处于失活态,当胞内Ca2+的增加时,Ca2+/CaM复合物链接于CaMKⅡ调节结构域的Ca2+/CaM结合位点,释放CaMKⅡ的催化结构域并发生自磷酸化而发挥生物效应[30-32]。
目前,Ca2+/CaM/CaMKs信号系统是否在胞内Ca2+稳态失衡后的mPTP开放过程中发挥作用尚不明确。本研究结果显示,TM3细胞胞浆Ca2+水平、CaM和p-CaMKⅡ/CaMKⅡ蛋白表达水平在Fen暴露后均显著上升,TM3细胞MMP水平显著下降;胞浆Ca2+螯合剂BAPTA-AM和CaM阻断剂TFP均可在抑制Ca2+/CaM/CaMKs信号系统的同时恢复TM3细胞的MMP水平。提示Fen可能通过诱发细胞Ca2+超载,异常激活Ca2+/CaM/CaMKs信号系统,引起TM3细胞mPTP开放导致MMP下降。
mPTP是一种多蛋白复合体,处于线粒体内、外膜的接触区,具有非特异、低电阻、高导电的通道特性,其分子组成目前尚未完全明确。一般认为,mPTP由内膜的腺嘌呤核苷酸转移酶(ANT)、基质的亲环蛋白D(CypD)和外膜的电压依赖性阴离子通道(VDAC)以及B细胞淋巴瘤-2(Bcl-2)家族蛋白等组成[33];其中,Bcl-2家族蛋白包括抗凋亡蛋白(Bcl-2、Bcl-xL、Bcl-w、Mcl1和A1)和促凋亡蛋白(Bax 和 Bak),前者通过结合并抑制促凋亡蛋白活性发挥抗凋亡作用,后者通过寡聚化作用增加mPTP开放程度以及线粒体外膜通透性发挥促凋亡作用[33-34]。Zhang等[35]研究表明,Hep3B细胞暴露于六价铬后凋亡水平升高,这与Hep3B细胞Bax/Bcl-2表达比例上升引起的mPTP开放程度增加有关。Marzetti等[36]的研究显示,老化的腓肠肌细胞mPTP开放程度增加,细胞凋亡率升高,mPTP结构成分蛋白CypD的表达水平上升可能是主要诱因。然而,病理性因素诱导mPTP结构蛋白表达上升的机制鲜有报道。本研究结果显示,Fen暴露后TM3细胞Bax表达增多,Bcl-2表达减少,孵育BAPTA-AM和TFP可逆转Fen暴露后Bax和Bcl-2的表达水平。提示TM3细胞在Fen暴露后mPTP开放程度增加与mPTP结构蛋白表达水平改变有关,Ca2+/CaM/CaMKs信号系统可能参与了mPTP结构成分的表达调控。
综上所述,本研究结果表明,Fen暴露后TM3细胞胞内Ca2+稳态失衡,致使细胞Ca2+/CaM/CaMKs信号系统紊乱,mPTP结构成分蛋白Bax和Bcl-2表达异常,mPTP开放程度增加,TM3细胞MMP水平下降,ATP合成能力降低,进而引起cAMP/PKA信号通路障碍,导致睾酮合成酶表达下降以及睾酮合成受阻。但Fen暴露引发TM3细胞胞内Ca2+稳态失衡以及Ca2+/CaM/CaMKs信号系统调控mPTP结构成分蛋白表达的作用机制仍有待进一步明确。

