柔弱斑种草石油醚部位化学成分活性研究*
夏 炎,商 勋,赵小超△,廖承谱,丁美婷,王 勇
(1.江苏省南京市中西医结合医院,江苏 南京 210000; 2.江苏省宿迁市中医院,江苏 宿迁 223800;3.浙江大学金华研究院,浙江 金华 321000)
肺癌死亡率居癌症之首[1]。在治疗过程中,多种因素可诱发肺癌及其他癌症患者的肺部感染[2-3],甚至危及生命,而中药可在肺癌的治疗中发挥重要作用。柔弱斑种草Bothriospermum zeylanicum(J.Jacquin)Druce 归肺经,具有止咳等功效[4-5],收载于《中药大辞典》《中华本草》等典籍。本研究中采用气相色谱质谱联用(GC -MS)法初步分析柔弱斑种草石油醚部位(PB)的化学成分,再通过微量肉汤稀释法和MTS 法探讨其抗菌及抗肺癌活性,并采用网络药理学分析挖掘其抗肺癌的潜在分子机制,为其深入开发与利用提供参考。
1 仪器、试药与菌株、细胞
1.1 仪器
8860 - 5977B 型气相色谱- 质谱联用仪(美国Agilent 公司);UV2550 型紫外可见-分光光度计(日本Shimadzu 公司);XS205 型分析天平(意大利Mettler Toledo 公司);RE-52A A 型旋转蒸发器、SHB-Ⅲ型真空泵(郑州长城科工贸有限公司);CA-1115A型冷却水循环装置(上海爱朗仪器有限公司);DMI3000B 型倒置显微镜(德国Leica 公司);370 系列CO2培养箱、Multiskan FC型酶标仪(美国Thermo Fisher Scientific公司)。
1.2 试药
头孢他啶(齐鲁制药有限公司,批号为1H0189A50);青霉素G钠(华北制药股份有限公司,批号为F1078101);顺铂(美仑生物科技有限公司,批号为N1001A);MH 肉汤(批号为1103531)、LB 肉汤(批号为1096071),均购自广东环凯微生物科技有限公司;胎牛血清(批号为1706126),RMPI - 1640 培养基(批号为0023019),DMEM 培养基(批号为0024719),胰酶(批号为0023518),双抗(批号为1936917),磷酸盐缓冲液(PBS,批 号 为0044818),二 甲 基 亚 砜(DMSO,批 号 为B821BA0018),均购自碧艾(上海)生物科技有限公司;MTS 试剂盒(美国Promega 公司,批号为0000219904);95% 乙醇、石油醚(60~90 ℃)、甲醇、无水乙醇等均为分析纯,水为超纯水。柔弱斑种草药材样品,采于江苏省宿迁市宿豫区曹集田间,经广西壮族自治区中医药研究院黄云峰副研究员鉴定为正品。
1.3 菌株与细胞
大肠埃希菌Escherichia coli(ATCC25922)、金黄色葡萄球菌金黄亚种Staphylococcus aureussubsp.aureus(ATCC29213)、肠沙门氏菌肠亚种Salmonella entericasubsp.enterica(ATCC14028)、铜绿假单胞菌Pseudomonas aeruginosa(ATCC27853);人白血病细胞HL-60、肺癌细胞A549、肝癌细胞SMMC - 7721、乳腺癌细胞MCF - 7、结肠癌细胞SW480。均购自中国普通微生物菌种保藏管理中心。
2 方法与结果
2.1 样品制备
取柔弱斑种草药材样品适量,剪段,加10倍量甲醇回流提取3次,减压回收溶剂,合并浓缩物得总浸膏。采用系统溶剂法萃取,浓缩,得PB;取100 mg,加入100 mL锥形瓶内进行甲酯化反应[6],加石油醚(60~90 ℃)-苯(1∶1,V/V)18 mL,充分溶解,再加0.4 mol/L 氢氧化钾- 氢氧化镁溶液9 mL,50 ℃水浴30 min,加18 mL水,振摇,静置分层,取上清液,加无水硫酸钠脱水,滤过,取滤液,即得样品。
2.2 GC-MS 试验
色谱条件:色谱柱为DB-WAX UI毛细管柱(30 m×0.25 mm,0.25µm);固定相为聚乙二醇(PEG-20M);进样口温度为250 ℃;检测器温度为250 ℃;进样量为1µL;分流比为10∶1;载气为氦气,恒流模式,流速为3.5 mL/ min;尾吹气流速为20 mL/ min;空气流速为450 mL/ min;氢气流速为40 mL/ min;升温程序,初始温度为40 ℃,保持3 min 后以3 ℃/ min 的速率升至250 ℃,保持30 min。
质谱条件:电离方式为电子轰击离子(EI)源;电子能量70 eV,离子源温度230 ℃,四极杆温度150 ℃,传输线温度250 ℃,质量范围35~500 amu;相对含量采用色谱峰面积归一化法计算;主要成分的定性鉴定采用美国国家标准与技术研究院标准质谱谱库(NIST11 谱库)检索法。
方法学考察结果:按相关要求进行方法学考察,结果精密度、稳定性、重复性试验结果的RSD均小于2.0%,表明仪器精密度良好,供试品溶液在室温放置12 h内基本稳定,方法重复性良好。
检测结果:取样品适量,按GC-MS 试验条件进样测定,记录总离子流图(见图1)。PB 的化学成分鉴定结果见表1。共鉴定出30 个化学成分,即亚油酸(20.13%)、十六酸(19.87%)、α-亚麻酸(13.60%)、反油酸(7.23%)、硬脂酸(4.27%)等,主要包含脂肪酸、脂肪醇、酯类、醚类、烷胺类化学成分。

图1 总离子流图Fig.1 Total ion chromatograms
2.3 体外抗菌活性筛选
溶液制备:取样品适量,以DMSO 和PBS为溶剂,灭菌,用水定容,制成质量浓度分别为128.00,100.00,20.00,4.00,0.80,0.16µg/mL 的供试品溶液。取青霉素G 钠适量,以DMSO 和PBS 溶解制成质量浓度分别为5,10µg/mL 的阴性对照溶液,同法制备头孢他啶质量浓度为2µg/mL的阴性对照溶液。
抗菌活性筛选:采用微量肉汤稀释法[7]。以含2%葡萄糖的RMPI-1640 培养基,于37 ℃、5%CO2条件下培养,得浓度为1 × 106cfu/mL 的大肠埃希菌、金黄色葡萄球菌金黄亚种、肠沙门氏菌肠亚种、铜绿假单胞菌菌悬液。实验设PB 组(32,64,128µg/mL)及阳性对照1,2,3组(青霉素G钠5µg/mL、青霉素G钠10µg/mL、头孢他啶2 µg / mL);取菌悬液及相应药物各100 µL,96 孔板中37 ℃培养24 h,酶标仪测定625 nm 波长处的吸光度(OD)值。重复操作3次。结果质量浓度为128µg/mL时,PB对4 种菌株均无明显抑制作用。详见表2。
表2 抗菌活性筛选结果(±s,%,n=3)Tab.2 Results of antibacterial activity screening(±s,%,n=3)

表2 抗菌活性筛选结果(±s,%,n=3)Tab.2 Results of antibacterial activity screening(±s,%,n=3)
组别质量浓度(µg/mL)抑制率大肠埃希菌肠沙门氏菌肠亚种铜绿假单胞菌阳性对照1组阳性对照2组阳性对照3组PB组5.00 10.00 2.00 128.00金黄色葡萄球菌金黄亚种100.11±0.00 99.94±0.08 99.29±0.00-34.30±3.65-200.31±0.86-26.30±0.39 100.55±0.21-21.60±3.93
2.4 体外抗肿瘤活性筛选
采 用MTS 法[8]。以 含10% 胎 牛 血 清 的 培 养 液(DMEM 或RMPI- 1640)37 ℃培养细胞12~24 h,分别制得HL - 60,A549,SMMC - 7721,MCF - 7,SW480 细胞悬液。以每孔3 000~15 000 个细胞100 µL 接种于96孔板,分别以100.00,20.00,4.00,0.80,0.16µg/mL的样品(每孔100µL)37 ℃下培养48 h。弃去培养液,每孔加入MTS 溶液20 µL 和培养液100 µL,37 ℃下继续孵育2~4 h。以酶标仪测定492 nm 波长处的OD值。以质量浓度(X,µg/mL)为横坐标、细胞存活率(Y)为纵坐标绘制细胞生长曲线,并计算半数抑制浓度(IC50)。实验设阳性对照(顺铂,配制方法与同量同样品)、模型对照、空白对照。细胞增殖抑制率(%)=[1 -(OD给药-OD空白对照)/(OD模型对照-OD空白对照)]×100%。结果显示,PB 对A549 和SMMC-7721细胞增殖具有较明显的抑制作用(见表3),随着样品质量浓度的增大,对2 种细胞增殖的抑制作用也逐渐增强(见图2)。
表3 抗肿瘤活性筛选结果(±s,μg/mL)Tab.3 Results of antitumor activity screening(±s,μg/mL)

表3 抗肿瘤活性筛选结果(±s,μg/mL)Tab.3 Results of antitumor activity screening(±s,μg/mL)
处理方式样品顺铂IC50 HL-60细胞>100 6.25±0.14 A549细胞76.43±11.33 7.47±0.5 SMMC-7721细胞47.20±7.67 6.06±0.24 MCF-7细胞>100 73.95±6.06 SW480细胞>100 28.74±1.93
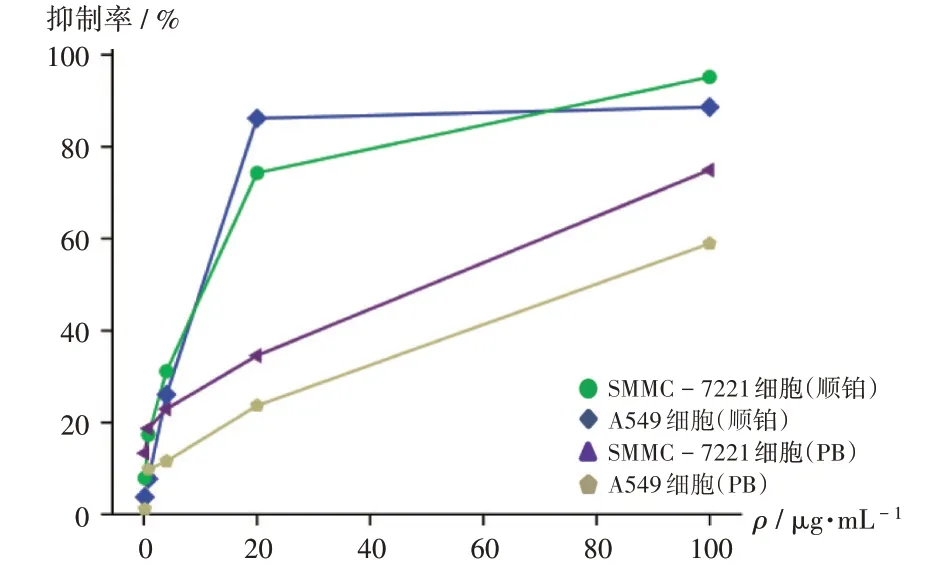
图2 石油醚部位对肿瘤细胞增殖的抑制作用Fig.2 Inhibitory effect of PB on the proliferation of tumor cells
2.5 抗肺癌作用分子机制研究
共有靶点预测:通过中草药系统药理学平台TCMSP(https:// old.tcmsp - e.com/ tcmsp.php)、中医药综合数据库TCMID(http://www.megabionet.org/tcmid/)、Batman - TCM 数据库(http:// bionet.ncpsb.org.cn/batman - tcm/)收集并预测PB 的化学成分靶点,以“lung cancer”为关键词,通过GeneCards 数据库(https://www.genecards.org/)、OMIM数据库(https://omim.org/)、DisGeNET数据库(https://www.disgenet.org/)、TTD数据库平台(https:// db.idrblab.net/ ttd/),获得疾病相关靶点。利用Venny 2.1.0软件获得共有靶点。
共筛选出23 727 个疾病靶点,513 个药物靶点,获得共有靶点504个,详见图3。

图3 药物-疾病靶点维恩图Fig.3 Venn diagram of drug - disease targets
富集分析:利用Bioconductor 软件,借助clusterprofiler 包、pathview 包、Dose 包,通过R 4.4.1 软件进行基因本体论(GO)功能富集和京都基因与基因组百科全书(KEGG)通路富集分析,以P<0.01 为筛选阈值,并绘制气泡图。GO功能富集分析筛选出343个条目(P<0.05),主要包括核受体活性、配体激活的转录因子活性、神经递质受体活性等,详见图4。KEGG通路富集分析筛选出163 条信号通路,主要包括神经活性配体-受体相互作用、钙信号通路、TRP通道的炎症介质调节等通路,其中EGFR,PI3K - Akt,VEGF 等通路在抗肺癌过程中有重要作用,且均有文献证实[9-11],详见图5。

A.柱状图 B.气泡图图4 GO功能富集分析结果A.Histogram B.Bubble chartFig.4 Results of GO functional enrichment analysis
3 讨论
GC-MS 法共鉴定出PB 中脂肪酸、脂肪醇、酯、醚、烷胺类等30个化学成分,其中亚油酸、十六酸、α-亚麻酸、反油酸、硬脂酸含量较高;抗菌活性筛选实验发现,柔弱斑种草PB 无明显抗菌活性;抗肿瘤活性筛选实验发现,其对A549细胞增殖具有抑制作用,依据其中医药归肺经的药性理论,实验结果结合网络药理学初步探讨了其抗肺癌活性及分子机理,发现PB 可能通过神经活性配体-受体相互作用、EGFR 酪氨酸激酶抑制剂耐药性AGE - RAGE 信号通路、PI3K - Akt 信号通路、VEGF 信号通路等发挥抗肺癌活性。另有研究表明,肉豆蔻酸、十五酸、十六酸、棕榈油酸、油酸、亚油酸、α-亚麻酸等化学成分具有抗肿瘤活性[12-15],而肉豆蔻酸、十五酸、十六酸、棕榈酸等化学成分对A549细胞增殖具有明显抑制作用,与本研究结果相似,故可为柔弱斑种草PB 具有较强的抗肺癌活性提供依据,提示其作为一种新的、具有抗肺癌活性的中药有较大的开发潜力,需进一步挖掘药效,以更好地服务于临床肿瘤疾病的防治。另外,GC-MS分析表明,PB化学成分中亚油酸相对含量较高,其除具有抗肿瘤活性外,还有较强的抗氧化活性,是天然抗氧化剂的重要原料之一,可降低胆固醇水平,并通过改善脂质代谢和抑制炎性反应缓解非酒精性脂肪性肝病,还可通过调节TLR4/NF- κB信号通路发挥抗类风湿关节炎的作用,对慢性头痛、神经和视网膜功能均有一定作用[16-19]。含量排名第3的α-亚麻酸生物活性多样,主要包括心血管及神经保护、抗癌、抗骨质疏松、抗炎、降糖、抗氧化等作用[15,20-24]。最新研究表明,α- 亚麻酸的足量摄取有助于视网膜DHA 水平提高[25]。表明PB化学成分具有较高的开发价值。
综上所述,本研究中尚未发现柔弱斑种草PB对大肠埃希菌、金黄色葡萄球菌金黄亚种、肠沙门氏菌肠亚种、铜绿假单胞菌的抗菌作用,但对A549细胞和SMMC-7721细胞增殖有一定的抑制作用,而PB抗肺癌的新药效尚无研究报道。
——和田盘羊

