多黏菌素治疗耐药革兰氏阴性菌感染致肾毒性的Meta分析Δ
王晓洁 ,董志强 ,董 媛 ,张春霞 ,武 婧 ,陈 晨 (.内蒙古科技大学包头医学院第一附属医院药物临床研究室,内蒙古 包头 0400;2.包头市第八医院药剂科,内蒙古 包头 04040)
多黏菌素为多肽类抗生素,对大部分需氧革兰氏阴性菌具有较强的抗菌活性,以多黏菌素B 和多黏菌素E较为常用,主要用于耐药革兰氏阴性菌感染的临床治疗,后因肾毒性与神经毒性明显而逐渐退出临床。近年来,由于耐药革兰氏阴性菌感染呈现快速上升趋势[1],而新型抗菌药物研发及新药上市的速度缓慢,使得临床可选择的药物较少,因此对耐药革兰氏阴性菌感染具有较好疗效的多黏菌素重新回归临床,成为了治疗这类感染的“最后一道防线”。
多黏菌素最常见的不良反应是肾毒性,可表现为血肌酐和尿素氮水平升高、肌酐清除率下降,而导致蛋白尿、血尿、管型尿或少尿,严重者可引起肾功能损害甚至急性肾小管坏死[2]。目前,不同研究报道的多黏菌素致肾毒性发生率差异较大[3―4]。为了更加科学地评估多黏菌素的肾毒性,本研究采用Meta分析的方法分析了耐药革兰氏阴性菌感染患者使用多黏菌素后的肾毒性发生情况,旨在为临床用药提供循证参考。
1 资料与方法
本研究根据Cochrane 手册和PRISMA 声明,按照PICOS 原则进行系统评价并报告结果。本研究已在INPLASY 网站(https://inplasy.com)登记,登记号为INPLASY2022120059。
1.1 纳入与排除标准
1.1.1 研究类型
本研究纳入的文献类型为随机对照试验(randomized controlled trial,RCT)或队列研究(回顾性队列研究和前瞻性队列研究)。
1.1.2 研究对象
本研究纳入的患者均为经微生物培养确诊的耐药革兰氏阴性菌感染患者。
1.1.3 干预措施
本研究的干预措施为多黏菌素(试验组)对比其他抗菌药物(对照组)或多黏菌素B(试验组)对比多黏菌素E(对照组)。患者的用药剂量不限,多黏菌素的用药疗程≥48 h。
1.1.4 结局指标
本研究的结局指标为肾毒性发生率。
1.1.5 排除标准
本研究的排除标准为:(1)无法获取全文的文献;(2)无法提取数据的文献;(3)重复发表的文献;(4)基础研究、会议论文。
1.2 文献检索策略
检索PubMed、Embase、Web of Science、the Cochrane Library、万方数据、中国知网、维普网和中国生物医学数据库。英文检索词为“polymyxin”“colistin”“acute kidney injury”“acute renal injury”“acute kidney failure”;中文检索词为“多黏菌素”“黏菌素”“肾毒性”“急性肾损伤”“急性肾功能衰竭”。采用主题词与自由词相结合的方式进行检索。检索时限为建库至2022年11月。
1.3 文献筛选与资料提取
由2名研究者独立筛选文献,如遇分歧,则通过讨论解决。提取资料包括:第一作者、发表年份、研究国家、研究类型、微生物类型、感染部位、干预措施、结局指标等。
1.4 纳入文献质量评价
采用Cochrane 系统评价员手册推荐的5.3.0 偏倚风险评估工具评价RCT的质量,具体包括:随机序列产生、分配隐藏、盲法、结局指标描述、结局指标完整性、报告偏倚、其他偏倚;每项均分为高偏倚、低偏倚或不清楚[5]。采用纽卡斯尔-渥太华量表(Newcastle-Ottawa scale,NOS)评分评价队列研究的质量,具体包括:研究人群的选择、组间可比性、结果评价;总分为9分,≥7分为高质量文献,<7分为中低质量文献[6]。
1.5 统计学方法
采用RevMan 5.4.1 软件进行Meta 分析。数据采用危险比(risk ratio,RR)及其95%置信区间(confidence interval,CI)表示。采用χ2检验分析各研究间的异质性,若P≤0.1且I2≥50%,表示各研究间有统计学异质性,先通过亚组分析探究异质性来源,若异质性对结果无实质性影响,采用随机效应模型进行分析;反之,则采用固定效应模型进行分析。采用倒漏斗图进行发表偏倚分析。检验水准α=0.05。
2 结果
2.1 文献检索结果与纳入研究基本信息
初检共获得相关文献901篇,经过阅读标题、摘要和全文后,最终纳入文献37篇[7―43],共计5 871例患者。文献筛选流程见图1,纳入研究基本信息见表1。
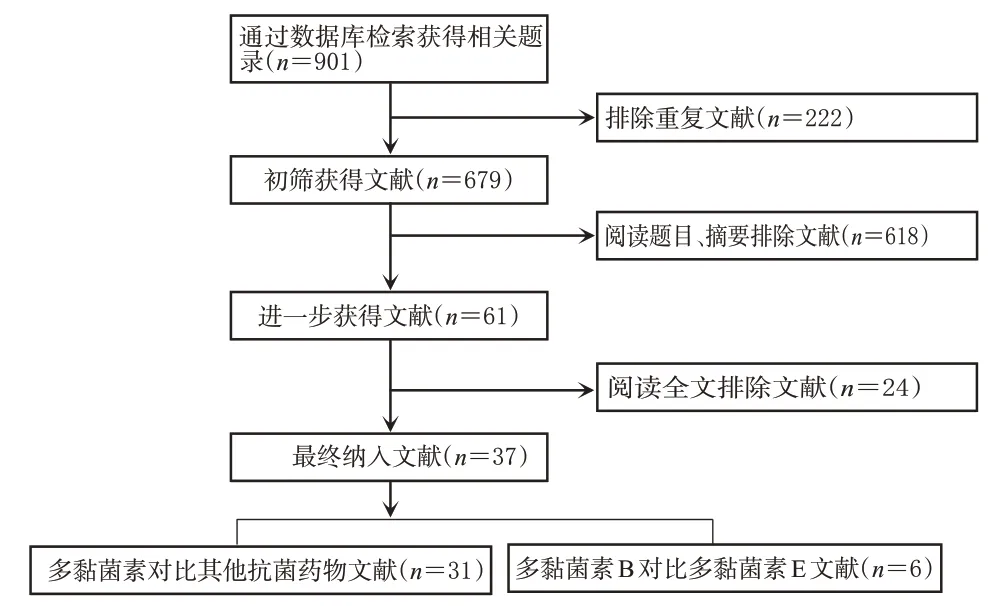
图1 文献筛选流程
2.2 纳入研究质量评价结果
4项RCT均描述了随机序列生成,均未描述分配隐藏方法[14―15,17,22];1项研究未采用盲法[15];所有研究均不存在随访偏倚和报告偏倚,均不清楚是否存在其他偏倚来源。结果见图2、图3。

图2 偏倚风险条形图

图3 偏倚风险总图
33 项队列研究中,6 项研究总分为9 分[13,25,31,34―35,40],16项研究总分为8分[7―8,10,12,16,18,20,23―24,26,29,32―33,37,39,42],11项研究总分为7分[9,11,19,21,27―28,30,36,38,41,43],均为高质量研究。
2.3 Meta分析结果
2.3.1 多黏菌素与其他抗菌药物比较
(1)RCT:4项RCT均报道了肾毒性发生率[14―15,17,22],各研究间无统计学异质性(P=0.40,I2=0),采用固定效应模型进行Meta分析。结果显示,试验组患者的肾毒性发生率显著高于对照组[RR=2.64,95%CI(1.43,4.87),P=0.002],详见图4。

图4 RCT中患者肾毒性发生率的Meta分析森林图
(2)队列研究:27 项队列研究报道了肾毒性发生率[7―13,16,18―21,23―37]。各研究间有统计学异质性(P<0.000 01,I2=71%),采用随机效应模型进行Meta 分析。结果显示,试验组患者的肾毒性发生率显著高于对照组[RR=1.59,95%CI(1.27,1.98),P<0.000 1],详见图5。

图5 队列研究中患者肾毒性发生率的Meta分析森林图
队列研究按对照组用药的不同进行亚组分析。结果显示,试验组患者的肾毒性发生率显著高于对照组使用新型β-内酰胺及其酶抑制剂类药物、替加环素患者(P<0.05),但与使用氨苄西林舒巴坦、碳青霉烯类药物、氨基糖苷类药物、其他药物的患者比较差异均无统计学意义(P>0.05),结果见表2。

表2 队列研究按对照组不同用药进行的亚组分析结果
队列研究按肾毒性诊断标准的不同进行亚组分析。结果显示,使用KDIGO 标准、RRT 标准或血肌酐升高0.5 倍标准时,试验组患者的肾毒性发生率显著高于对照组(P<0.05);使用RIFLE 标准、血肌酐>2 mg/dL、其他标准时,两组患者的肾毒性发生率比较差异均无统计学意义(P>0.05),详见表3。
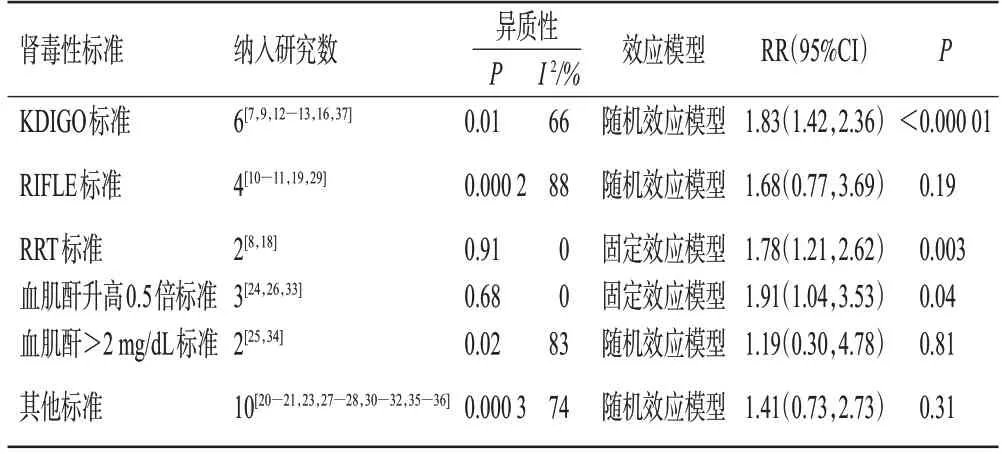
表3 队列研究按不同肾毒性标准进行的亚组分析结果
2.3.2 多黏菌素B与多黏菌素E比较
6 项研究报道了多黏菌素B 对比多黏菌素E 的肾毒性发生率[38-43]。各研究间有统计学异质性(P=0.000 1,I2=80%),采用随机效应模型进行Meta 分析。结果显示,使用多黏菌素E患者的肾毒性发生率显著高于使用多黏菌素B 患者[RR=0.57,95%CI(0.39,0.84),P=0.005],详见图6。
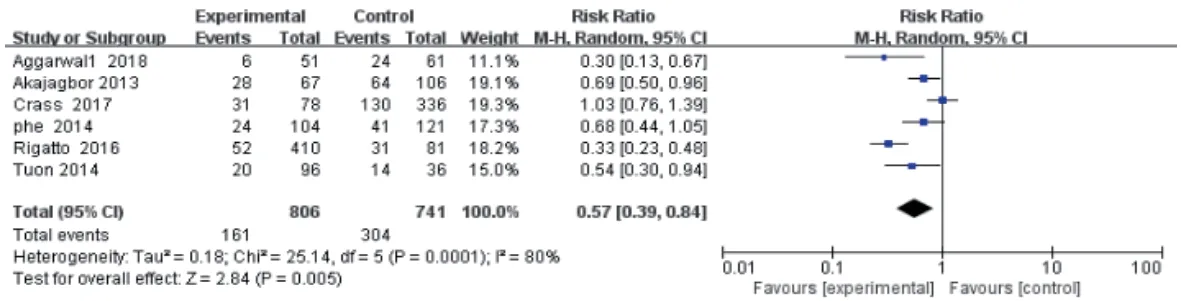
图6 多黏菌素B 对比多黏菌素E 致肾毒性发生率的Meta分析森林图
2.4 敏感性分析
以肾毒性发生率为指标,在逐一剔除纳入研究后,结果显示,剔除后的合并效应值均未发生明显改变,提示本研究结果基本稳健。
2.5 发表偏倚分析
以肾毒性发生率为指标绘制倒漏斗图。结果显示,各研究散点基本在倒漏斗范围内,表明本研究存在发表偏倚的可能性较小。结果见图7。

图7 肾毒性发生率的倒漏斗图
3 讨论
本研究结果显示,RCT中多黏菌素致肾毒性发生率为35.21%,队列研究中多黏菌素致肾毒性发生率为31.72%,这与Almangour 等[10]研究中多黏菌素致肾毒性发生率为33.33%的结果相似,但与Doremus 等[8]研究发现多黏菌素致肾毒性发生率为23.80%及Alotaibi等[3]研究显示51.56%的多黏菌素使用者发生了肾毒性的结果不同。这可能与多黏菌素给药剂量、患者的基础肾功能及是否联用其他具有肾毒性的药物等因素有关。多黏菌素引起肾毒性的机制较为复杂,目前认为是由于多黏菌素经肾小球滤过后,通过受体介导的内吞作用大量积聚于肾近端小管中,随后经死亡受体激活、线粒体损伤、内质网功能改变、氧化应激和自噬等一系列过程,最终导致肾脏细胞凋亡[44]。高龄、肥胖、低蛋白血症、糖尿病、合并使用肾毒性药物(如非甾体抗炎药、氨基糖苷类药物、万古霉素、利福平等)均可增加患者发生急性肾损伤的风险[4]。因此,在使用多黏菌素时应尽量避免可能增加患者肾毒性风险的因素,避免与其他已知有肾毒性的药物联用。
亚组分析结果显示,使用多黏菌素患者的肾毒性发生率显著高于使用新型β-内酰胺及其酶抑制剂药物和替加环素患者,但与使用氨苄西林舒巴坦、碳青霉烯类药物、氨基糖苷类药物、其他类药物比较差异均无统计学意义。这可能是由于不同抗菌药物的结构及作用机制不同,使得其肾毒性也存在差异。近年来,新型β-内酰胺及其酶抑制剂复方制剂表现出了良好的临床疗效及较低的肾毒性,成为了治疗耐药革兰氏阴性菌感染的新手段[8]。但由于上述药物上市品种较少,在目前治疗耐药革兰氏阴性菌感染可选药物较少的情况下,多黏菌素仍然是治疗此类感染相对安全的药物。亚组分析结果还显示,在使用KDIGO 标准、RRT 标准、血肌酐升高0.5 倍标准时,试验组患者的肾毒性发生率均显著高于对照组。这可能是由于多黏菌素引起的肾损伤多为轻中度损伤,严重肾损伤发生较少。
多黏菌素B 对比多黏菌素E肾毒性的结果显示,使用多黏菌素E 患者的肾毒性发生率显著高于使用多黏菌素B 患者。非肾脏清除机制被认为是多黏菌素B 的主要清除途径[38],而多黏菌素E 在体内有60%~70%经肾脏排出,可在尿液中维持较高的杀菌浓度,适用于尿路感染的治疗,侵袭性感染时可优先选择肾毒性发生风险较低的多黏菌素B。
综上所述,在耐药革兰氏阴性菌感染的治疗中,多黏菌素的肾毒性发生率较高,且多黏菌素E高于多黏菌素B。本研究的局限性为:(1)纳入的研究数量有限;(2)给药剂量不一致,且缺乏用药剂量的具体数据,无法针对剂量进行亚组分析;(3)有部分研究将肾毒性发生率作为次要结局,因此关于肾毒性发生率的数据有限。可见,本研究所得结论尚需更多高质量研究进一步证实。

