藻炭改性电极强化微生物燃料电池产电及去除硝基苯性能
徐戴非,吴兵党,杨晶晶,沈正栋,黄天寅*
1.苏州科技大学环境科学与工程学院
2.苏州市海绵城市技术重点实验室
微生物燃料电池(microbial fuel cell,MFC)是一种新型的生物电化学系统,用于同时发电和废水处理[1]。传统MFC 由阳极室和阴极室2 个腔室组成(图1),2 个腔室由质子交换膜隔开。MFC 的重点是利用微生物在阳极室的代谢活性和阴极室的氧化还原反应,将化学能转化为电能。在阳极室中,微生物分解有机物产生电子与质子[2-4],这些电子通过外部电路,质子通过膜到达阴极。在阴极,进入的电子被氧[5]、铁氰化物等电子受体还原,从而完成阴极半电池反应。到目前为止,除了通过阳极室中的氧化过程有效去除复杂的有机物,MFC 还可以通过阴极室中的还原过程成功去除各种污染物,包括重金属[6]、染料[7]、亚硝酸盐[8]等。
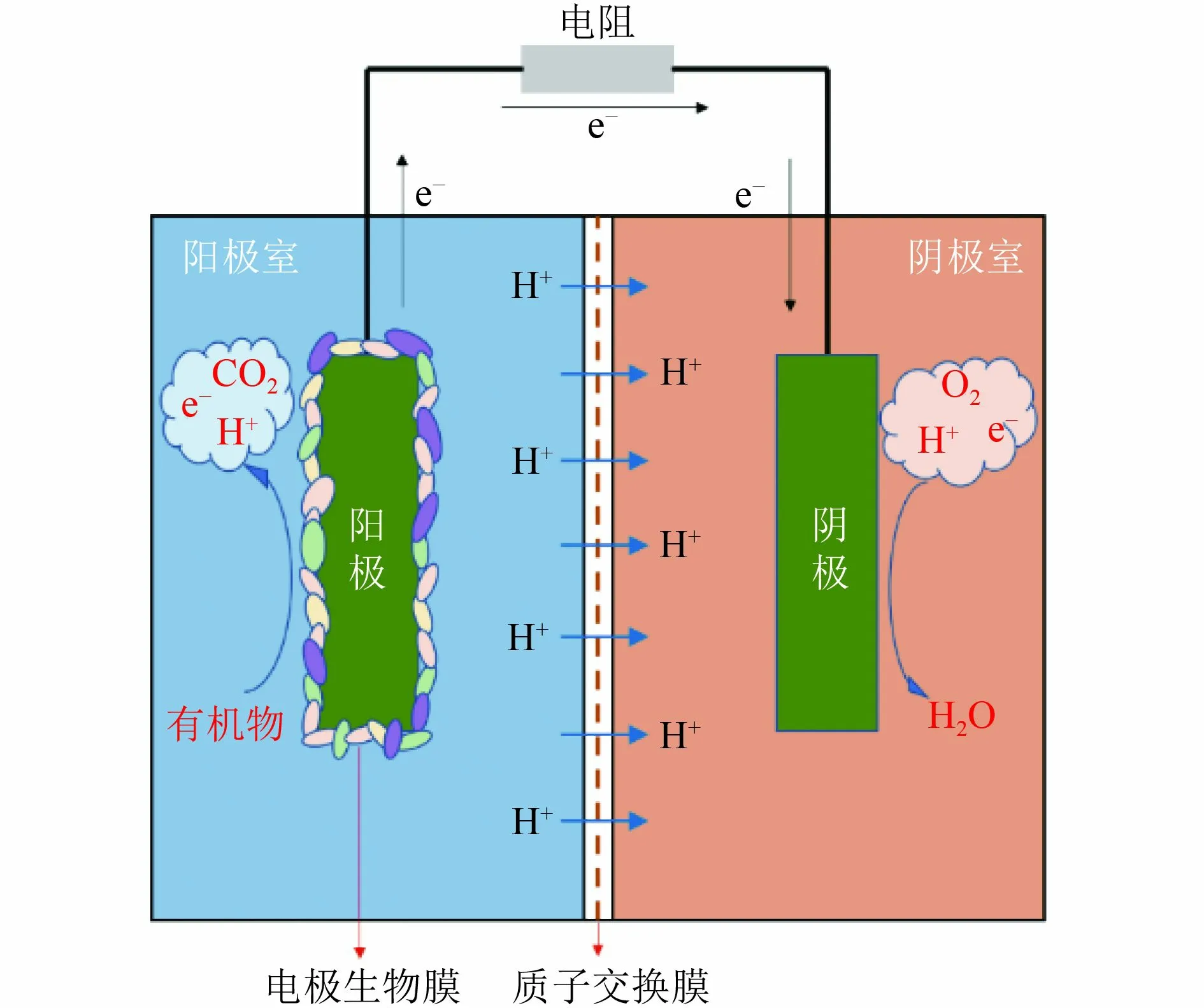
图1 MFC 反应器原理Fig.1 MFC reactor schematic diagram
低功率性能和高材料成本阻碍了MFC 的大规模开发和实际应用[9-10]。因此,MFC 未来能否广泛投入实际应用必然依赖于系统性能的提高和材料成本的降低。研究表明,在所有MFC 组件中,阳极电极在发电和去除污染物方面起着至关重要的作用,因为它与细菌直接接触,并影响电子从细菌到阳极表面的转移速率[11]。具有大表面积、丰富的可接近传质通道和高活性表面官能团的阳极对于促进外电极微生物的附着和生长,从而提高阳极性能至关重要[12]。在许多研究中,商用碳材料(如碳纸、炭毡或布)被用作MFC 中的电极材料。然而,这些碳材料显示出相对较低的细菌黏附活性,产生的生物膜形成量较低,细菌与电极表面之间的相互作用较弱,因此导致功率输出效率较低[13]。在最近的研究中,人们通过对原始阳极进行表面处理或通过纳米材料(如贵金属和非贵金属、金属氧化物、金属碳化物、天然和合成碳材料以及各种纳米复合材料)进行表面涂层来进行阳极改性[14]。其中,生物炭是一种富含碳的材料,可以通过木质纤维素生物质、动物废物、城市废物和其他有机材料的热化学分解产生[15]。生物炭由不同数量的微量金属离子组成,具有高表面积的多孔结构、不同的官能团、生物相容性好、易修饰等特点[16-17]。Wang 等[18]使用在500 ℃(BC500)和900 ℃(BC900)下烧制的玉米秸秆生物炭和KOH 改性生物炭(BAC)作为生物电化学系统(BES)的电极材料。与炭毡电极相比,BC500、BC900 和BAC 阳极的最大功率密度分别提高了10.7%、56.0%和92.0%。Lan 等[19]通过炭化蛋白核小球藻(CCP)来修饰碳布(CC)作为MFC 的阳极,结果表明,CCP 修饰的碳布的生物电催化成功启动后电流密度最高达(13.44±0.34)A/m2,分别比使用炭黑和裸露CC 的高12%和22%。
硝基苯(NB)是一种典型的硝基芳香族化合物,广泛用于染料、制药、炸药、农药、苯胺制造、有机溶剂等行业[20]。随着全球化学工业的快速发展,硝基苯的排放量也在不断增加[21]。未经处理的原水和处理的工业废水中仍含有14~591 mg/L 的NB[22]。由于其致畸性、致癌性、致突变性和高毒性,已被美国国家环境保护局列为“优先污染物”[23-24]。废水中的NB 因具有稳定的化学结构而难以被降解。且由于NB 中NO2-的缺电子特性,污水处理中常用的氧化剂难以对NB 进行降解,甚至会产生一些有毒副产物,如吡啶甲酸。相比于氧化降解,还原降解更有利[25]。这是因为当NB 被还原时,初级产物苯胺(AN)更容易进一步生物降解[26]。因此,开发高性能MFC 以有效去除硝基苯并伴随高效产电是当前研究热点之一。
本文以螺旋藻粉为原料制备生物炭,将其修饰在炭毡上作为MFC 的阳极以期提高MFC 的性能;通过循环伏安(CV)测试、扫描电镜(SEM)、高通量测序来评估阳极的性能;阴极用来处理硝基苯废水,测试其去除率,并定量分析其中间产物。相关研究结果将为通过阳极改性提高MFC 产电及降解污染物的性能提供参考。
1 材料与方法
1.1 藻炭及生物炭修饰电极的制备
螺旋藻粉购于滨州美越饲料科技有限公司。藻粉首先在60 ℃鼓风干燥箱中干燥24 h。干燥后的粉末在管式炉(OTF-1200X-S,合肥科晶材料技术有限公司)分别以直接热解、酸活化、碱活化的方法,以500 和700 ℃的热解温度制备3 类共6 种藻炭材料。具体制作方法如下:1)未活化藻炭。干燥后的藻粉在管式炉中以5 ℃/min 升温速率,分别从室温升至500 和700 ℃,并保持2 h,随后自动冷却至室温,全程通N2。将热解的样品在研钵中研磨过200 目筛网,筛后粉末用无水乙醇、2 mol/L HCl 溶液和去离子水连续洗涤数次,直到pH 达到7。将粉末过滤并在60 ℃下干燥12 h。所得产物表示为BC500、BC700。2)酸活化藻炭。将干燥后的藻粉在1 mol/L 的HCl 溶液中浸泡12 h 以上,搅拌均匀后用离心机分离,并用纯水清洗藻粉直至上清液pH 呈中性为止,将清洗好的藻粉烘干后置于管式炉中碳化,全程通N2,将得到的藻炭研磨、清洗、干燥,步骤与未活化藻炭相同。得到酸活化的藻炭,记为HCl-AC500、HCl-AC700。3)碱活化藻炭。将干燥后的藻粉与NaOH 固体以1∶1 的质量比迅速研磨混合,随即在N2保护下碳化,将得到的藻炭研磨、清洗、干燥,步骤与未活化藻炭相同。得到碱活化的藻炭,记为NaOH-AC500、NaOH-AC700。
制备藻炭修饰电极:生物炭负载量按5 mg/cm2计算,准确称取45 mg 藻炭置于10 mL 离心管中,分别滴加2 mL 异丙醇、2 mL 5%的Nafion 溶液和1 mL 去离子水,超声2 h 使材料分散均匀。用移液管将分散好的藻炭悬浊液分几次均匀滴涂于3 cm×3 cm 的炭毡(carbon felt,CF)表面,常温晾干后即可制备成微生物燃料电池阳极材料,将不同类型藻炭材料制备的阳极分别命名为NaOH-AC700/CF、HCl-AC700/CF 和BC700/CF 等。
1.2 试验装置与方法
1.2.1 MFC 反应器的组装与运行
通过亚克力板组装2 个相同容积的有机玻璃室(图2),拼接成双室MFC。每个腔室的尺寸为5 cm×5 cm×9 cm,每个腔室的有效容积为200 mL。2 个腔膜(PEM)(CMI-7000)隔开。藻炭修饰电极放于阳极室中,阴极室由尺寸为3 cm×3 cm 的泡沫镍组成。电极夹在钛丝上,阳极和阴极电极外接1 000 Ω 的电阻。阳极室和阴极室都是密封的,并用磁力搅拌器搅拌以改善传质。所有MFC 的试验均在(30±2)℃下进行,所有试验至少重复3 次。根据电极的不同材料,反应器的命名如表1 所示。
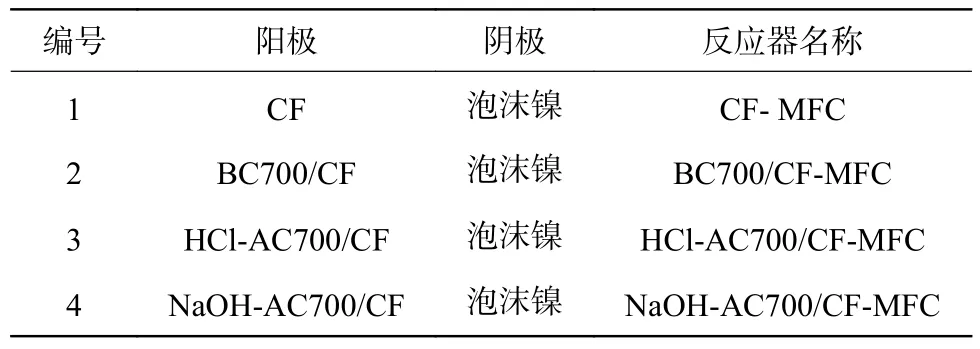
表1 不同电极的MFC 反应器名称Table 1 MFC reactor with different electrodes

图2 MFC 反应器装置Fig.2 Device diagram of MFC reactor
MFC 的接种污泥来自苏州某印染厂厌氧塔的厌氧活性污泥。开始接种时,阳极室加入10 mL 接种污泥和190 mL 的营养液。阳极室营养液的制备如下[27]:3.0 g/L NaAc,0.31 g/L NH4Cl,0.13 g/L KCl,10 mg/L CaCl2,20 mg/L MgCl2·6H2O,2 mg/L NaCl,5 mg/L FeCl2,1 mg/L CoCl2·2H2O,1 mg/L MnCl2·4H2O,0.5 mg/L AlCl3, 3 mg/L (NH4)6Mo7O24, 1 mg/L H3BO3,0.1 mg/L NiCl2·6H2O,1 mg/L CuSO4·5H2O,1 mg/L ZnCl2和50 mmol/L pH=7 的磷酸盐(PBS)缓冲溶液。阴极室加入200 mL 的阴极液,其组分为50 mmol/L 的K3[Fe(CN)6]和50 mmol/L pH 为7 的PBS缓冲溶液。
系统加入接种液和营养液后开始驯化,以电阻两端电压指标评估驯化和稳定阶段。在驯化阶段,当电压低于50 mV 时,视为1 个周期的结束,并更换阴阳极液。当连续3 个周期的最大电压值相似时,视为驯化阶段结束,MFC 进入稳定运行期[28]。
1.2.2 硝基苯阴极还原试验设计
MFC 稳定运行后,将1 个周期结束后的阴极液更换成硝基苯阴极还原试验设计条件下的配方,具体试验设计如下:1)不同藻炭修饰阳极对硝基苯阴极还原性能的影响。选取CF、BC700/CF、HCl-AC700/CF 和NaOH-AC700/CF 作为MFC 的阳极,硝基苯浓度为0.8 mmol/L,以PBS 为电解质,pH=7。2)不同阴极初始pH 对硝基苯阴极还原性能影响。设置阴极液初始pH 为5、6、7 和8,硝基苯浓度为0.8 mmol/L,以NaOH-AC700/CF 为阳极,PBS 为电解质。3)不同阴极电解质对硝基苯阴极还原性能影响。设置阴极电解质为NaCl、PBS 和Na2SO4,硝基苯浓度为0.8 mmol/L,以NaOH-AC700/CF 为阳极,pH=7。4)不同硝基苯初始浓度对硝基苯阴极还原的影响。取硝基苯初始浓度分别为0.4、0.8、1.6、和2.4 mmol/L,以NaOH-AC700/CF 为阳极,PBS 为电解质,pH=7。
取上述试验条件下运行144 h 时的出水检测硝基苯、苯胺、亚硝基苯、偶氮苯和氧化偶氮苯浓度,进行硝基苯在MFC 阴极还原降解的中间产物分析。
1.3 生物炭与生物膜的表征
使用场发射电镜(Quanta FEG 250,美国)对藻炭进行表征,以了解样品的表面形貌。利用全自动比表面积仪(ASAP 2460,美国)测定藻炭的比表面积。
使用场发射电镜分析阳极表面微生物形貌特征及附着情况。将驯化完成的MFC 阳极取出,用小刀在电极中间部分采得带有微生物附着的炭毡材料;将取得的材料置于2.5%的戊二醛中,冷藏24 h 固定,用pH 为7 的0.1 mol/L 的PBS 溶液冲洗样品3 次,接着使用乙醇水溶液对样品进行梯度脱水,溶液中乙醇含量依次为30%、50%、70%、80%、90%和100%,样品自然干燥后用于SEM 分析。
分别取接种污泥和稳定运行2 个月的反应器阳极表面生物膜样品,送至苏州金唯智生物科技有限公司进行16S rDNA 扩增子测序,得出Alpha 多样性指数,包括Ace、Chao、Shannon 和Simpson。根据测序结果分析阳极表面微生物的丰度与物种组成。
1.4 水质分析
采用高效液相色谱仪(Breeze QS,美国)测定硝基苯、亚硝基苯、苯胺浓度,具体检测方法:甲醇与1‰乙酸水流动相(体积比为60∶40),紫外检测波长为240 nm,进样量为10 µL,流速为1 mL/min。试验中污染物浓度采用标准曲线法确定。
采用气质联用仪(Agilent 7890A/5975C,美国)对硝基苯还原过程中的中间产物进行定性与定量分析。将硝基苯还原终点得到的产物用乙酸乙酯萃取。质谱使用EI 离子源,采用全扫模式,扫描范围为50~400 m/z,进样体积为1 µL,进样温度为250℃,以5 ℃/min 升温速率升到300 ℃。确定中间产物后,进一步通过配备火焰离子化检测器(FID)的GC 进行定量分析。
1.5 电化学测量
使用数据采集器(Agilent 34972A,美国)记录电阻两端的电压。通过稳态放电法将外电阻从20 000 Ω 到10 Ω 获得计划曲线。功率密度计算公式如下:
式中:P为功率密度,W/m2;U为电压,V;I为电流,A;A为阳极的投影横截面积,m2。
电极的CV 测试在电化学工作站(CHI660,上海辰华)中进行,采用三电极体系,以铂电极为对电极,Ag/AgCl 为参比电极,修饰电极为工作电极,扫描速率为1 mV/s,扫描范围为-0.8~0.8 V。
2 结果与讨论
2.1 藻炭及藻炭修饰电极的表征和电化学性能分析
2.1.1 不同藻炭修饰电极表面形貌
图3 展示了藻炭及其原材料藻粉的扫描电镜图。从表面形貌来看,原材料藻粉呈球状,表面有较多褶皱,光滑,无孔洞结构。BC500、BC700 整体形貌类似,表面较为粗糙,但未观察到孔洞结构,其中BC500 材料表面有少量颗粒状晶体结构,这可能是热解过程中,焦油与生物质中盐成分混合形成的残留杂质。HCl-AC500、HCl-AC700 整体形貌类似,表面相对光滑,有少量细小的孔洞出现,并有少量晶体状杂质附于材料表面。NaOH-AC500、NaOHAC700 表面形貌特征类似,表面粗糙,形成了丰富的孔状结构,孔径小且密,呈蜂窝状,具有更大的比表面积。在较大放大倍数视野中观察发现,相比于NaOH-AC500 材料〔图3(g)〕,NaOH-AC700 材料〔图3(i)〕成孔率更高,孔洞更为密集。

图3 藻炭材料SEM 图Fig.3 SEM diagram of algal biochar
进一步对比微生物驯化后电极表面形貌特征,观察各电极表面微生物附着情况,经驯化后各电极表面形貌如图4 所示。
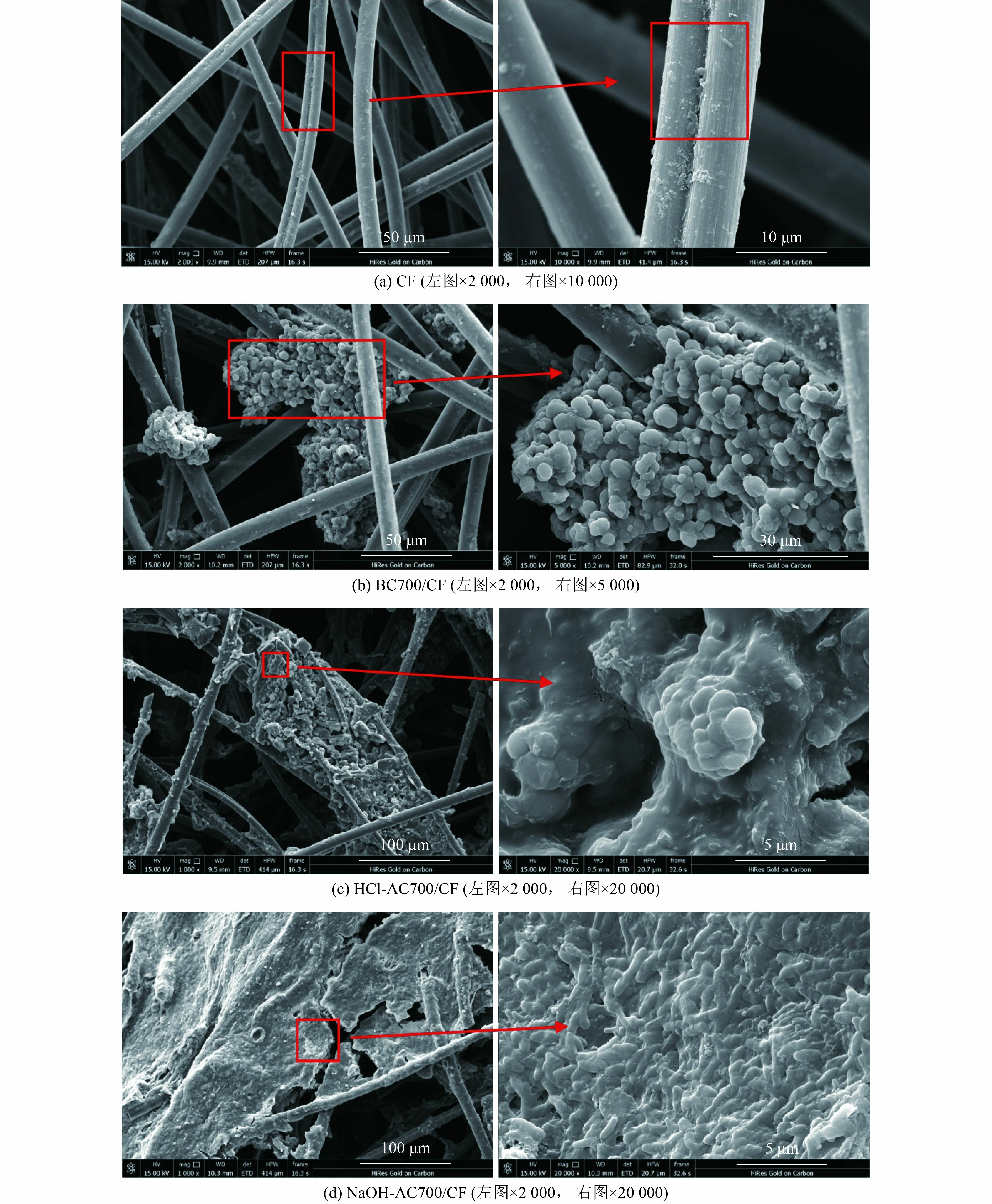
图4 MFC 阳极表面微生物附着情况SEM 图Fig.4 SEM diagram of microorganism adhesion on MFC anode surface
由图4(a)可知,CF 电极纤维结构明显,表面较为光滑,只有少数物质附着在碳纤维丝表面,视野内观察到的微生物较少。由图4(b)可知,BC700/CF 阳极表面发现有大块球形颗粒物质堆积,推测为藻炭材料与微生物的混合物,虽然量比较多,但是类型较为单一。由图4(c)可知,HCl-AC700/CF 阳极表面能观察到明显的藻炭颗粒,且在藻炭颗粒上发现了少量球形微生物。由图4(d)可知,NaOH-AC700/CF 阳极表面未发现由滴涂黏附的生物炭,但观察到有明显的层状结构,并发现了大量杆状微生物附着在其表面,推测该层状结构是由生物炭吸附阳极液中有机物质形成的,表面粗糙,为微生物的提供了更大的黏附面积,利于微生物的富集与挂膜。
2.1.2 不同藻炭比表面积
比表面积是表征生物炭吸附能力的重要指标,作为MFC 阳极材料,比表面积越大,对污泥的黏附面积越大,越利于微生物在阳极表面的富集。不同活化方式下的藻炭比表面积如表2 所示。6 种藻炭材料中,2 种碱活化藻炭的比表面积远大于未活化藻炭与酸活化藻炭。NaOH-AC500 与NaOH-AC700的比表面积分别为46.726 4 和664.203 4 m2/g。从活化温度来看,NaOH-AC700 藻炭比表面积远大于NaOH-AC500 的比表面积,该结果与SEM 形貌特征一致。

表2 不同类型藻炭比表面积Table 2 Specific surface area of different types of algal biochar
2.1.3 不同藻炭修饰电极的CV 曲线
CV 法是一种评价电极电化学性能的常用手段,CV 曲线的闭合面积越大,在相同时间内转移的电荷量越多,电极的电荷转移能力也越强,表明电极表面具有更多的活性位点并且电极的导电性更好[29]。裸露炭毡以及其他不同藻炭修饰电极的CV 曲线如图5所示。由图5 可见,各藻炭修饰电极的闭合面积均明显大于CF 电极,说明6 种藻炭修饰电极对电子的转移都有一定的促进作用。按活化方法来看,碱活化藻炭修饰电极CV 曲线闭合面积最大,未活化与酸活化藻炭修饰电极闭合面积接近;按活化温度看,700 ℃下活化的藻炭修饰电极CV 曲线闭合面积均大于500 ℃下活化的藻炭。总体来看,700 ℃下活化的NaOH-AC700 修饰电极电化学性能最好,NaOH-AC500 次之。其中,NaOH-AC700/CF 电极电化学性能远好于其他藻炭修饰电极,具有良好的导电性。后续采用700 ℃下的各类生物炭修饰电极进行试验。
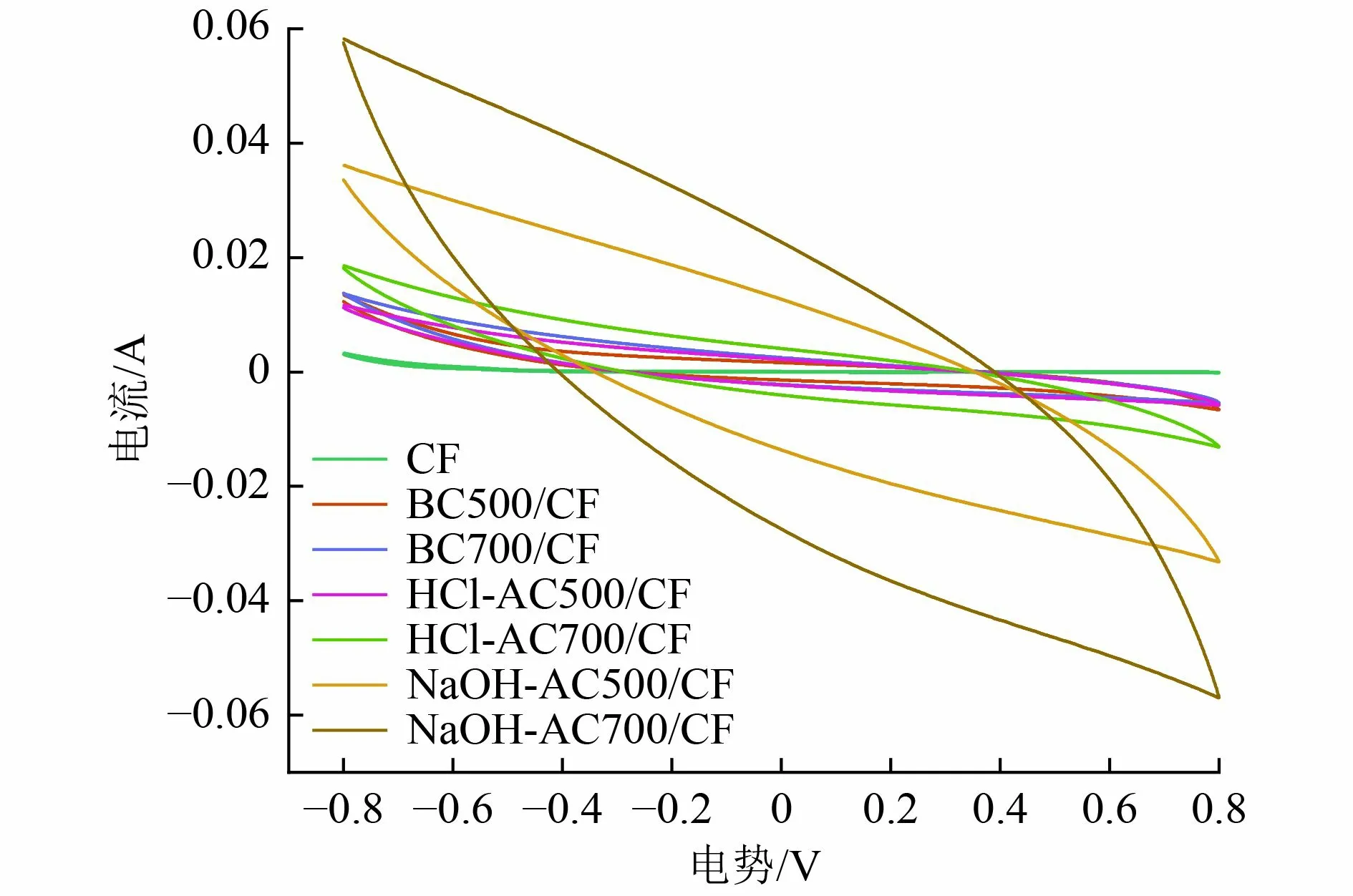
图5 藻炭修饰电极CV 曲线Fig.5 CV diagram of algal biochar modified electrodes
2.2 藻炭修饰阳极MFC 产电性能分析
为了考察不同藻炭修饰阳极在实际运用中对MFC 产电性能的影响,以BC700/CF、HCl-AC700/CF 和NaOH-AC700/CF 为MFC 阳极,与普通CF 电极对比,分析不同藻炭修饰电极对MFC 启动与运行电压输出的影响,结果如图6 所示。由图6(a)可知,NaOH-AC700/CF-MFC 的响应时间最短,在第1 天就出现电压响应,第2 天开始有较稳定的电压输出,然后依次是HCl-AC700/CF-MFC 和BC700/CFMFC,CF-MFC 响应时间最长,在第7 天开始才有明显的电压输出。从驯化阶段的电压输出来看,NaOH-AC700/CF-MFC 最大输出电压达到0.65 V,HCl-AC700/CF-MFC 和BC700/CF-MFC最大输出电压接近,在0.6 V 左右,CF-MFC 最大输出电压最低,仅有0.53 V。研究表明,MFC 启动时间与启动响应电压受电极材料、接种污泥和化学需氧量(COD)等因素影响[30],电极材料是微生物参与阳极反应传递电子的接触界面,是影响MFC 启动的主要因素之一。NaOH-AC700/CF 阳极在MFC 驯化过程中展现出明显优势,一定程度上说明NaOH-AC700/CF 具有良好的生物相容性。
反应器稳定运行后的电压输出情况与启动时基本一致。由图6(b)可知,NaOH-AC700/CF-MFC 输出电压最高,最大可达0.67 V,分别是CF 阳极、BC700/CF 阳极和HCl-AC700/CF 阳极MFC 最高输出电压的1.26、1.20、1.14 倍。
图7 为不同藻炭修饰阳极MFC 稳定运行后的功率密度曲线与极化曲线。功率密度是一个直接反映微生物燃料电池产电性能优劣的指标,功率密度越大,电池产电性能越好[31]。由图7(a)可知,NaOHAC700/CF-MFC、 HCl-AC700/CF-MFC、 BC700/CF-MFC 和CF-MFC 最大功率密度分别为0.60、0.44、0.41 和0.29 W/m2,NaOH-AC700/CF-MFC 的最大功率密度是CF-MFC 的2 倍,高于Huggins 等[32]以林业残渣和木屑残渣生物炭构建的生物炭电极MFC的最大功率密度〔(532±18)和(457±20)mW/m2〕。极化曲线反映了电极电位与电流密度之间的关系,是表征电极性能的重要指标。由图7(b)可知,随着电流密度的增加,NaOH-AC700/CF-MFC 的极化程度最低,进一步证明了NaOH-AC700/CF 阳极的优异性能。
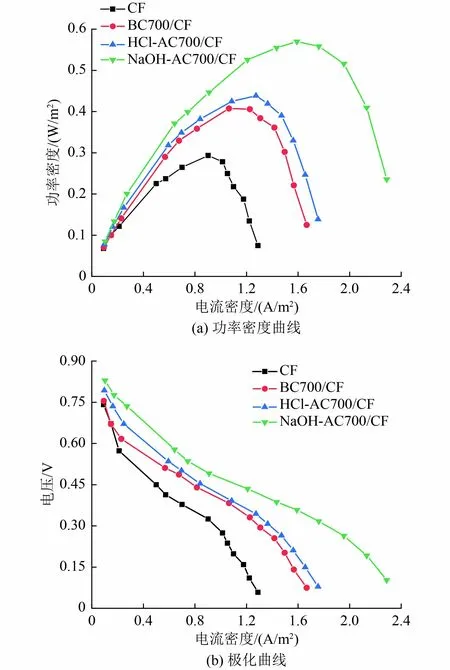
图7 不同藻炭修饰阳极MFC 功率密度曲线与极化曲线Fig.7 MFC power density curve and polarization curve of different algal biochar modified anodes
2.3 MFC 对硝基苯阴极还原性能和降解途径分析
2.3.1 不同藻炭修饰阳极对硝基苯阴极还原性能影响
不同藻炭修饰阳极MFC 硝基苯阴极降解与产物生成情况如图8 所示。由图8(a)可知,反应7 d 后, CF-MFC、 BC700/CF-MFC、 HCl-AC700/CFMFC 和NaOH-AC700/CF-MFC 的阴极对硝基苯的降解率分别为81.3%、94.5%、96.3%和99.3%,各反应器的苯胺生成率分别为18.9%、27.7%、29.6%、42.2%。相比于CF 阳极,NaOH-AC700/CF-MFC 的降解效率提高了22.1%,苯胺生成率提高了123.3%〔图8(b)〕,且具有更高的反应速率,表明较大的系统功率密度利于阴极还原过程,该试验结果与文献[18,33]研究结果一致。
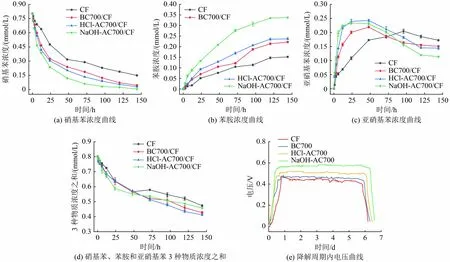
图8 不同阳极MFC 体系硝基苯降解、产物生成及电压变化Fig.8 Nitrobenzene degradation, product formation and voltage variation in different anode MFC systems
亚硝基苯是硝基苯还原生成苯胺过程中主要的中间产物,其浓度变化如图8(c)所示,反应中亚硝基苯的浓度总体呈先升高后降低的趋势。3 种藻炭修饰阳极MFC 亚硝基苯浓度在2 d 内达到峰值,CFMFC 亚硝基苯浓度达到峰值的时间较晚,约在第4 天其峰值与BC700/CF-MFC 相近,低于NaOHAC700/CF-MFC 和HCl-AC700/CF-MFC。原因可能是反应前期,阳极COD 充足,微生物活性较高,大量硝基苯得电子还原为亚硝基苯。反应第2 天,亚硝基苯浓度达到峰值,与硝基苯竞争电子,此时硝基苯降解速率下降,苯胺生成量持续升高,直至第5 天,反应逐渐结束。在反应过程中,硝基苯、苯胺和亚硝基苯3 种物质摩尔浓度之和始终处于逐渐下降的趋势〔图8(d)〕,反应结束后,观察到阴极液呈淡黄色,初步推测反应过程中含有氧化偶氮苯和偶氮苯,由中间产物亚硝基苯与其进一步还原后生成的不稳定化合物苯基羟胺(苯胲)缩合反应生成[34]。
对比硝基苯在各藻炭阳极MFC 与CF-MFC 的阴极还原发现,NaOH-AC700/CF 阳极不仅提升了MFC 对硝基苯的还原效率,同时提高了苯胺的生成率,降低了阴极亚硝基苯的积累,大大提升了MFC对硝基苯的定向还原能力。
图8(e)为不同阳极MFC 阴极降解硝基苯时的电压曲线,NaOH-AC700/CF-MFC 最大输出电压为0.58 V,分 别 是CF 阳 极、BC700/CF 阳 极 和HCl-AC700/CF 阳极MFC 最高输出电压的1.26、1.23、1.10 倍。与MFC 稳定运行时的电压相比均出现了下降的情况,但NaOH-AC700/CF 阳极的输出电压仍是最高的,因此阴极能获得更多的电子加速硝基苯的还原。
2.3.2 不同阴极初始pH 对硝基苯阴极还原性能影响
pH 是影响MFC 性能的主要因素之一[35-36]。不同初始pH 条件下硝基苯降解和产物生成变化结果如图9 所示。从降解速率来看,初始pH 越低,降解速率越快。pH 对苯胺生成效率影响显著,pH 越低,苯胺生成量越高,pH 为5 时,反应终点苯胺生成量为52.8%,较初始pH 为6、7、8 时分别提升了16.6%、32.1%、67.3%。各反应器硝基苯、苯胺和亚硝基苯3 种物质摩尔浓度之和如图9(d)所示,pH 越低,反应终点3 种物质之外的其他产物的生成量也越低。推测原因可能是当pH 较低时,会抑制氧化偶氮苯等产物的生成[37],促进了硝基苯在阴极对苯胺的定向还原。
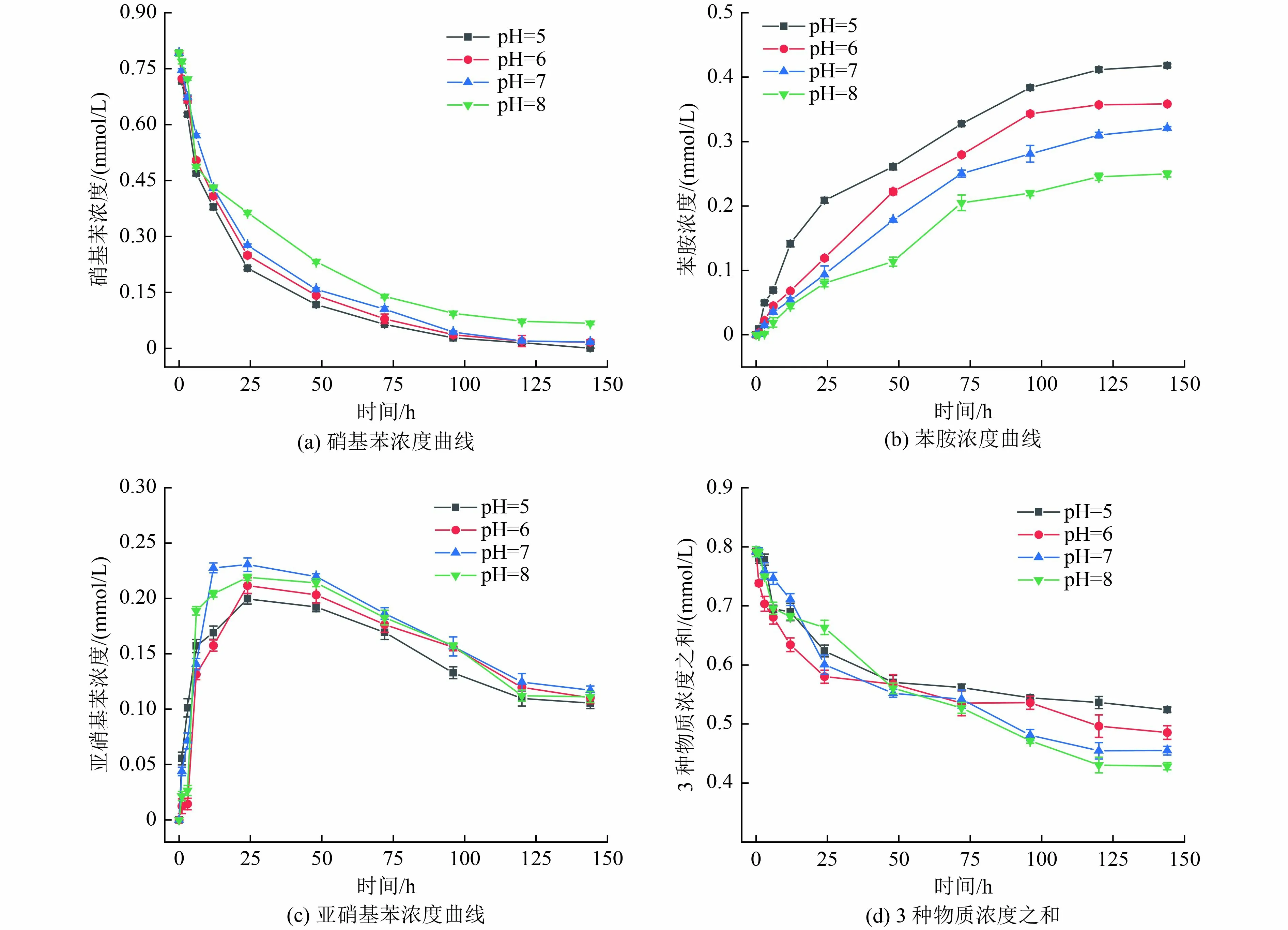
图9 不同初始pH 条件下硝基苯降解和产物生成变化Fig.9 Nitrobenzene degradation and product formation changes at various initial pH
2.3.3 硝基苯阴极还原降解产物及路径分析
通过GC-MS 谱图分析硝基苯阴极还原的降解产物,检测到的物质有亚硝基苯、苯胺、硝基苯、偶氮苯和氧化偶氮苯,与文献[38-39]中的结果基本一致,但本试验中未检测出苯基羟胺,推测可能是苯基羟胺不稳定易分解所致[33]。
进一步研究在不同阳极类型、阴极电解质、阴极初始pH 和硝基苯初始浓度条件下硝基苯阴极还原的特点,对偶氮苯与氧化偶氮苯进行定量分析,并计算硝基苯还原终点各产物占比,结果如图10 所示。由图10 可见,以上4 个影响因素中,阳极类型与阴极初始pH 在硝基苯阴极还原中起关键作用。NaOH-AC700/CF-MFC 不仅提高了硝基苯的降解率,同时促进了硝基苯对苯胺的定向还原,且在4 种阳极MFC 中亚硝基苯积累量最低,减小了溶液的生物毒性,有利于阳极对该混合液的进一步降解,与2.3.1节结果一致。pH 是影响硝基苯还原的重要因素。当溶液呈碱性时,对硝基苯的还原明显起抑制作用;当酸性增强时,硝基苯的降解率与苯胺的生成率明显升高,利于后续反应的进行。硝基苯初始浓度与电解质类型对硝基苯阴极降解的影响较小。
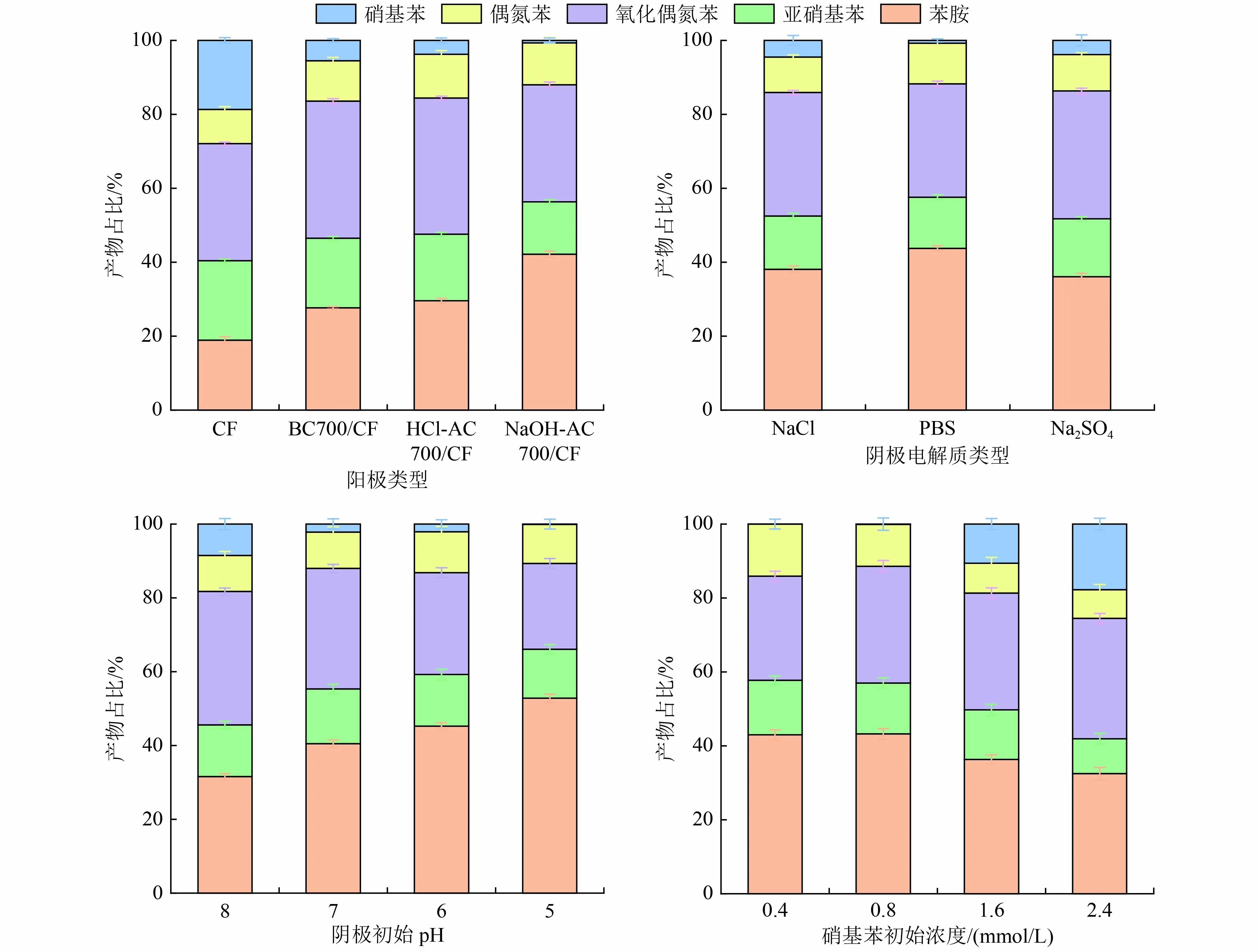
图10 各条件下反应终点产物占比Fig.10 Proportion of end products under various conditions
基于以上产物分析,绘制MFC 阴极硝基苯的还原路径(图11)。亚硝基苯和苯基羟胺可通过缩合反应生成氧化偶氮苯,并可进一步还原为偶氮苯与氢化偶氮苯,最后得电子生成苯胺[40]。因此苯胺的生成量越多,说明硝基苯得到的电子越多,也反映了MFC 阳极向阴极传递的电子越多。
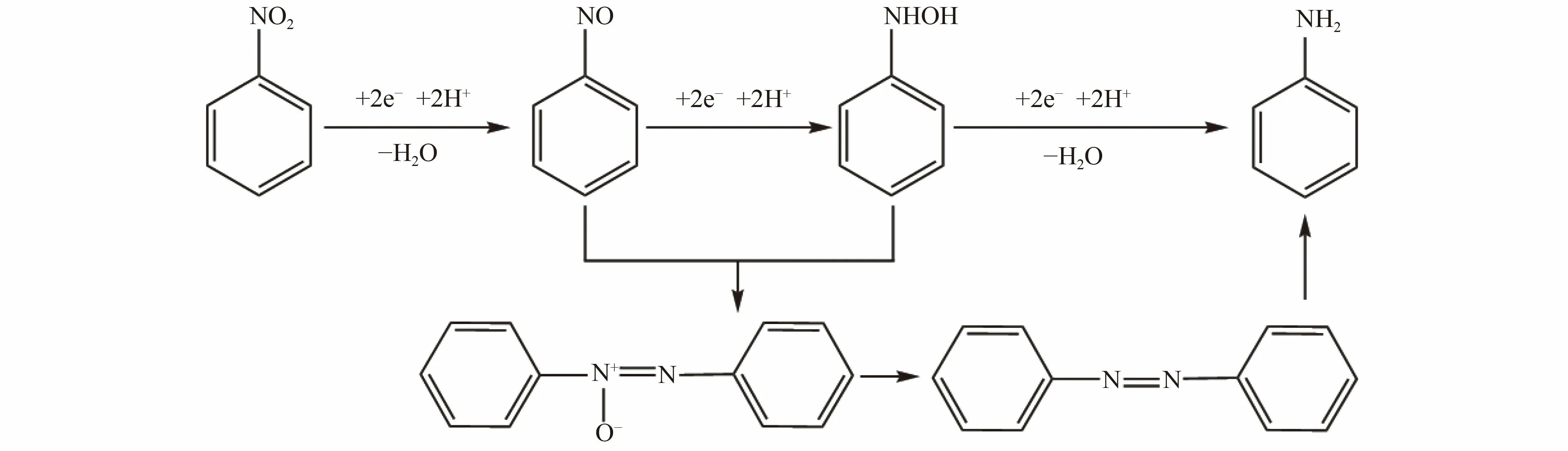
图11 硝基苯阴极还原降解路径Fig.11 Cathodic reduction degradation pathway of nitrobenzene
2.4 不同藻炭阳极表面微生物群落分析
不同藻炭修饰阳极MFC 阳极表面微生物Alpha 多样性分析结果如表3 所示。由表3 可知,与接种污泥相比,各电极表面微生物Ace 指数与Chao1 指数均有不同程度的降低;除CF 阳极MFC 外,各MFC 的Shannon 指数和Simpson 指数的下降也较为明显,说明其环境中物种多样性降低。横向对比各反应器发现,NaOH-AC700/CFMFC 中电极表面微生物各项指标均处于最低水平。研究表明,电化学性能好的MFC 中所形成的阳极生物膜上优势菌属的丰度相对较高,但是微生物群落多样性往往较低[41-43]。
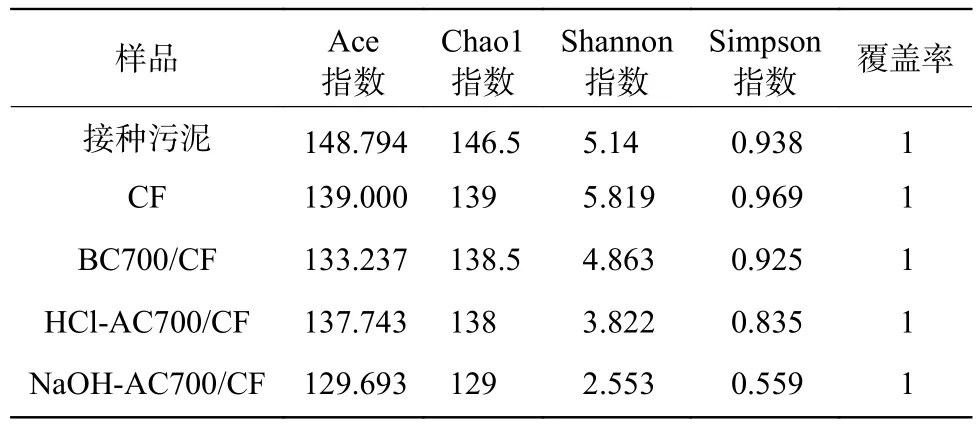
表3 生物种群Alpha 多样性分析Table 3 Alpha diversity analysis of biological population
图12 是驯化前后微生物主要属水平下的丰度(相对丰度排名前20)。从图12 可以看到,接种污泥驯化前后优势菌差异巨大,接种污泥中优势菌种主要为氢噬胞菌属(Hydrogenophaga)、脱氯杆菌属(Dechlorobacter)、固氮弧菌属(Azoarcus)和产乙酸嗜蛋白质菌(Proteiniphilum)等厌氧反应中常见菌属。经驯化培养后,各MFC 反应器中主要优势产电菌属为弧形杆菌属(Arcobacter)和铜绿假单胞菌属(Pseudomonas),还有少数反硝化细菌属(Lentimicrobium)和地杆菌属(Geobacter)等。
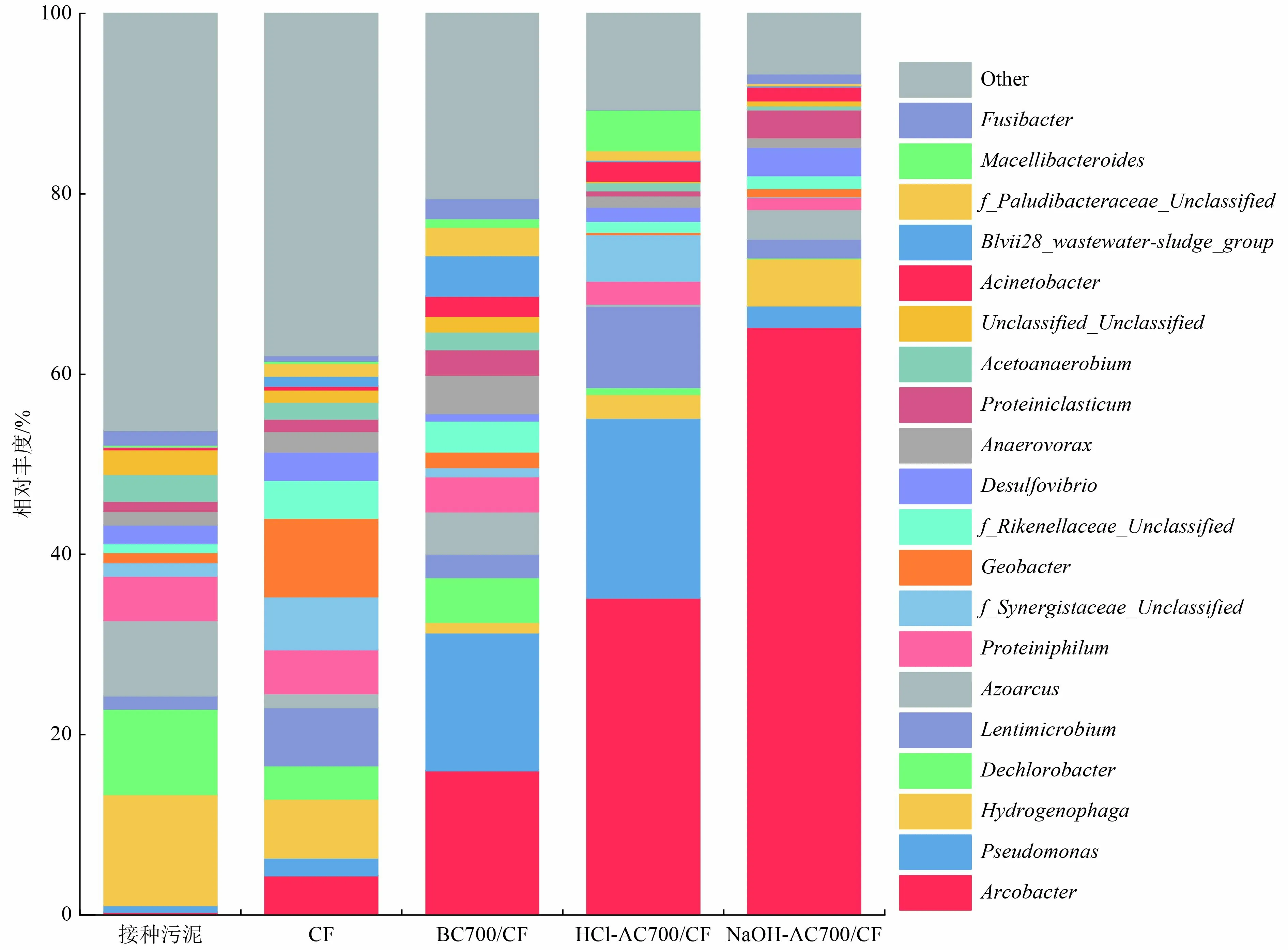
图12 藻炭修饰阳极微生物驯化前后属水平下菌群相对丰度(排名前20)Fig.12 Relative abundance of bacteria at genus level before and after acclimation of algal biochar modified anodes (top 20 genus)
弧形杆菌属是一种常见的以乙酸盐为电子供体的产电菌,能在短时间内迅速产生较大的功率密度,是一种颇具潜力的产电微生物[44]。阳极产电菌的相对丰度一定程度上反映了MFC 的产电性能,横向对比不同藻炭阳极表面优势菌属的相对丰度发现,NaOH-AC700/CF 阳极表面的产电菌属相对丰度最高,然后依次是HCl-AC700/CF 阳极、BC700/CF 阳极和CF 阳极。其中NaOH-AC700/CF阳极表面产电菌主要为弧形杆菌属,相对丰度为65%;而HCl-AC700/CF 阳极和BC700/CF阳极表面弧形杆菌属(Arcobacter)的相对丰度分别为35%和16%,铜绿假单胞菌属的相对丰度分别为20%和15%。这在一定程度上解释了NaOH-AC700/CF 阳极对MFC 启动与稳定运行时的促进效果。
阳极生物膜的微观形貌与微生物群落分析结果表明,藻炭阳极特别是NaOH-AC700/CF 对阳极产电微生物的富集与挂膜具有良好的促进作用。
3 结论
(1)NaOH-AC700 具有丰富的孔隙结构,其比表面积远大于未活化和酸活化藻炭,且使用NaOHAC700 修饰的炭毡电极拥有最多的电化学活性位点。NaOH-AC700/CF-MFC 的最大电压为0.67 V,最大功率密度为0.60 W/m2,功率输出比裸炭毡高出1 倍。
(2)通过对藻炭改性用以修饰MFC 的炭毡阳极,可提升MFC 的功率密度,加快了电子转移速率,从而促进了硝基苯的阴极还原。MFC 去除硝基苯的最好工况:硝基苯的初始浓度为0.8 mmol/L,以NaOH-AC700/CF 为阳极,电解液为pH=5 的PBS 缓冲液,该工况下硝基苯去除率达99.9%。
(3)NaOH-AC700/CF 阳极的优越性能归因于其较大的比表面积和生物相容性,有利于微生物的吸附和生长,其良好的导电性对电极表面及内部的电子传递有促进作用。弧形杆菌属和铜绿假单胞菌属是MFC 主要的产电菌。

