耐替加环素鲍曼不动杆菌中外排泵AdeB与Bfs过表达生物膜形成的关系
罗斌 李智伟 王倩 王昌敏
鲍曼不动杆菌是临床感染的重要致病因素之一,具有较高的死亡风险,近年来,在院内感染中一直占有很高的比例[1,2]。既往研究报道生物被膜形成和外排泵是鲍曼不动杆菌感染和异常抗生素抗药性的致病机制[3-5]。替加环素是一种新型静脉注射用四环素类抗感染药物,由惠氏制药公司从米诺环素衍生而来。替加环素是美国食物及药物管理局首个批准在临床使用的氨酰基抗生素,用于治疗复杂腹腔感染、皮肤感染及社区感染性肺炎[6,7]。替加环素对鲍曼不动杆菌有很好的治疗作用,但其耐药性越来越严重[8]。本研究重点研究替加环素耐药鲍曼不动杆菌的耐药外排泵基因和菌毛合成基因,分析了耐药基因AdeB和菌毛合成基因BfmS在生物被膜形成过程中的作用,希望找到抗替加环素鲍曼不动杆菌生物相关基因和外排泵基因之间的潜在关联。
1 材料与方法
1.1 菌种来源 该项试验于2018年10月至2019年10月从新疆维吾尔自治区人民医院医院临床检验所采集到了72株鲍曼不动球菌的临床标本,全部采用法国VITEK II Compact鉴定药敏仪和VITEK MS质谱仪设备进行鉴定,仪器均来自法国梅里埃公司,在标准麦康基琼脂培养基上生长48 h。检出菌种: 血21株(29.2%) ,尿13株(18.1%) ,痰38株(52.8%)。选取菌株时剔除同一例患者,同一来源的重复菌株和其他不动杆菌菌株。
1.2 药敏实验 根据美国食品及药物管理局推荐标准,临床实验室标准研究所(CLSI) ,并按照2019 CLSI S23m100临床实验室指南解释[10],依照标准操作程序,使用法国生物医药公司 vitek2复方测定替加环素的敏感性。用肉汤微量稀释法测定,替加环素的最低抑菌含量约为2(mg/L)。根据美国食品和药物管理局对替加环素敏感性的推荐标准,替加环素无敏感性被定义为MIC至少4 mg/L(敏感 MIC, 2 mg/L; 中介 MIC, >2 mg/L and <8 mg/L;耐药 MIC, 8 mg/L)。
1.3 生物膜与耐药基因检测
1.3.1 生物膜形成能力测试:测定后鲍曼保持不动杆菌生物膜的正常水平,并划线后置于血琼脂平板上培养,在第35℃培养后的18 h内。将单菌落悬浮于0.85%(w/V)盐水缓冲液中,制备1麦肯齐菌悬液。在96孔板的每孔中分别加入200 μl LB培养基和10 μl菌悬液,每株菌平行3孔,设阴性对照。35℃孵育48 h后,抽吸培养液,0.85%(w/V)生理盐水缓冲液洗净,每孔加99%(V/V)甲醇200 μl固定20 min,抽吸甲醇,0.85%(w/V)生理盐水缓冲液洗二次。孔中加入了1%的(w/V)结晶紫洗染液200 μl,保持10 min。经洗涤后,用蒸馏水洗涤2遍,然后晾干。各孔注入了95%乙醇200 μl,使结晶紫充分水解,用酶标仪于570 nm上读出吸光度值(A570)。吸光度值实验应变的正平均值等于负的控制,即菌膜的形成能力是正常的,和菌膜的形成能力的比较结果是由3个平行井的正平均吸光度值减去负面的平均值控制。
1.3.2 生物膜合成基因检测:基因组DNA制备取血琼脂平板上鲍曼不动杆菌菌落,按照制造商说明书(Qiagen,美国),在QIA symphony系统中使用QIA symphony DSP病毒/病原试剂盒分离基因组DNA。纯化后的基因组DNA溶液-20℃保存备用。利用常规PCR方法对8个生物膜合成相关基因和外排泵基因进行检测。扩增的扩增时间是:95℃变性2 min,后95℃变性30 s,后56℃再退火30 s,前72℃延长1 min,最后72℃再延长10 min,共35个周期。DNA模板在所有扩增。扩增产物经TAE缓冲液1%(w/V)琼脂糖凝胶电泳分析。本研究所的引物序列与扩增的长度。见表1。
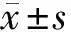
2 结果
2.1 药敏试验结果 本次试验共采集了经临床分离的鲍曼不动球菌共72株,结果全部达到多重耐药的指标,且耐药度普遍较好,其中又以碳青霉烯的耐药度最高,而耐药度最低的则是复方新诺明。见表2。
2.2 外排泵及耐药基因检测 用微量肉汤稀释法测定替加环素的药敏指标。72株菌株中,8个替加环素的MIC在0.04~17.26 mg/ml。根据美国食品药品监督管理局肠杆菌科对替加环素敏感临界点推荐标准,将鲍曼不动杆菌分为对替加环素耐药的鲍曼不动杆菌(TR-AN)组45株(62.5%)和对替加环素敏感的鲍曼不动杆菌(TS-AN)组27株(37.5%)。分别对blaOXA-23、blaOXA-58、blaOXA-51、AdeABC和AdeRS基因的转录水平分析表明,AdeB在TR-AN组的表达量比TS-AN组高6.1倍。与TS-AN组相比,TR-AN组AdeA、AdeC、AdeR、AdeS基因表达增加1.5倍、2.1倍、0.8倍、0.7倍。进一步对有或没有生物膜的TR-AN组进行AdeB基因转录水平分析,有生物膜形成的TR-AN组为94.6%,无生物膜的TR-AN组为37.5%。见图1。
注:M maker TR1-TR5 耐药组试验菌株
2.3 生物膜基因检测 在72份痰标本中,abaI,bfmS, bfmR, csuA, csuB和csuE的检出率均<20%,bap, bfmR和bfs的检出率分别为34.7%、41.6% 和68.1%。45株TR-AN菌株中在体外形成生物膜37株,TS-AN菌株仅形成4株。通过对膜形成组和非膜形成组bfs基因转录水平的研究,可以得出结论: 膜形成组bfs的表达水平比非膜形成组高9.3倍。见图2,表3。

图2 生物膜相关基因电泳与表达量比较

表3 TR-AN 和 TS-AN 生物膜基因组 PCR 检测结果 株(%)
2.4 生物膜与耐药性关系 临床分离的72株鲍曼不动杆菌生物被膜形成与替加环素耐药性之间的关系,其中57株在体外形成生物被膜。替加环素敏感组与替加环素耐药组细菌生物膜形成能力差异有统计学意义(P<0.05)。替加环素抗性组生物被膜形成能力明显强于敏感组(P<0.01)。用接受者操作曲线(ROC)评价替加环素对鲍曼不动杆菌生物膜形成的敏感性。生物膜形成曲线下面积(AUC)为0.92(95% 置信区间[CI]0.864~0.981),最佳截止水平为1.13,灵敏度和特异度为90.2%和82.1%。见图3。
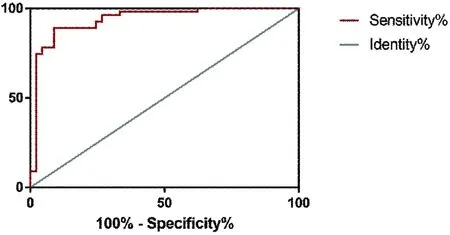
图3 ROC曲线图
3 讨论
不动杆菌根据其基因组可分为31种,已命名的有17种,其中鲍曼不动杆菌最为突出[10,11]。近年来,已成为医院中感染的重要致病菌,同时鲍曼不动杆菌还具有了高度的对环境适应能力,还有着获得外源性污染和不敏感基因的能力[12,13]。医院获得性感染已成为患者发病率和死亡率高的主要原因之一,特别是重症监护病房和免疫力低下的患者[14,15]。
鲍曼不动杆菌对替加环素耐药机制的研究主要集中在抗生素失活酶的产生、外排泵高表达、孔蛋白丢失、药物靶点改变以及生物膜形成等方面[16,17]。本研究中,38种(52.8%)均来源于抽吸物标本,表明了鲍曼不动杆菌在我院的住院患者中可导致塑料吸管传染和定植有关,或与细菌被人员操作引起的外源性感染传染有关,或与鲍曼不动杆菌在导管中定植所引起的内源性感染有关。而根据对医院细菌分布考察结果显示,医院的重症监护病区是鲍曼不动杆菌传染的最重要发病位点。这可能与重症监护病房患者病情危急,免疫功能低下,各种侵入性手术,留置管道广泛使用有关。抗生素引起的内源性和外源性感染是相关的[18,19]。研究证明生物被膜其实是鲍氏不动杆菌的一种重要保护机制,它能够附着于各种医疗器械的表层,进而导致感染[20]。生物膜使微生物产生了强烈的免疫逃逸功能,是引起慢性持续感染和难治性感染的主要因素[21,22]。目前,关于鲍曼不动杆菌生被膜产生功能和抗性间的联系,还存在着一些争论。不过Rodriguez等[23]指出,由于鲍曼不动杆菌生物膜的产生功能,对环丙沙星、头孢类药物噻肟、氨曲南等的耐药性明显增强。Espinal等[24]还证明,生物膜阳性菌株对常见抗生素的耐药性高于阴性菌株。生物被膜合成相关基因bfs存在于鲍曼不动杆菌全基因组中,其氨基酸序列含有与生物被膜形成相关的功能区[25]。在替加环素的耐药组中,由于bfs基因转录能力的增强,相关的菌膜形成能力也提高,而在鲍曼比不动杆菌生物膜形成组中外排泵基因对adeB的表达能力,也明显超过了鲍曼相比的不动杆菌生物膜形成组,所以,bap与bfs都与菌膜的形成能力有关。而bfs基因的阳性组耐药概率也明显超过相关基因的阴性组(P<0.05)。
因此,笔者认为我院分离的鲍曼不动杆菌对替加环素的耐药与bfs有显著相关性,而替加环素的耐药主要是由于外排泵基因adeB和bfs共表达所致。

