脊柱转移瘤的外科治疗进展
刘东明综述,唐晓杰,杨晓光,谭江威审校
近年来,受人口老龄化、肿瘤发病增加、肿瘤诊疗水平提高等因素影响,肿瘤转移诊断率也呈逐年上升趋势[1-2]。骨骼是除肝、肺之外的第3大常见的肿瘤转移部位,脊柱转移在骨转移中较常见,约20%的脊柱转移表现为椎管侵犯和脊髓压迫症状[3]。脊柱转移大多数发生于胸椎(70.9%),其次为腰椎(23.6%)和颈椎(20.0%)[4]。发生脊柱转移的肿瘤常见于乳腺癌、前列腺癌、肺癌、肾癌[5]。一般出现与神经功能受损、脊柱生物力学不稳相关的症状及体征时需手术干预[6]。研究[7]显示,存在神经功能受损的脊柱转移瘤患者的总生存率较低且生活质量较差。因此,及早诊断和选择合适手术方式对脊柱转移肿瘤的治疗至关重要,现就脊柱转移瘤的影像学检查、手术指针及禁忌证、预后评分系统、手术入路及方式、体外放疗、并发症防治等方面的研究进展进行综述,以期为临床选择合适的手术方案提供帮助。
1 脊柱转移瘤的影像学检查
脊柱转移瘤的诊断方法包括询问病史、体格检查、肿瘤标志物检测、病理组织活检、影像学检查等,其中影像学检查的准确性较高,可为病灶切除的部位及范围提供依据。对于癌症患者新发背痛和(或)新出现的神经功能损伤应立即进行脊柱影像学检查。MRI检查是诊断硬膜外脊髓压迫(ESCC)的金标准,其灵敏度为93%,特异性为97%[8]。PET检查灵敏度及准确性高,但费用高、解剖清晰度较MRI差,且可能出现假阳性结果[9]。 PET-MRI是诊断肿瘤的一项新技术,其与PET-CT相比在检测骨转移的准确性和可靠性方面具有相似性,但可减少约79.7%的辐射损伤[9]。
2 脊柱转移瘤的手术指针及禁忌证
脊柱转移瘤手术的目的是恢复或保留神经功能、重建脊柱稳定、缓解脊柱肿瘤相关疼痛、矫正脊柱畸形等。此外,手术还可将脊髓从肿瘤中分离进行安全的辅助放疗,以获得满意的疗效。脊柱转移瘤有如下手术指针[10-11]:① 放疗后肿瘤仍有进展的证据,包括影像学检查、临床表现等;② 放射期间神经功能恶化;③ 脊髓受压;④ 顽固性疼痛;⑤ 单发孤立的脊柱转移瘤;⑥ 因无法诊断明确,需获取病理组织以明确诊断;⑦ 放射性耐药肿瘤,包括黑色素瘤、肉瘤、肾癌、结肠癌等;⑧ 有脊柱不稳定的证据,包括椎体塌陷高度>50%、后凸畸形、平移畸形(半脱位)、肿瘤涉及前柱和后柱等。需要注意的是:对于伴ESCC症状者应尽早接受减压手术,可显著提高生存率,且在发生运动功能障碍的7 d内进行手术可延长患者生存期[12]。脊柱转移瘤手术的绝对禁忌证为患者预期寿命<3个月,相对禁忌证包括严重的心血管疾病、肺部疾病、内脏转移及超过48 h的完全性截瘫。
3 脊柱转移瘤的预后评分系统
脊柱转移瘤患者预期寿命的评估是手术与否的先决条件,为了更好地评估脊柱转移瘤患者的预期寿命,各种预后评分系统应运而生。目前国际上常用的预后评分系统是Tomita评分和修订版Tokuhashi评分。2001年Tomita et al提出以原发肿瘤恶性程度、内脏转移情况、骨转移情况作为重要预后因素,总分越低预后越好:2~3分者建议广泛或边缘肿瘤切除以达到长期的局部控制;4~5分者建议进行边缘性或囊内肿瘤切除以达到中期的局部控制;6~7分者建议进行姑息手术治疗;8~10分者不建议手术,建议行临终关怀及支持治疗。2005年修订版Tokuhashi评分系统包括如下项目:一般情况(根据卡氏评分确定),除脊柱外的骨转移数,受累椎体数量,主要脏器转移情况,原发肿瘤部位,脊髓损害情况(根据Frankel神经功能评分确定)。除原发肿瘤部位评分为0~5分外,其他各项评分均是0~2分,总分15分。根据总分可将预后情况分为3类:预后最差(0~8分),患者预期生存时间<6个月,建议非手术治疗;预后中等(9~11分),患者预期生存时间6~12个月,建议姑息手术治疗;预后最好(12~15分),患者预期生存时间>12个月,建议手术切除肿瘤。Faye et al[13]研究认为,Tomita评分和修订版Tokuhashi评分用于评估肺癌脊柱转移患者的准确性均不可靠。Mezei et al[14]的一项单中心回顾性研究发现,对修订版Tokuhashi评分不建议行手术治疗的脊柱转移瘤患者进行手术治疗,不仅患者疼痛能得到显著缓解,而且其运动功能及脊柱稳定性也得到了改善。Denisov et al[15]对138例脊柱转移瘤患者术后生存率进行回顾性分析后认为,Tomita评分比其他评分系统的预测效果更佳。因此,对于脊柱转移瘤患者选择何种预后评分系统尚未达成共识,外科医师除了要考虑预后评分系统外,还应与其他评分系统一起综合考虑,如脊柱肿瘤不稳定评分、ESCC分级、Tomita外科分型等,再结合患者的具体情况以确定最佳的手术治疗方式。
4 脊柱转移瘤的手术入路
脊柱转移瘤的传统手术入路包括前路、后路、前后联合入路,可根据脊柱转移节段水平、肿瘤侵袭范围、脊髓受压程度等因素进行选择。脊柱转移瘤由椎体向背侧生长突至椎管通常是导致ESCC的主要原因。前路手术的优势在于可以从前方直接到达带瘤椎体,清除病灶后用短节段固定装置对前柱稳定性进行重建,缺点是脊柱前方的骨性结构(胸骨、肋骨)及重要脏器的阻隔会增加手术操作的困难,容易引起相关并发症。后路手术适用于椎体后方病灶的处理,可避免前路手术相关并发症的发生。研究[16]显示,后路较前路手术具有更短的重症监护时间、更低的手术相关并发症发生率。因此,后路手术是达到脊柱减压和稳定固定目的的常用方式[17]。近年来,经椎弓根入路越来越受到脊柱外科医师的欢迎,通过该入路可暴露后纵韧带并对脊髓前方受侵犯的椎体进行切除和减压。研究[18]显示,经椎弓根入路分离手术联合立体定向放疗(SBRT)治疗脊柱转移瘤,术后1年局部控制率>95%,且对放疗不敏感的肿瘤也有效。前后联合入路相较于单一入路可更彻底地清除病灶和减压,但存在创伤大、手术时间长、手术风险高、手术技术难度大、术后并发症多、患者无法耐受等缺点。为了克服开放入路治疗脊柱转移瘤的这些缺点,经皮椎体后凸成形术(PKP)、经皮椎弓根螺钉固定技术(PPSF)、经皮穿刺微波消融等微创手术的应用越来越广泛。与传统透视引导下的微创手术相比,光学导航机器人技术具有更好的辅助效果,可以缩短手术时间、减少术中透视次数、降低透视辐射量、提高穿刺准确率[19-22]。
5 脊柱转移瘤的手术方式
脊柱转移瘤手术方式的选择受肿瘤侵袭范围、受累脊柱水平、脊髓受压程度及患者预期寿命、身体状况、自身意愿等多种因素影响。2017年国际脊柱肿瘤研究小组(GSTSG)总结归纳了常见的脊柱转移瘤外科手术策略[23],见图1。
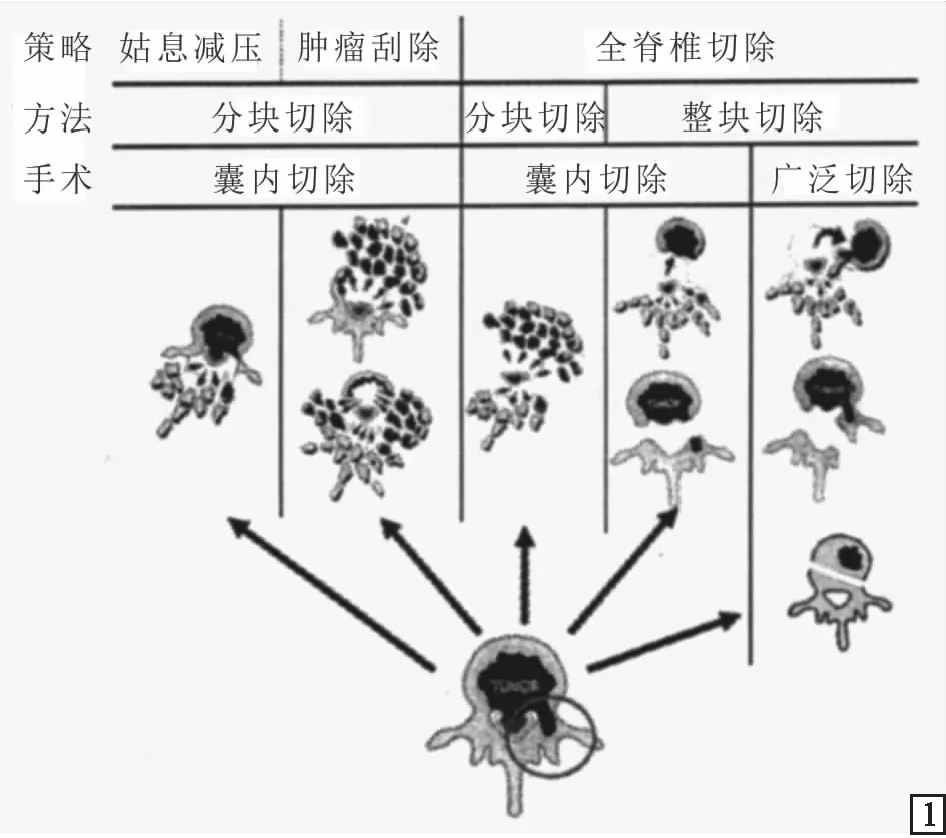
图1 GSTSG总结归纳的脊柱转移瘤外科手术策略[23]
5.1 姑息减压术目前,脊柱转移瘤手术大多数都是姑息性的,患者预期寿命为3~6个月就可以采用姑息手术提高生活质量[12]。以往单纯椎板减压切除术是脊柱转移瘤伴有ESCC患者的主要手术方式,它可以简单有效地扩大椎管容积,改善患者疼痛和神经压迫症状,但无法解除来自椎体后方肿瘤的压迫,还会对后方椎板等结构造成损伤而影响后柱的稳定性。另外,该手术对转移瘤局部的远期控制效果差。Suvithayasiri et al[24]对伴有ESCC的20例脊柱转移瘤患者在不进行前路融合或重建的情况下仅通过后路姑息减压和内固定手术进行治疗,结果显示53.33%的患者神经功能改善了至少1个Frankel级,疼痛也能得到明显缓解。因此,对于预期寿命有限、身体耐受差的脊柱转移瘤患者,姑息减压术可以作为手术治疗的代替方案。
5.2 肿瘤刮除术又称为减瘤手术,指在病灶内将肿瘤组织分块切除,属于囊内切除。与单纯椎板切除减压术相比,肿瘤刮除术可以切除椎体内病灶,解除神经压迫,使减压更充分,疼痛更快缓解,是目前治疗脊柱转移瘤常用的手术方式。Delgado-López et al[18]提出的分离手术可对脊髓周围进行360°环形减压,分离得到1个安全空间,便于联合SBRT进行治疗,即使术中无法完全切除肿瘤,也能达到良好的肿瘤局部控制效果。
5.3 全脊椎整块切除术(TES)Tomita et al(1989年)对包括脊柱转移在内的恶性脊柱肿瘤患者实施了TES,并由其团队逐渐完善和标准化,对局部肿瘤控制效果已得到临床的广泛认可[25-26],是目前较受欢迎的脊柱肿瘤治疗技术之一。TES的适应证包括:① 脊柱孤立转移或可根治的跳跃性脊柱转移;② 累及连续3个以内脊椎节段的肿瘤;③ 原发癌部位无肿瘤迹象;④ 无其他转移,或即使有转移,也是稳定可控的;⑤ 患者一般状况良好(美国东部肿瘤协作组评分≤3分)。Higuchi et al[26]研究表明,与减瘤手术相比,行TES的患者生存期更长、局部复发率更低。对于行TES的脊柱转移瘤患者,前柱稳定重建的材料主要包括血管化或非血管化自体移植支架、异体结构支架、笼式系统(钛、可消耗钛、可堆叠碳笼)、骨水泥、3D打印椎体假体;后柱稳定系统主要采用钉棒系统进行多节段椎弓根内固定。Igarashi et al[27]回顾分析了91例TES术中接受液氮冷冻自体移植的脊柱转移瘤患者资料,结果显示TES术后冷冻自体移植局部复发率为11.0%,且局部复发位置均不位于液氮处理过的脊椎中,多因素分析显示放疗史是局部复发的唯一危险因素。说明液氮冷冻自体移植用于前柱重建的方案是有潜力的,但仍需更长时间的随访和研究来证明其安全性。在单节段椎体缺损重建中使用钛笼就足以支撑前柱,但在多节段椎体缺损重建中,3D打印椎体假体的优势更大,适用于不同长度的前柱重建且并发症少。Tang et al[28]对27例TES术后使用3D打印椎体假体进行前柱重建的患者资料进行回顾性研究显示,短期随访中3D打印椎体假体可为患者提供稳定的前柱支撑。
5.4 脊柱微创手术脊柱转移瘤患者常发生多节段的脊柱转移并伴有诸多合并症和(或)全身多处骨转移,患者一般身体状况较差,难以耐受开放手术。因此,微创手术逐渐成为一种可行的替代治疗手段。与传统开放手术相比,微创手术具有出血量少、住院时间短、能保留后方结构和椎旁肌的优点,已成为脊柱转移瘤的重要治疗手段[29-30]。
5.4.1椎体成形术 主要包括经皮椎体成形术(PVP)和PKP。这两种手术均能有效缓解肿瘤局部疼痛,恢复压缩椎体高度,增加脊柱稳定性,防止椎体进一步塌陷。脊柱转移瘤伴病理性骨折PVP术后最常见的并发症为骨水泥渗漏。研究[31]显示,Tomita分型和椎体后壁破坏程度是骨水泥渗漏的独立危险因素。因此,术前应对脊柱肿瘤Tomita分型和椎体后壁及椎体骨质破坏程度进行充分评估,防止出现骨水泥渗漏引发严重并发症。与PVP相比,PKP具有球囊装置,可以更好地撑开被压缩椎体,更好地恢复椎体高度,在一定程度上可减少骨水泥渗漏,但是花费较PVP高[32]。椎体成形术已被临床证明是安全有效的,对于伴有病理性骨折的脊柱转移瘤是姑息减压治疗的一种替代方式。
5.4.2胸腔镜手术(VAST) 是指在胸腔镜辅助下显示并放大T1~12的整个腹侧脊柱,以便进行椎体切除、脊髓减压、脊柱稳定重建的技术,一般用于治疗胸椎转移瘤。但由于存在手术操作难度大、手术时间长以及术中大出血控制困难等问题,尚未被广泛运用[33]。
5.4.3PPSF 是指在影像系统引导下经皮置入椎弓根螺钉,能有效避免开放手术造成的软组织广泛剥离。对于严重脊柱不稳且耐受力差无法进行开放手术的脊柱转移瘤患者,PPSF成为微创治疗的一种可能。Silva et al[34]研究表明,PPSF联合放疗或化疗中,有一半的患者症状得到改善且并发症发生风险低,因此,其认为PPSF可作为微创姑息治疗脊柱转移瘤的一个潜在选择。Rao et al[35]根据修订版Tokuhashi评分对PPSF的应用进行了如下简单分类。① 后路正中或旁正中小切口开放减压和上、下单节段PPSF固定,适用于预期寿命短(<6个月)的患者。② 后路正中或旁正中小切口开放减压和(或)骨水泥椎体置换和2节段PPSF固定,适用于预期寿命中等(6~12个月)的患者。③ 后路小切口开放360°减压、前路重建、后路2节段固定,适用于预期寿命长(>12个月)的患者。
5.4.4射频消融(RFA) 是指在影像系统引导下将等离子RFA套管经皮穿刺到瘤灶并发出高频率的射频波(450~500 kHz),从而激发病灶周围组织细胞进行离子震荡产生较高热量(50~100 ℃),使肿瘤组织固缩、血管闭塞的一种技术。RFA作为杀灭肿瘤细胞的一种手段,已被广泛用于骨与软组织肿瘤的临床治疗中[36]。Shawky et al[37]研究显示,RFA是一种安全、实用、有效和可重复的姑息治疗技术,它能以最小的侵入方式减轻患者疼痛和维持脊柱稳定性,且不会增加明显手术创伤或并发症。
6 脊柱转移瘤的体外放疗
体外放疗在缓解脊柱转移瘤患者疼痛方面具有基础性作用,大多数患者对其耐受性良好,且还可防止肿瘤局部复发和生长,其安全性和有效性已得到证实[38]。常规体外放疗的效果高度依赖于肿瘤组织对放疗的敏感性,例如鳞状细胞癌对放疗高度敏感,局部姑息放疗能迅速缓解骨痛,不良反应少,疗效好,但对放疗不敏感的肿瘤如肾细胞癌、黑色素瘤、骨肉瘤、甲状腺癌、结肠癌等,治疗效果较差。Sahgal et al[39]研究表明,低剂量的常规体外放疗具有短期姑息益处。因此,对于预期生存期较短(<3个月)的脊柱转移瘤患者,可采用姑息体外放疗。SBRT是一种新的治疗技术,与传统体外放疗相比,其放射部位控制更加精准,生物学有效剂量比传统放疗高约3倍,且这种剂量引起的肿瘤损伤似乎使疗效不再依赖于肿瘤组织的敏感性。Smith et al[40]研究认为,SBRT在局部疼痛缓解和肿瘤控制方面较传统体外放疗有更好的效果,且患者对SBRT有更好的耐受性,严重不良反应相对发生较少。但在脊髓受压的情况下SBRT是不可行的,容易引起放射性脊髓损伤并增加椎体骨折风险,因此可通过外科手术对受压迫脊髓进行环形减压,隔离出一定的安全空间使SBRT变得可行。Igarashi et al[27]对91例行全脊椎切除术患者的局部复发因素研究显示 ,体外放疗史是局部复发的唯一危险因素。因此,治疗脊柱转移瘤时应尽量避免对放射低敏感性肿瘤进行简单照射,对于有体外放疗史者需考虑其局部复发的高风险,应适当扩大肿瘤的切除范围并做好术后随访。
7 脊柱转移瘤的并发症防治
7.1 减少术中出血量Truumees et al(2010年)报道,约有>60%的脊柱转移瘤病灶是高血管性的。因此,术前可以考虑进行动脉栓塞治疗,以降低术中出血并减少内镜视野遮挡,从而缩短手术时间,提高手术成功率。研究[41]表明,术前栓塞能明显减少肾细胞癌组和混合原发肿瘤组的术中出血量。另有研究[42-43]显示,术前栓塞治疗组与未栓塞组的术中出血量比较差异无统计学意义。因此,外科医师应根据转移瘤血管造影结果,评估脊柱转移瘤患者是否有必要进行术前栓塞治疗,以减少术中出血量、缩短手术时间。
7.2 术中自体血回收自体回收血中因含有循环肿瘤细胞,在回输过程中可能引发肿瘤的转移与播散。因此,异体血仍是术中输血的主要来源,但异体输血也存在传播感染性疾病、免疫抑制、输血并发症等相关风险。术中红细胞回收是解决异体输血问题的一种新方法。Kumar et al[44]研究显示,术中回收的红细胞和回收后过滤的血液样本在培养后都没产生癌细胞集群,表明术中红细胞经回收处理后没有活的癌细胞,但此项技术的安全性仍有待进一步研究。
7.3 神经系统早期康复治疗脊柱转移伴神经功能受损者在脊柱稳定性重建后进行早期活动或物理治疗对神经功能康复是很有必要的。文献[45-46]显示,对脊柱转移瘤患者术后早期康复管理是有效的,有助于缓解疼痛、预防并发症的发生,且能增强功能的独立性,改善患者生活质量、心理健康和生存状况。
8 总结与展望
近年来随着医疗技术的进步,脊柱转移瘤患者的生存时间进一步延长。对脊柱转移瘤患者的管理需要多学科团队协作,包括外科团队、放射/医学肿瘤团队等。术前评估除了考虑原发肿瘤和预期寿命以外,患者一般状况及合并症等问题也需要考虑,以决定是否适合手术及选择合理术式。改善脊柱转移瘤患者症状、提高其生存质量仍是目前手术治疗的重点。

