载抗生素人工骨联合负压封闭引流治疗骨折内固定术后早期感染
杨瑞芳,王新卫,王石林,郭再冉,钟文龙,张 磊,陈江非
内固定治疗骨折时,感染是其常见并发症,发生率为0.4%~16.1%[1]。感染的发生不仅严重影响骨折愈合,而且治疗不当可迁延为慢性骨髓炎,严重者甚至截肢[2-3]。目前尚无统一的治疗标准,传统的非手术治疗感染复发率约为75%,单纯清创治疗的1年随访治愈率仅有79.81%,且上述2种方法治疗周期长、医疗花费高[4]。此外,骨折尚未愈合的情况下发生早期感染,内固定的去留备受争议。若取出固定改为外固定,则不利于骨折良好复位和愈合,且会增加护理工作量和钉道感染风险;若保留内固定,则会增加感染控制难度和复发率[5]。因此,选择合适的治疗方案和准确评估内固定的去留是治疗感染的关键。载抗生素人工骨或负压封闭引流(VSD)均已广泛用于骨感染疾病的治疗,但关于两者联合且保留内固定治疗内固定术后早期感染的文献报道较少。2017年2月~2020年2月,我们在术中尽量保留内固定的前提下,采用载抗生素人工骨联合VSD治疗28例骨折内固定术后早期感染患者,疗效满意,报道如下。
1 材料与方法
1.1 病例选择纳入标准:① 2周内曾接受过骨折内固定术治疗,术后感染就诊于河南省洛阳正骨医院(河南省骨科医院);② 年龄18~65岁;③ 符合骨折内固定术后早期感染诊断标准。排除标准:① 全身多发骨折;② 髓内针固定术后感染;③ 合并心、肝、肾等重要脏器疾病;④ 合并糖尿病;⑤ 患者依从性差或失访。
1.2 骨折内固定术后早期感染诊断标准[6]满足以下之一可诊断为骨折内固定术后早期感染。① 临床症状与体征:有发热、乏力等全身症状,手术切口部位红肿、疼痛、皮温升高,切口愈合不良,有脓性分泌物或窦道形成;② 影像学检查:CT、MRI或超声检查显示有感染病灶,MRI检查可清晰显示骨与软组织感染部位;③ 白细胞计数(WBC)、红细胞沉降率(ESR)、C-反应蛋白(CRP)、降钙素原(PCT)等血清学炎性指标明显升高;④ 细菌培养或组织病理学检查呈阳性。
1.3 病例资料本组28例,男19例,女9例,年龄25~64岁。受伤原因:交通事故伤13例,坠落伤9例,压砸伤6例。骨折部位:肱骨3例,桡骨2例,股骨5例,髌骨1例,胫骨12例,跟骨5例。患者入院后完善术前常规检查,采集感染病灶分泌物做细菌培养和药敏试验,结果为2例阴性,26例阳性,其中4例培养出2种细菌,共分离出病原菌30株:金黄色葡萄球菌11株,表皮葡萄球菌5株,大肠埃希菌4株,铜绿假单胞菌5株,鲍曼不动杆菌2株,阴沟肠杆菌3株。根据培养结果选用敏感抗生素治疗。内固定术至因感染入院时间5~14 d。
1.4 手术方法全身麻醉或腰硬联合麻醉。患者仰卧位,患肢上止血带。将无菌亚甲蓝稀释液注入感染病灶或窦道,沿原手术切口切开皮肤,避开重要神经及血管,剥离软组织,充分显露感染组织和内固定物。若打开病灶发现骨与软组织感染严重,需行内固定取出术,清创完成后更换为外固定架固定,以尽可能一期控制感染。彻底清除感染坏死组织直至出现渗血样新鲜组织,用刮勺刮除内固定物表面异物,留取多部位深部感染组织进行术中细菌培养及药敏试验。用生理盐水和双氧水反复冲洗病灶3次,再用碘伏原液浸泡的纱布擦拭内固定物10 min。二次铺巾,更换手套及手术器械。在无菌手术台上制备载抗生素硫酸钙人工骨,根据术前细菌培养及药敏试验结果选择载药抗生素,在模具上做成ø 3~5 mm的圆柱状载抗生素硫酸钙颗粒,待颗粒硬化后将其均匀置入感染病灶内。若清创后缺损较大,可直接置入块状载抗生素硫酸钙人工骨以填补空腔。放置1根引流管,逐层缝合切口。根据切口大小将VSD敷料泡沫修剪合适后覆盖,用手术缝线简单固定,再用具有生物通透性的薄膜封闭整个创面。将VSD引流管的进水口和出水口临时接入负压引流球,待患者返回病房后接入负压吸引器,压力保持在65 kPa左右。
1.5 术后处理根据术中细菌培养及药敏结果继续静脉滴注敏感抗生素1~2周,然后改口服4~6周。保持引流通畅,密切观察VSD引流液颜色及性质,持续引流7~14 d并定期检查血清学炎性指标,待WBC、ESR、CRP、PCT等指标逐步降至正常,且连续3次引流液都未培养出细菌后,拆除VSD装置。术后3 d患者在医师指导下进行患肢的主动及被动功能锻炼,按揉双下肢,防止卧床期间下肢深静脉血栓形成。定期摄X线片复查,观察骨折愈合情况。
1.6 观察指标① 感染控制情况:术后7 d与术前的血清学炎性指标变化比较;② 围手术期及随访情况:术中内固定保留情况,住院时间,骨折愈合时间,感染复发情况。

2 结果
患者均获得随访,时间12~20(15.32±2.26)个月。
2.1 感染控制情况一期感染控制率100%。WBC、ESR、CRP、PCT:术后7 d均较术前明显降低,差异均有统计学意义(P<0.01),见表1。
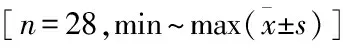
表1 术后7 d与术前血清学炎性指标比较
2.2 围手术期及随访情况术中3例因内固定周围骨组织感染严重,行内固定取出并更换为外固定架,二期行自体髂骨植骨;其余25例内固定均保留成功,内固定保留率为25/28。住院时间18~37(22.36±3.98) d。骨折均愈合,时间4~13(6.92±2.11)个月。26例切口均一期愈合;2例软组织缺损严重,经抗感染治疗后二期行局部转移皮瓣术,术后皮瓣成活,皮肤缺损修复。1例术后5个月感染复发,感染复发率1/28,再次行清创置入载抗生素人工骨治疗,感染得到控制,切口愈合良好。末次随访时,28例患者患肢功能均基本恢复正常。
2.3 典型病例见图1~6。
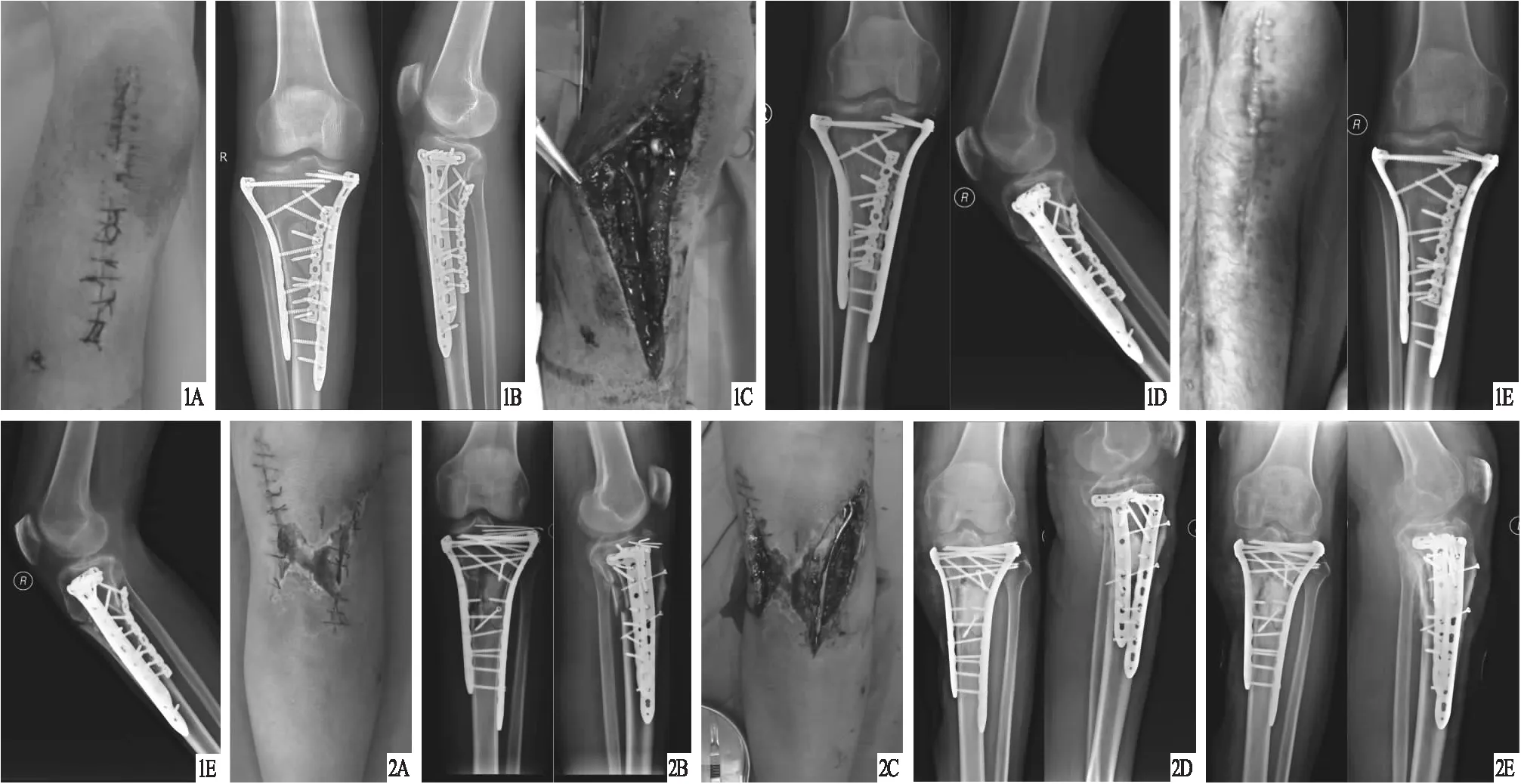
图1 患者,男,44岁,右胫骨平台骨折内固定术后早期感染,采用载抗生素人工骨联合VSD治疗 A.术前大体外观,缝线在位,切口愈合不良;B.术前X线片,显示内固定在位,骨折端对位对线良好;C.术中用无菌亚甲蓝稀释液染色后的感染病灶外观;D.术后X线片,显示载抗生素人工骨粒的点状高密度影;E.术后3个月大体外观及X 线片,显示感染已控制,切口愈合良好,骨折线模糊,载抗生素人工骨粒已降解 图2 患者,男,43岁,左胫骨平台骨折内固定术后早期感染,采用载抗生素人工骨联合VSD治疗 A.术前大体外观,切口愈合不良,局部皮肤红肿、坏死、破溃、渗出;B.术前X线片,显示内固定在位,骨折线清晰,骨折端对位对线可;C.术中用无菌亚甲蓝稀释液染色后的感染病灶外观;D.术后X线片,显示载抗生素人工骨块的斑片状高密度影;E.术后3个月X线片,显示骨折端对位对线可,内固定在位,载抗生素人工骨块部分降解
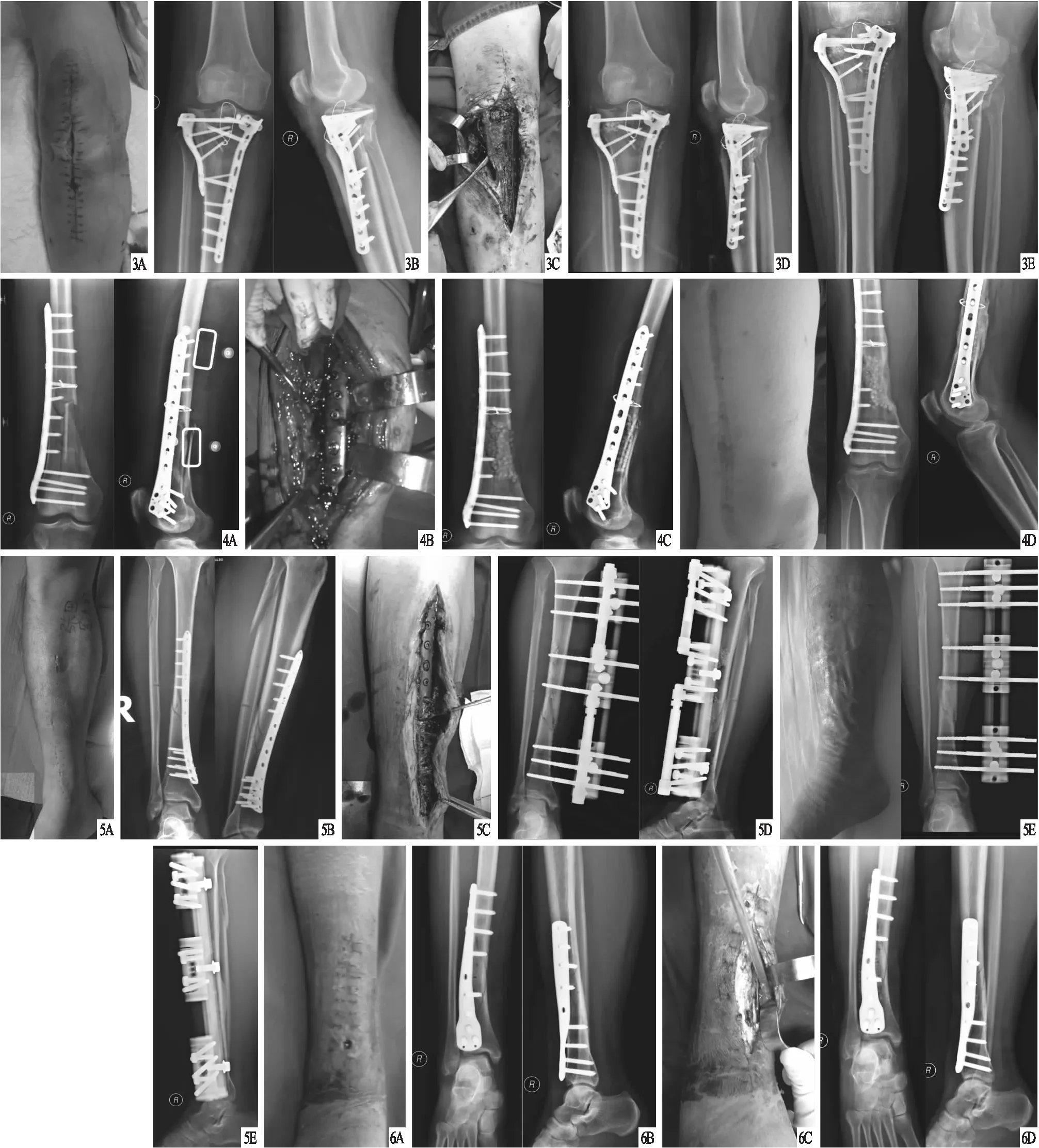
图3 患者,女,55岁,右胫骨平台骨折内固定术后早期感染,采用载抗生素人工骨联合VSD治疗 A.术前大体外观,切口开裂、破溃、渗出;B.术前X线片,显示内固定在位;C.术中用无菌亚甲蓝稀释液染色后的感染病灶外观;D.术后X线片,显示内固定在位,骨折端对位对线可,载抗生素人工骨粒的点状高密度影;E.术后3个月X线片,显示内固定在位,骨折线模糊,载抗生素人工骨粒部分降解 图4 患者,男,48岁,右股骨骨折内固定术后早期感染,采用载抗生素人工骨联合VSD治疗 A.术前X线片,显示股骨远段骨质不连接,内固定在位,骨折端对位对线可;B.术中用无菌亚甲蓝稀释液染色后的感染病灶外观;C.术后X线片,显示骨折断端载抗生素人工骨粒的点状高密度影;D.术后3个月大体外观及X线片,显示感染已控制,切口愈合良好,骨折端对位对线好,载抗生素人工骨粒部分降解 图5 患者,男,41岁,右胫骨骨折内固定术后早期感染,采用载抗生素人工骨联合VSD治疗 A.术前大体外观,局部皮肤破溃、渗出;B.术前X线片,显示骨折线清晰,骨折端对位对线可;C.术中用无菌亚甲蓝稀释液染色后的感染病灶外观;D.因骨组织感染严重,行内固定取出并更换为外固定架后X线片,显示外固定架在位,骨折端对位对线好,载抗生素人工骨粒的点状高密度影;E.术后3个月大体外观及X线片,显示感染已控制,切口愈合良好,外固定在位,骨折线模糊,载抗生素人工骨粒部分降解 图6 患者,女,44岁,右胫骨骨折内固定术后早期感染,采用载抗生素人工骨联合VSD治疗 A.术前大体外观,局部皮肤破溃、渗出,切口愈合不良;B.术前X线片,显示内固定在位,骨折端对位对线可;C.术中用无菌亚甲蓝稀释液染色后的感染病灶外观;D.术后X线片,显示内固定在位,骨折端对位对线可,骨折线可见,载抗生素人工骨粒的点状高密度影
3 讨论
3.1 骨折内固定术后早期感染保留内固定的可行性及彻底清创的重要性骨折内固定术后发生感染时,内固定的取出与保留是首要考虑的问题,需结合多种因素综合考虑,主要包括骨折固定的稳定性、感染致病菌的类别与毒力、宿主的生理状态、感染部位及持续时间、软组织覆盖条件等。其中,感染持续时间影响细菌生物膜的形成与状态,是决定内固定去留的关键依据[7]。目前临床治疗骨折内固定术后早期感染通常比较激进,一旦确认感染就早期取出内固定更换为外固定,以低度恶性肿瘤为标准,广泛切除感染波及的组织,这无疑是控制感染的有效策略。但对于术后早期感染,骨折尚未愈合,若取出内固定更换为外固定,不仅会影响骨折愈合和增加钉道感染的风险,而且也可能导致骨不连、肌肉萎缩、关节僵硬等并发症的发生[8]。宋元 等[9]研究认为,术中彻底清创、反复多次用碘伏纱布涂擦内固定物、术后持续冲洗引流能有效提高感染治愈率。彻底清创是治疗骨感染的基础,也是降低复发率的关键,临床医师需严格把握清创的标准和时机。目前,对于清创的标准尚存争议[10-11],普遍认为感染部位正常组织也可能受到细菌侵袭,故可将感染病灶视作低度恶性肿瘤,采取扩大范围的激进式清创方式,直至正常组织5 mm处,以组织出现渗血样辣椒征为标准。为明确感染的范围与界限,达到彻底清创的目的,笔者的清创经验是,首先沿切口或窦道注射无菌亚甲蓝,根据组织染色情况区分感染组织,以彻底清除感染及坏死组织,并用刮勺刮除内固定物及骨质表面的脓苔,然后用双氧水和生理盐水反复冲洗病灶3次,再用碘伏原液浸泡的纱布擦拭内固定物10 min,本组内固定保留率为25/28。说明对于骨折内固定术后早期感染,严格把握适应证,彻底清创后经合理规范化治疗,术中保留内固定是可行的。需要注意的是,清创时机宜早不宜晚。研究[12]显示,在确诊当日即接受手术患者的住院时间和感染复发率均优于延迟清创超过7 d的患者。
3.2 载抗生素人工骨联合VSD治疗的优势① 载抗生素人工骨。既往临床主要通过口服或静脉给药等全身应用抗生素方式治疗骨感染疾病,但易导致细菌耐药和全身毒性等不良反应,且局部血药浓度低,感染治疗失败率和复发率较高[13]。局部载药抗生素缓释系统可弥补以上不足,已成为骨感染治疗的研究热点[14]。本研究中使用的载抗生素人工骨为硫酸钙,其不仅能够填补清创后骨与组织缺损留下的空腔,诱导骨再生,局部稳定释放高浓度抗生素,而且有较好的生物相容性、低细胞毒性及无需再次手术取出的优势[15]。在人工骨中加入的抗生素选用方面,使用敏感抗生素已成为骨感染治疗的共识。既往研究[5]表明,金黄色葡萄球菌等革兰阳性菌是骨折术后早期感染的主要致病菌。本研究也得到相似结论,术前细菌培养得到30株病原菌中11株为金黄色葡萄球菌。因此,革兰阳性菌一般选用万古霉素联合庆大霉素;革兰阴性菌一般选用美罗培南;若术前未培养出细菌,可经验性选用广谱类抗生素,之后再及时调整。笔者通常将载抗生素的硫酸钙人工骨制备成ø 3~5 mm的圆柱状颗粒,若缺损较大,也可直接制成块状,既能增加人工骨与病灶的接触面积,又可加快抗生素起效和降解速度,更好发挥控制感染作用。② VSD。通过将高塑性的医用泡沫和特殊生物膜辅料覆盖切口,使切口局部形成封闭环境,可减少术后换药和创面暴露,降低再次感染风险,同时能减轻消毒剂对皮肤及微血管的灼伤刺激,利于新生肉芽组织生长[16],而且持续负压引流能够闭合组织腔隙防止积血、积液,并加速局部血液循环,改善感染创面及骨折愈合条件[17]。武山山 等[18]采用载抗生素硫酸钙人工骨联合VSD治疗慢性骨髓炎,静脉应用抗生素时间、住院天数、一期至二期手术时间均显著短于常规负压引流治疗。本研究采用载抗生素人工骨联合VSD治疗骨折内固定术后早期感染,两者优势互补,彻底清创后置入载抗生素人工骨,在稳定释放高浓度抗生素杀灭细菌的同时,VSD封闭了创面,持续冲洗引流感染坏死组织及人工骨代谢渗液,促进了局部肉芽组织生长和毛细血管增生,达到了共同控制感染目标。本研究中,一期感染控制率100%,WBC、ESR、CRP、PCT术后7 d均较术前明显降低,差异均有统计学意义(P<0.01),末次随访时28例患者患肢功能均基本恢复正常。
综上所述,采用载抗生素人工骨联合VSD治疗骨折内固定术后早期感染是一种可以保留内固定的有效方法,不仅能有效控制感染,促进骨折愈合,而且感染复发率低,安全性较高。本研究不足:回顾性分析,缺乏临床对照研究,样本量小。后期将进行更大样本、更长时间的随访,以得到更高质量的数据为临床提供参考。

