合成MRI 定量参数评估宫颈鳞癌淋巴脉管间隙浸润的初步研究
郭丽美,王峻,武文奇,张毓婧,张润梅,牛金亮
0 前言
在我国,宫颈癌是女性生殖系统最常见的恶性肿瘤,严重威胁女性生命安全[1]。宫颈鳞状细胞癌是最常见的病理类型,约占全部宫颈癌的75%-80%[2-3]。淋巴脉管间隙浸润(lymphovascular space invasion, LVSI)反映肿瘤细胞进入循环系统,最终播散至全身,是发生淋巴结转移的重要途径[4-5]。LVSI、深层间质浸润、肿瘤大于4cm是早期宫颈癌复发的危险因素[6-7]。根据美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)指南,LVSI 状态是决定宫颈癌术后是否行辅助治疗的因素之一[8],也是决定是否可实施保留生育功能手术的重要因素[9]。因此,术前对宫颈鳞癌患者的LVSI 状态进行评估,对于评估预后、制订治疗方案、降低致死率等十分重要。
常规MRI仅能提供肿瘤大小、间质浸润深度等形态学评估,无法判定LVSI 状态[10]。目前评价LVSI 状态主要依靠术后病理,术前活检由于肿瘤的异质性等特点,无法对LVSI 状态做出准确评价[11-12]。既往有学者将体素内不相干运动(intravoxel incoherent motion, IVIM)成像[13]、酰胺质子转移(amide proton transfer, APT)成像[14]等定量技术初步应用于预测宫颈癌LVSI 状态,研究结果表明灌注系数、APT 值等在预测宫颈癌LVSI方面有一定价值。
纵向弛豫时间(longitudinal relaxation time, T1)、横向弛豫时间(transverse relaxation time, T2)、质子密度(proton density, PD)等参数可用于定量评估组织内在生理特性,如心肌纤维化程度[15-16]、组织含水量、反映肿瘤细胞密度[17]等。在肿瘤学领域,上述定量参数在前列腺良恶性病变的鉴别诊断[17]、肾透明细胞癌病理分级[18]等方面有一定价值。然而,由于扫描时间过长、后处理分析复杂等原因,上述定量MRI技术的临床应用受限。
合成MRI可实现单次扫描同时获得T1、T2和PD值3个定量参数[19],并且可重建对比加权图像,可大大缩短扫描时间。目前,合成MRI技术已经初步应用于前列腺[20]、乳腺[21]良恶性病灶的鉴别诊断,发现T1 和T2值可以帮助判断病灶性质、预测肿瘤的侵袭性。目前为止,合成MRI在术前预测宫颈癌的LVSI状态的应用未见报道。鉴于此,本研究旨在初步探究合成MRI的定量参数预测宫颈鳞癌LVSI状态的可行性,以期为宫颈鳞癌的术前诊断提供一定分子层面信息。
1 材料与方法
1.1 一般资料
前瞻性招募2020年5月至2022年11月因疑似宫颈癌于山西医科大学第二医院就诊的患者。纳入标准:(1)首次经临床查体、影像学检查、阴道镜等初诊为宫颈癌;(2)进行根治性子宫切除术;(3)盆腔MRI检查后进行手术,时间间隔不超过一周。排除标准:(1)病灶肉眼不可见或病灶最大径小于5 mm;(2)术后病理为非鳞状细胞癌;(3)因图像伪影明显,MRI图像质量差,无法进行影像评估。本研究遵守《赫尔辛基宣言》,经山西医科大学第二医院伦理审查委员会的批准(编号:2020YXD077),并获得所有参与者的书面知情同意。
1.2 MRI扫描方法
采用GE Signa Pioneer 3.0 T MRI 扫描仪,并使用腹部线圈。患者呈仰卧位。常规加权序列包括:横断位T1WI、横断位/矢状位T2WI、横断位/冠状位脂肪抑制T2WI、横断位扩散加权成像(diffusion-weighted imaging, DWI)。横断位T1WI序列参数:TR 753 ms,TE 11 ms,层厚5 mm,层间距1 mm,矩阵320×256,视野(field of view, FOV)260 mm×260 mm;横断位/矢状位T2WI 序列参数:TR auto 763/3873 ms,TE 73.0/71.4 ms,层厚5/4 mm,层间距1 mm,矩阵288×288/280×280,FOV 260 mm×260 mm;横断位/冠状位脂肪抑制T2WI 序列参数:TR auto 5305/4884 ms,TE 73.0/64.6 ms,层厚5/5 mm,层间距1 mm,矩阵288×288/300×300,FOV 260 mm×260 mm;横 断 位DWI 序 列 参 数:TR 5000 ms,TE 80.3 ms,层厚 5 mm,层间距1 mm,矩阵128×1300,FOV 260 mm×260 mm,b 值为0、800 s/mm2;矢状位合成MRI(magnetic compilation, MAGiC)序列参数:TR 4000 ms,TE1 18.8 ms,TE2 94.1 ms,TI 210、610、1810、3810 ms,翻转角90°、110°,FOV 260 mm×260 mm,层厚4 mm,层间距1 mm,矩阵320×224。
1.3 MRI图像分析
将合成MRI 图像传输至GE pioneer 设备自带的MAGiC 专用后处理软件(V100.1.1, GE, USA),生成定量参数图。首先需参考矢状位T2WI图像,识别肿瘤实性区域及血管、坏死区域和囊性区域。在合成T2加权图像上,选择显示肿瘤的最大层面,沿着肿瘤边界勾画感兴趣区(region of interest, ROI),勾画时尽量避开血管、坏死等区域,仅包括肿瘤实质成分区域(图1和图2),得到T1、T2和PD值。两名放射科医生(分别为主治医师和副主任医师)对患者临床资料及病理结果不知情,并分别分析图像,最终结果取两者平均值。
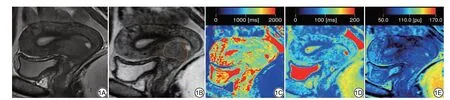
图1 女,33岁,病理确诊为低分化宫颈鳞状细胞癌,淋巴脉管间隙浸润阴性。1A:矢状位T2WI图像;1B:合成T2WI图像;1C-1E:分别为定量T1图、T2图和质子密度(PD)图,T1值为1280.0 ms,T2值为88.0 ms,PD值为81.9 pu。Fig.1 A 33-year-old female patient with poorly-differentiated cervical squamous cell carcinoma and absent lymphovascular space invasion confirmed by pathology.1A: Sagittal T2-weighted imaging (T2WI); 1B: Synthetic T2-weighted images derived from the synthetic MRI sequences; 1C-1E: T1 map, T2 map, and proton density (PD) map, respectively, T1 value is 1280.0 ms, T2 value is 88.0 ms, PD value is 81.9 pu.
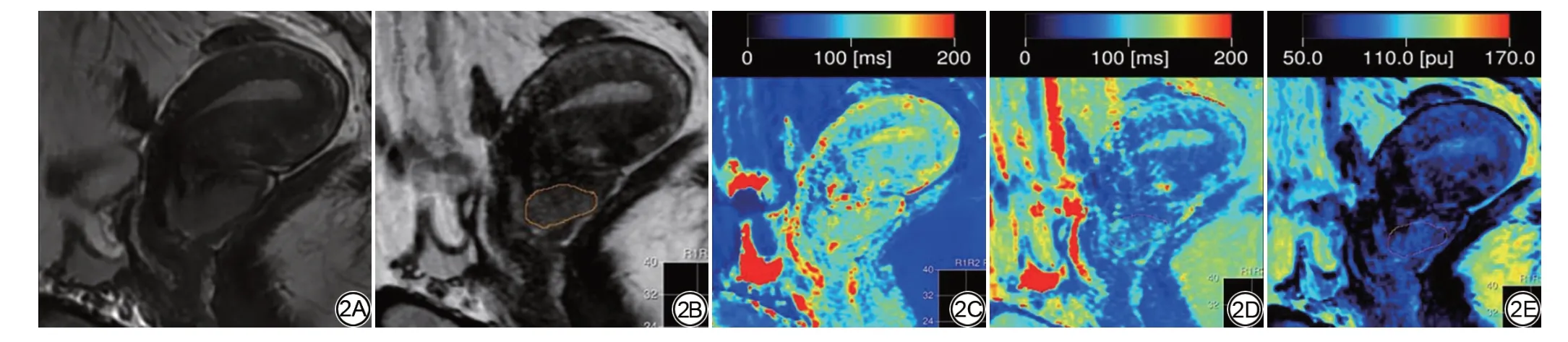
图2 女,34 岁,病理确诊为低分化宫颈鳞状细胞癌,淋巴脉管间隙浸润阳性。2A:矢状位T2WI图像;2B:合成T2WI图像;2C-2E:分别为定量T1 图、T2 图和质子密度(PD)图,T1值为1153.0 ms,T2值为78.0 ms,PD值为72.3 pu。Fig.2 A 34-year-old female patient with poorly-differentiated cervical squamous cell carcinoma and positive lymphovascular space invasion confirmed by pathology.2A: Sagittal T2-weighted imaging (T2WI); 2B: Synthetic T2-weighted images derived from the synthetic MRI sequences; 2C-2E: T1 map, T2 map, and proton density (PD) map, respectively, T1 value is 1153.0 ms, T2 value is 78.0 ms, PD value is 72.3 pu.
1.4 病理分析
根据2018 版国际妇产科联盟(Federation of International of Gynecologists and Obstetricians,FIGO)分期,所有患者均行根治性子宫切除术±双侧卵巢切除+双侧盆腔淋巴结清扫±腹主动脉旁淋巴结清扫。病理结果均由山西医科大学第二医院病理科依据标准病理程序处理,进行HE染色,并进行免疫组化CD34(用于评估血管内皮)和D240(用于评估淋巴管)染色。采用光学显微镜联合免疫组织化学法对病理组织进行检测。LVSI 阳性被定义为在肿瘤组织外缘,内皮细胞所衬空间内存在附壁肿瘤细胞[22]。采集患者的组织病理学特征,包括:肿瘤分化程度、肿瘤最大径等。
1.5 统计学方法
采用SPSS 22.0(IBM, Armonk, NY)及MedCalc进行统计分析。应用组内相关系数(intra-class correlation coefficient, ICC)评价两名医师测量肿瘤的T1、T2 和PD 值的一致性,ICC≥0.75 为高度一致,0.75>ICC≥0.40 中度一致,ICC<0.40 为一致性较低。非正态分布的连续数据表示为中位数(下四分位数,上四分位数),符合正态分布的计量资料表示为均数±标准差。根据数据分布特征,采用独立样本t检验或Mann-WhitneyU检验,比较不同LVSI 状态下T1、T2 和PD 值的差异。受试者工作特征(receiver operating characteristic, ROC)曲线分析合成MRI定量参数鉴别宫颈鳞癌的LVSI状态的诊断效能。应用MedCalc软件进行DeLong检验,比较不同参数预判LVSI 状 态 的ROC 曲 线 下 面 积(area under the curve, AUC)值。P<0.05认为差异具有统计学意义。
2 结果
2.1 临床资料
80 名经术后病理证实的宫颈鳞癌患者纳入研究(图3),其中LVSI 阳性者51 例,LVSI 阴性者29 例。两组患者的年龄、肿瘤分化程度、肿瘤最大径、术前FIGO分期差异无统计学意义,详见表1。
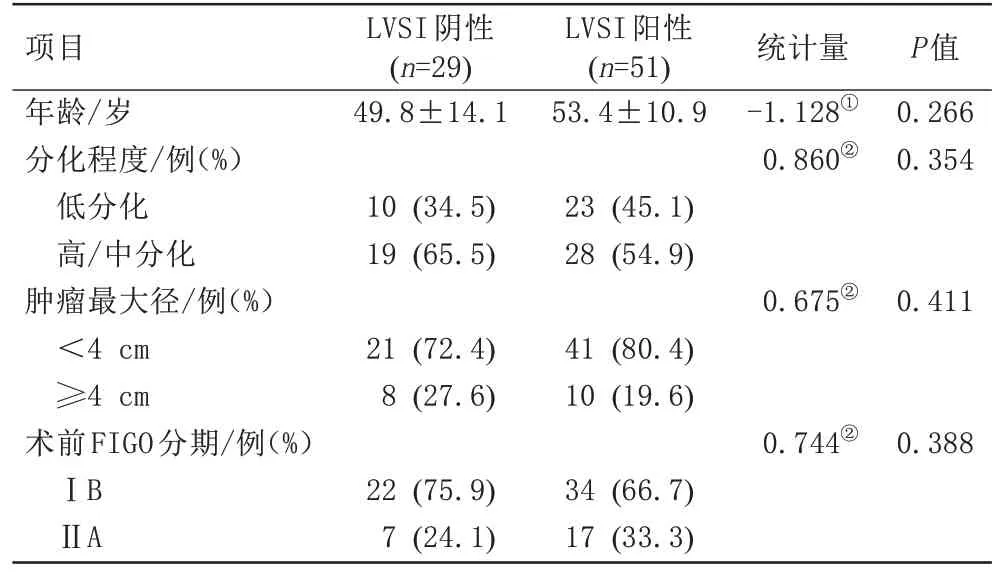
表1 80例宫颈鳞癌患者的临床和病理信息Tab.1 Clinical and pathological characteristics of 80 cases of cervical squamous cell carcinoma
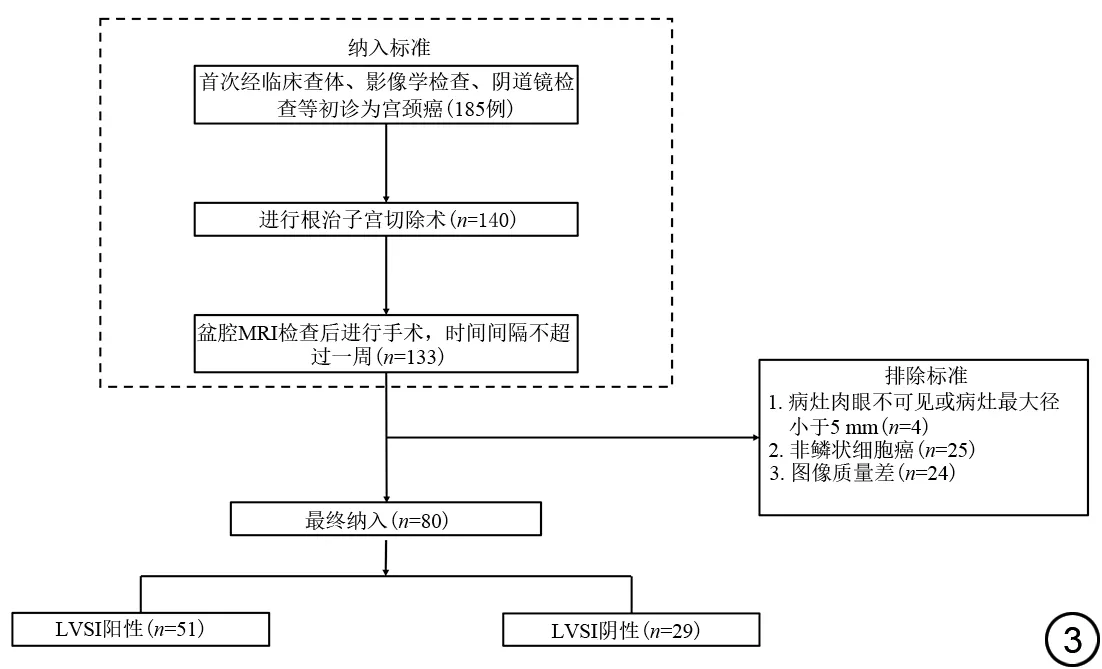
图3 纳入和排除流程图。LVSI为淋巴脉管间隙浸润。Fig.3 A flowchart of patient inclusion and exclusion.LVSI: lymphovascular space invasion.
2.2 两名医师测量的T1、T2、PD值的一致性
两名医师测量的宫颈鳞癌肿瘤的T1、T2、PD值显示出较高的一致性。T1、T2 和PD 值的ICC 分别为0.900 [95%置信区间(confidence interval,CI):0.849-0.935]、0.874(95%CI: 0.810-0.917)和0.893(95%CI: 0.838-0.930)。
2.3 合成MRI 参数评估宫颈鳞癌的淋巴脉管间隙浸润状态
LVSI 阳性组的T1 值[(1191.60±101.17) ms vs.(1316.58±107.42) ms]和T2 值[(80.72±5.62) ms vs.(89.79±7.43) ms]显著低于阴性组(P值均<0.001)。不同LVSI状态的T1、T2和PD值如表2所示。
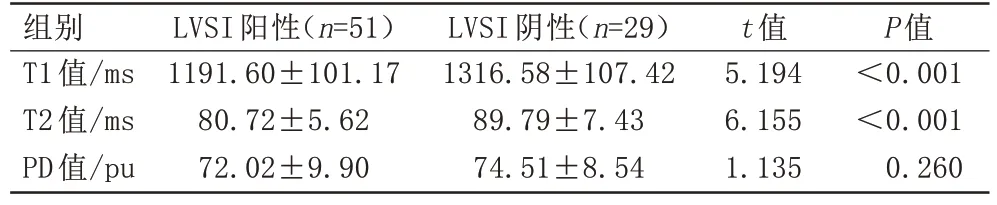
表2 宫颈鳞癌不同淋巴脉管间隙浸润状态各参数间比较Tab.2 Assessment of differences in T1, T2, and PD values in different lymphovascular space invasion status of cervical squamous cell carcinoma
2.4 T1和T2值对淋巴脉管间隙浸润状态的诊断效能
T1 和T2 预测宫颈鳞癌LVSI 状态的AUC 分别为0.798、0.850,T1 值1237.26 ms、T2 值86.19 ms 是最佳临界值。采用二元多因素logistic回归分析,回归方法为输入,回归分析结果:T1 [B值=-0.010, OR=0.990(95%CI: 0.983-0.997),P=0.009], T2 [B 值=-0.199,OR=0.820 (95%CI: 0.726-0.925),P=0.001]。将回归分析得到的预测概率值进行ROC分析,即参数T1和T2值联合诊断的诊断效能,为0.881。采用DeLong检验比较不同参数独立及联合诊断LVSI 状态的AUC 值,发现T1和T2联合诊断与T1、T2值单独分析相比差异无统计学意义(P=0.054,P=0.357)。预测LVSI状态的每个定量参数的ROC分析结果见图4和表3。
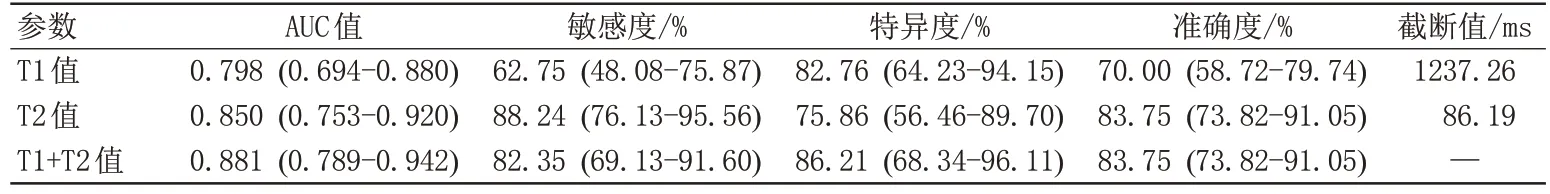
表3 合成MRI参数鉴别淋巴脉管间隙浸润状态的诊断效能Tab.3 Diagnostic performance of the parameters from synthetic MRI in predicting the status of lymphovascular space invasion
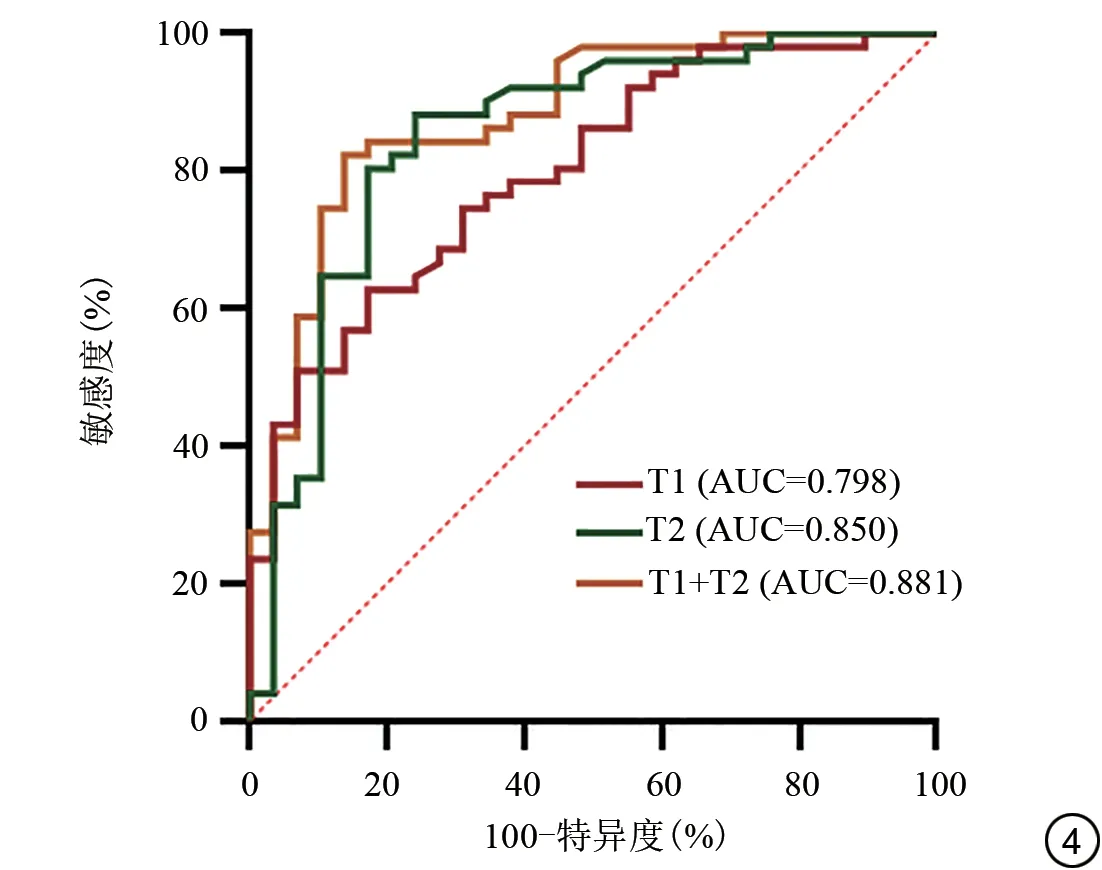
图4 T1和T2值诊断宫颈鳞癌患者淋巴脉管间隙浸润状态的受试者工作特征(ROC)曲线。AUC为曲面下面积。Fig.4 The receiver operating characteristic (ROC) of T1, T2 values and combined T1 and T2 in terms of lymphovascular space invasion status in cervical squamous cell carcinoma.AUC: area under the curve.
3 讨论
本研究探讨了合成MRI 在预测宫颈鳞癌LVSI 状态的价值,结果显示,LVSI 阳性组T1 和T2 值均低于LVSI 阴性组的患者,T1 值、T2 值独立诊断及T1 和T2联合诊断LVSI状态的效能差异无统计学意义。
3.1 T2值与淋巴脉管间隙浸润状态
T2值是公认的反映不同组织中自由水含量的定量生物标志物[23-24]。既往有研究将T2值应用于识别直肠癌患者的恶性淋巴结[25]、判定肾透明细胞癌病理分级[26]、鉴别前列腺良恶性病变[27]等领域。在宫颈癌方面,既往研究表明T2值在预测宫颈癌LVSI状态方面有一定价值[28-29]。其中,LI 等[29]采用T2 maping 技术预测宫颈鳞癌中的LVSI状态,发现T2值可用于预测宫颈鳞癌LVSI状态,AUC值达0.877。本研究中LVSI阳性组的T2值显著低于LVSI阴性组,与既往研究结果一致,但AUC值(0.850)略低于上述研究。这种差异可能与研究人群不同有关,LI等[29]的研究病例数为58例,其中LVSI阳性者17例,本研究病例数80,LVSI阳性者51例。
3.2 T1值与淋巴脉管间隙浸润状态
T1 mapping 已被广泛应用于无创性评估心肌弥漫性纤维化[30-32]。在肿瘤学领域,T1值的应用多联合对比剂进行评估,通过计算细胞外体积分数、增强扫描后强化率、下降率等参数,进行肾透明细胞癌病理分级的鉴别[33]、评估胰腺肿瘤化疗后疗效评估[34]、肝细胞癌病理分级、预后评估等[35]。WANG 等[36]研究表明,基于T1 mapping 的细胞外体积分数在鉴别宫颈癌LVSI 状态方面有一定价值,LVSI 阳性组细胞外体积分数显著高于非LVSI 组,细胞外体积分数的诊断效能优于动态增强扫描的定量参数Ktrans值。本研究基于平扫采用合成MRI 技术,结果表明LVSI 阳性组的T1 值明显低于阴性组。ZHAO 等[37]的研究中,采用合成MRI技术评估直肠癌的病理特征,发现壁外静脉侵犯阳性组的T1 值低于壁外静脉侵犯阴性组,与本研究结果一致。组织T1弛豫时间与多种生物因素有关,如大分子浓度和水结合状态[38]。LVSI 阳性肿瘤更容易伴有细胞缺氧、坏死,大分子物质聚集等[13-14,39],这些因素可以缩短组织的T1弛豫时间。
相比传统的T1 mapping、T2 mapping 技术,合成MRI在一次扫描中生成T1、T2、PD三个弛豫时间的定量图,可以更加全面地反映肿瘤信息,大大提高工作效率。本研究结果中,二元logistics回归分析中T1和T2 值均为预测宫颈鳞癌LVSI 的独立影响因素,T1 和T2值两个参数联合在预测宫颈鳞癌LVSI状态方面的AUC值略高于T1、T2值单独诊断,但差异无统计学意义。
3.3 局限性
本研究存在几个局限性:首先,样本量小,为单中心研究,多中心大样本的前瞻性研究将在以后的研究中进行;其次,ROI 勾画仅在肿瘤最大层面获得,由于肿瘤的异质性的特点,可能会对结果产生影响,逐层勾画肿瘤可获得更全面的肿瘤信息;最后,T1、T2、PD 值等参数受多种生理因素影响,其与肿瘤病理特征的相关性需进行进一步的研究。
4 结论
综上所述,本研究表明合成MRI可以在术前无创性地预测宫颈鳞癌LVSI 状态,为临床医生制订治疗方案提供参考。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:牛金亮设计本研究的方案,对稿件重要内容进行了修改;郭丽美起草和撰写稿件,获取、分析或解释本研究的数据;王峻、武文奇、张毓婧、张润梅获取、分析或解释本研究的数据,参与试验的设计,并对稿件的讨论部分进行了修改;全体作者都同意发表最后的修改稿,同意对本研究的所有方面负责,确保本研究的准确性和诚信。

