黄精总黄酮的提取工艺优化及抗氧化研究
韦国兰,吴超群,胡秀虹,龙杰凤,张启美
(凯里学院,贵州 凯里 556011)
黄精为百合科(Liliaceae)黄精属(Polygonatum)、黄精(P.sibiricum)、滇黄精(P.kingianum)和多花黄精(P.cyrtonema)干燥根茎的统称,按形状不同,俗称大黄精、鸡头黄精、姜形黄精等,药用和食用价值较高[1-3]。黄精作为药食两用中药,主要含有甾体皂苷、木脂素、生物碱、黄酮及挥发油等化学成分,具有调节血脂、改善记忆力、抗肿瘤、抗氧化、抗菌和抗炎等作用,毒副作用小,市场需求量大[4-6 ]。同时,黄精作为药食同源的食材,又具有解热消暑、改善记忆力、提高免疫力等功能[7-10]。黄酮类化合物又称类黄酮,是植物中重要的次生代谢产物,具有抗衰老、降血糖、改善血液循环等保健功能,具有很高的经济价值和药用价值[11-13]。黄酮类物质在医学和食疗保健品上的应用越来越广泛[14-16]。
黄精作为一种常用的中药材,就目前研究现状而言,对黔东南地区道地药材黄精的总黄酮研究报道少。黄酮提取方法有多种,用超声提取的方法较其他方法有较大的优点,如:操作简单、提取效率高、高效等。黄精在黔东南地区分布较广,各个县区均有分布且资源丰富,有潜在的资源开发和经济优势。所以本次实验以黄精为原材料,用超声提取法对黄精提取总黄酮进行研究,已确定黔产黄精提取总黄酮的最优条件为黄精的研究以及工业化生产提供一些参考数据;同时,使黄精资源能够得到有效利用,对黄精资源的开发有着比较重要的意义。
1 实 验
1.1 实验仪器及试剂
FW400A高速万能粉碎机,北京科伟仪器有限公司;AR224CN电子分析天平,奥豪斯仪器有限公司;FSP120-AAAN2酶标仪,全汉企业股份有限公司;80-2离心沉淀器,常州市国立实验设备研究所;WGLL-230BE电热鼓风干燥箱,天津市泰斯特仪器有限公司;JP-D040超声波清洗机,深圳市洁盟清洗设备公司。
黄精来源于贵州省黔东南州镇远县羊场镇,芦丁标准品、抗坏血酸、硝酸铝、亚硝酸钠、无水乙醇、氢氧化钠、DPPH等实验药品皆购买所得,蒸馏水实验室取,所需配制的药品均为现配现用。
1.2 实验方法
1.2.1 黄精的前处理
从贵州省镇远县采得黄精,去须,挖去腐烂部分,用自来水清洗干净,直至表面无泥土,用太阳晾干表面水分,然后切成厚薄均一的薄片,放置于烘箱中烘干,温度控制80 ℃左右(温度不宜过高),直至恒重,然后用高速万能粉碎机粉碎,放冷,过筛40目,用干净密封的口袋装好密封保存,写上标签,备实验使用。
1.2.2 芦丁标准曲线的制备
用天平精确取20 mg的芦丁标准品,放入的事先准备好的容量瓶50 mL中,向其加入60%的乙醇到刻度线处,用塞子盖好,上下振荡,使其芦丁与乙醇溶液充分混合,即可得到芦丁标准溶液,它的浓度为0.4 mg/mL。用移液管分别取0 mL、1 mL、2 mL、3 mL、4 mL、5 mL、6 mL,分别放于6个容量瓶25 mL中,并贴上标记1~6号,加入5%亚硝酸钠溶液1 mL到容量瓶中,室温下放于6 min后,再向其加入10%的硝酸铝溶液各2 mL,并同样在室温下放置6 min后。向其加入10%的氢氧化钠溶液各10 mL分别放入25 mL容量瓶中,最后加入去离子水到容量瓶刻度线上,放15 min。用酶标仪在波长为510 nm处有最大吸收峰值,即可测得它的值。图1为标准曲线图和线性回归方程,其中R2=0.99 94指的是它的浓度和吸光度值两者之间的线性关系良好。

图1 芦丁标准曲线Fig.1 Rutin standard curve
1.2.3 黄精中总黄酮的含量测定

式中:X是指含量;Y是指黄精总黄酮的浓度;N为稀释倍数;m为称取的样品质量,mg。
1.2.4 黄精总黄酮抗氧化活性的测定
根据得到总黄酮的量,用无水乙醇配制成不同梯度的浓度,分别配置的浓度为0.1、0.2、0.3、0.4、0.5 mg/mL,配制完成后,放于阴凉处保存备用。用干净的移液枪精密吸取300 μL不同梯度浓度溶液,分别加入0.004% DPPH溶液2 mL(注意:DPPH溶液需避光存放)使其总黄酮溶液与DPPH溶液充分混合,在室温的条件下,放置于20 min。同时,另精确吸取不同浓度的总黄酮溶液各300 μL,分别向其各加入无水乙醇2 mL,使其与无水乙醇混合均匀;用酶标仪在固定的波长处(517 nm)测得吸光度值,带入 DPPH 自由基的清除率公式中计算,它的公式为:
D=[1-(D1-D2)/D0]×100%
式中:D代表黄精总黄酮DPPH自由基的清除率;D0为不加总黄酮溶液的DPPH吸光度,作为空白对照;D1为溶液加DPPH的吸光度;D2为以无水乙醇加DPPH的吸光度。
用同样的方法测定维生素C溶液(对照)对DPPH自由基的清除能力。
2 结果与分析
2.1 单因素实验
2.1.1 不同乙醇浓度对黄精中总黄酮提取的影响
事先洗净并用烘干要用的圆底烧瓶和容量瓶,备用。用天平准确称取5份黄精粉末1.000 0 g,分别置于5个圆底烧瓶中,并贴上1~5号标签,量取15 mL不同浓度的乙醇于5个圆底烧瓶中,为防止乙醇挥发,要将瓶口封好。以时间20 min、温度50 ℃、料液比1∶15不变,乙醇浓度为变量,开始超声,超声后取出放置至室温,用离心机进行离心30 min,取上清液,倒入50 mL的容量瓶中,再滴加乙醇稀释至刻度线,再分别向其容量瓶中各量取10 mL溶液至25 mL容量瓶中,按照芦丁标准曲线的步骤,相继加入显色剂亚硝酸钠1 mL,硝酸铝2 mL,氢氧化钠10 mL,室温下放置一段时间后,用酶标仪测定吸光读并计算黄精的浓度和提取率。测定总黄酮的吸光度,计算的总黄酮浓度和得率。如图2所示,其他因素不变,以乙醇浓度比为变量的情况下,当乙醇浓度为70%时,所获得的总黄酮含量最高。
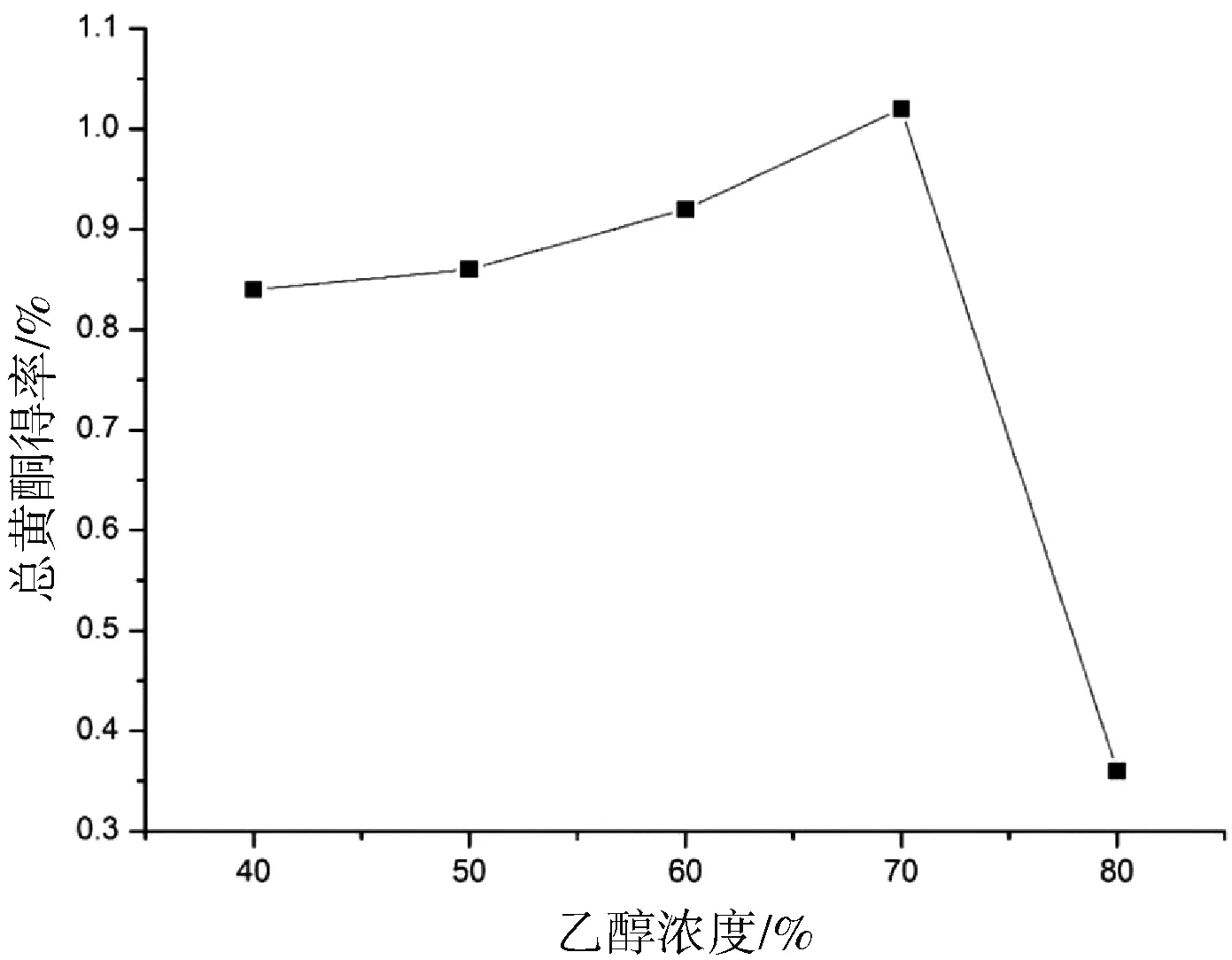
图2 不同乙醇浓度对总黄酮提取的影响Fig.2 Influences of ethanol concentration on total flavones of Polygonatum sibiricum
2.1.2 不同温度对黄精中总黄酮提取的影响

图3 不同提取温度对总黄酮提取的影响Fig.3 Influences ofextraction temperatureon total flavones of Polygonatum sibiricum
事先洗净并烘干实验要用的容量瓶和圆底烧瓶,备用。用天平准确称量5份黄精粉末1.000 0 g,分别置于5个圆底烧瓶中,并贴上1~5号标签,向圆底烧瓶中量取15 mL的60%乙醇,以料液比、时间、乙醇浓度为固定量,温度为变量,温度分别为40、50、60、70、80 ℃,将圆底烧瓶瓶口用保鲜膜封好,防止挥发,用超声机超声20 min,冷却后,用离心机离心,得到滤液,舍去下面固体部分,倒入50 mL容量瓶中,用乙醇滴加稀释至刻度线,再分别向其容量瓶中各量取10 mL至25 mL容量瓶中。按照上述芦丁标准曲线的方法加入依次加入不同显色剂,加去离子水至刻度线定容,用酶标仪在510 nm处测得吸光度,带入回归方程式计算黄精总黄酮的含量,并计算黄精中所含的提取率。根据酶标仪测定的不同提取温度的吸光度值,计算浓度和含量。如图3所示,其他因素不变,以提取温度为变量,当提取温度为70 ℃时,黄精中总黄酮含量最高。
2.1.3 不同提取时间对黄精中总黄酮提取的影响
洗净5个圆底烧瓶烘干备用。将圆底烧瓶贴上标签,用天平准确称量黄精粉末1.000 0 g,各5份,分别置于1~5号锥形瓶中,分别向圆底烧瓶中各量取15 mL的60%乙醇,用保鲜膜封住瓶口,以料液比、乙醇浓度、温度不变,时间作为变量,设定5组时间,分别为10、30、50、70、90 min,然后按设定好的时间开始超声,超声完成放至室温,用离心机开始离心,将得到的滤液放入50 mL容量形瓶中,用乙醇溶液定容,再量取10 mL的滤液至25 mL的容量瓶中根据标准曲线的试剂依次进行添加,摇匀,加去离子水定容至刻度线。得到供试品溶液。测值,并计算黄酮的含量以及提取率。如图4所示,测得在不同提取时间中所得到的吸光度,以时间为变量时,在时间为50 min时所得的总黄酮含量最高。

图4 不同提取时间对总黄酮提取的影响Fig.4 Effect of extraction time on total flavones of Polygonatum sibiricum
2.1.4 不同料液比对黄酮中总黄酮提取的影响

图5 不同料液比对总黄酮提取的影响Fig.5 Effect of liquid-solid ratio on total flavones of Polygonatum sibiricum
用蒸馏水洗净5个圆底烧瓶并烘干,贴上标签1~5号标签备用。用天平精确称取1.000 0 g黄精粉末,共5份,放置到事先准备好并标有标签1~5号的圆底烧瓶中,固定超声温度为50 ℃,时间为30 min,乙醇浓度为60 ℃,以料液比为变量,5组料液比分别为1∶5、1∶10、1∶15、1∶20、1∶25,准备好后,开始超声,超声结束后,用离心机离心,提取滤液到事先准备好的50 mL容量瓶中,再取10 mL的滤液装入到25 mL容量瓶中,再根据标准曲线的试剂依次添加亚硝酸钠,硝酸铝,氢氧化钠等显色剂,最后摇匀,加去离子水定容至刻度线,静止15 min,得到供试溶液,测得吸光度值。以料液比为变量,测定总黄酮含量的最大值,通过图5所知,料液比为1∶10,黄精中总黄酮的量最大。
2.2 单因素实验结果与分析
由单因素实验结果测得的含量可知最佳的提取时间50 min、提取温度70 ℃、液料比1∶10、乙醇浓度含量70%。
2.3 正交实验
得到最佳条件后,取最佳条件左右与本身组成3个水平因素,进一步的去探讨在相近条件下去确定更加精准的控制变量,以求得到更加准确的最佳提取率、最佳提取工艺。为方便实验的进行,有限选择最佳提取工艺。其水平因素如表1所示。

表1 正交实验水平因素表Table 1 Factors and levels of L9(34)orthogonal experiment
根据上述设计的因素水平,以L9(34)为正交试验方案设计提取黄精中的总黄酮,各组实验都取单因实验提取最高值与最高值左右的两组数据,在相同的条件下重复3次进行提取操作,提取步骤与上述实验相同,由乙醇为提取剂,用超声提取的方法提取黄精总黄酮的正交试验,其正交表2所示。

表2 正交试验结果Table 2 Orthogonal test results
根据正交实验的分析表可知,超声乙醇溶液提取总黄酮的最佳工艺为A2B3C1D1这组数据;从直观分析可知,极差由高到低的顺序为C>B>D>A;由此得到对总黄酮提取影响因素的大小依次为料液比、温度、乙醇浓度、提取时间。
2.4 验证性实验
称取黄精粉末1.000 0 g,按照A2B3C1D1的方法进行,以“2.2.2”的方法进行含量测定,如表3所示。

表3 验证性实验Table 3 Confirmatory experiments
2.5 黄精总黄酮抗氧化活性的分析
由图6可知,在0.1~0.5 mg/mL浓度范围内黄精总黄酮和抗坏血酸对DPPH自由基都有较强的清除能力,且随着浓度的增加而增加,当浓度为0.5 mg/mL时,黄精总黄酮的清除率为91%,抗坏血酸的清除率为95%,说明黄精总黄酮具有较强的抗氧化活性。

图6 不同质量浓度的清除率Fig.6 Clearance of different mass concentrations
3 结 论
本实验是用超声仪器对黄精总黄酮进行提取,选用乙醇作为提取溶剂,通过正交实验得到黄精总黄酮的最佳提取工艺为A2B3C1D1,探究黄酮提取的影响因素的大小依次为料液比、温度、乙醇浓度、提取时间。通过黄精总黄酮抗氧化活性的测定实验可知:在0.1~0.5 mg/mL范围内,黄精总黄酮的DPPH自由基的清除率与其浓度呈现良好的量效关系,且黄精总黄酮具备较好的DPPH自由基的清除能力。
结合上述结论,本方法与以前回流方法相比较;一是高效,如溶剂损失小、防止高温使化合物结构破坏。二是高速,提取的时间短。该工艺具有的优点,如操作简单,安全,速度快,易提取。黄精总黄酮具有较高的抗氧化能力,可作为天然的抗氧化活性活性剂和自由基清除剂。

