大豆秸秆强化染料脱色过程中微生物群落结构变化研究*
郭庆贤,刘 娜,刘 鑫,韩 娟,陆招娣,尹云美,韩亚芬,谢学辉
(1 宿州学院环境与测绘工程学院,安徽 宿州 234000;2 宿州学院沱河流域面源污染控制与生态修复技术研究中心,安徽 宿州 234000;3 东华大学环境科学与工程学院,上海 201620;4 上海污染控制与生态安全研究院,上海 200092)
近年来,由于人口和工业的快速增长,偶氮染料需求量逐年增加[1]。偶氮染料化学结构中都至少含有一个-N=N-键,即偶氮键,偶氮键可以与苯环相接构成新的化合物,而苯环可连接各种取代基,从而组成了各式各样的有机物化合物,且这些有机化合物中大多数对环境有一定的危害。偶氮染料的广泛应用,造成偶氮染料废水的大量产生,偶氮染料会使水体具有致突变性,还会改变水体的pH及BOD/COD等水质指标,进而对土壤肥力、天然藻类和水生生物造成严重危害,最终导致生态环境破坏[2]。偶氮染料属异生型芳香族杂环化合物,很难被降解,其中一些甚至具有很强的生物毒性及“三致”效应[3]。偶氮染料废水是最难治理的一类废水,对偶氮染料废水处理是一个急需解决的问题。
通常处理偶氮染料废水的方法主要有物理法、化学法、生物法,其中生物法具有高效、安全、低能耗以及环境友好等特点,有着良好的发展前景[4]。近年来,已分离出多种可使偶氮染料降解脱色的微生物,包括细菌、真菌和藻类,其中细菌以生长迅速,短时间可获得可观的生物量,以及对染料有较高的降解效率等优势,备受研究人员的青睐[5]。碳氮源在微生物处理染料废水中是必须的,但是优质碳氮源的价格昂贵,增加企业负担,因此,寻找能够替代的劣质碳氮源是一个值得探索的方向。
本研究利用劣质碳氮源大豆秸秆代替优质氮碳源牛肉膏和蛋白胨,强化偶氮染料活性黑5微生物脱色降解过程,采用Miseq高通量测序技术对菌群群落结构进行分析,揭示微生物群落结构、优势菌种与脱色效果的关系,研究结果可以为工业废水处理中利用廉价的氮碳源代替优质氮碳源提供借鉴意义。
1 实 验
1.1 实验材料
1.1.1 染料和混合菌群
本实验选取活性黑5(Reactive Black 5,RB5)偶氮染料作为目标污染物,其中,活性黑5分子式为C26H25N5O19S6Na4,熔点为300 ℃,相对分子量为991.82,特征峰波长是597 nm。结构式如图1所示。本实验所用混合菌群筛选自宿州市埇桥区生活污水处理厂[6]。
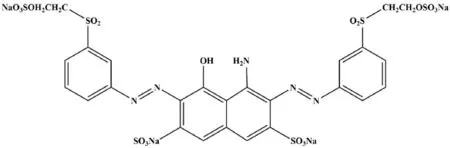
图1 活性黑5结构式Fig.1 Structural formula of Reactive Black 5
1.1.2 培养基
培养基:无水硫酸钠0.5 g/L,氯化铵0.2 g/L,无水磷酸二氢钾2.66 g/L,蛋白胨1.5 g/L,牛肉膏1.5 g/L,大豆秸秆12 g/L。
1.1.3 实验主要设备与仪器
本试验所用的主要设备及仪器有:LDZM-40L-I压力式蒸汽灭菌锅;UV-2600紫外可见分光光度计;SH-150G恒温培养箱;TGL-16M高速冷冻离心机;SW-DJ-2D超净工作台等。
1.2 实验方法
1.2.1 大豆秸秆强化微生物脱色效果
钱泰吉《曝书杂记》言:“余昔有明初抄本,即《解题》所载本。”《文渊阁书目》未囊括这个钞本,因为它是官府藏书目录,而《直斋书录解题》则是陈振孙的私家藏书目录。可见《解题》本到明初一直是为私家钞录收藏,而未进入官家藏书库。
以偶氮染料活性黑5为脱色降解目标物,利用大豆秸秆代替牛肉膏和蛋白胨作为碳氮源。首先,将大豆秸秆洗净后烘干(85 ℃),接着灭菌,待其冷却称取10 g放入 NaOH 溶液(2%)中,再将其用95 ℃恒温水浴锅煮沸20 min,冷却到室温,洗净烘干(85 ℃)后用粉碎机粉碎。取以上提前准备好的混合菌群40 mL离心(5 000 r/ min),倒去上清液,加入 PBS 混匀冲洗两次,再加入40 mL的无菌水。培养基冷却时开始计时,浸泡一天后使用。取上述90 mL培养基加入10 mL的菌液,再加入染料活性黑5,使其终浓度为50 mg/L,37 ℃静置培养,每24 h从培养基中取出2 mL脱色液,离心10 min(10 000 r/min)取上清液,测定其在597 nm处的活性黑5染料的特性波长,根据下列公式计算出脱色率。
脱色率=(A0-At)/A0×100%
式中:A0是特征峰597 nm处无菌染料培养基的吸光度值;At是特征峰597 nm处降解t小时培养基的吸光度值。
1.2.2 菌体样品采集
取强化脱色降解前后的菌液(编号分别为S0、S1),以 10 000 r/min的转速,在离心机中将样品离心10 min,除去上清液,菌体送至上海美吉生物医药科技有限公司进行Miseq高通量测序。
1.2.3 Miseq高通量测序
利用Illumina平台,对收集到的菌体样品进行Miseq高通量测序分析。首先提取冷藏保存在-20℃条件下的菌体样品的基因组总DNA,采用琼脂糖凝胶为1%的电泳进行检测;其次,将16S rDNA的V4-V5区域用引物515 F和907 R展开PCR扩增,然后,用琼脂糖凝胶为2%的电泳对扩增的结果进行分析,将 PCR扩增后的产物进行切胶回收;并用荧光定量测定(Promega公司),对从切胶中提取的PCR扩增产物也进行定量测定;最后,为高通量序列建立 Miseq文库进行分析,获得DNA模板序列,用于生物信息的分析。两个样品S0和S1共得到有效序列82 713个,为了对不同样品间的菌群结构更好的进行对比,本研究对2个样品随机抽取40 031个序列进行分析;将上一步得到的优化序列按97%的相似度在QIIME软件上进行操作分类单元(OUT)划分,每个OTU对应于一种代表序列[7]。在 OTU的聚类结果的基础上,利用 Mothur软件对 Alpha进行了多项指标的分析;最后,利用RDP Classifier,对其分类学水平(门、纲、科、属)上的菌群群落结构进行系统的研究。
2 实验结论与讨论
2.1 大豆秸秆强化微生物脱色效果
利用大豆秸秆强化混合菌群脱色偶氮染料活性黑5,结果如图2所示。从图2中可以看出,以大豆秸秆作为唯一碳氮源条件下,混合菌群对活性黑5的脱色率在反应24 h可以达到47.18%,在反应72 h达到51.84%,张轶洋等[8]研究表明大豆秸秆可以释碳,从而为反应体系提供碳源。
2.2 大豆秸秆强化前后微生物群落多样性特征分析
采用Miseq高通量测序技术,分别对强化脱色前S0和强化脱色后S1混合菌群群落多样性特征进行分析,结果见表1。可以看出,测序样品共聚类成19个OTU,其中样品S0聚类成9个OTU,S1聚类为10个OTU。S0和S1的 Shannon指数分别为1.38和1.57,S0和S1的Simpson指数分别为0.27和0.23,说明强化脱色后微生物群落多样性有所提高;两个样品的Chao指数和Ace指数均有所升高,反映了菌群群落的丰富度有小幅度增加。

表1 样品S0和S1的OUT与微生物多样性指数Table 1 OTU and microbial diversity index of samples S0 and S1

图3 样品 S0和S1的Shannon多样性指数曲线Fig.3 Shannon diversity index curves for samples S0 and S1
由图3可知,总体来看,2个样品的Shannon多样性指数曲线类似,同时,随着序列的增加,该曲线也变得平稳,表明在测序中使用的序列数是合理的,数据分析具有可靠性。
2.3 大豆秸秆强化前后微生物群落结构分析
2.3.1 门分类学水平

图4 门分类学水平上样品S0和S1的微生物群落结构Fig.4 Microbial community structure of samples S0 and S1 at the phylum level
由图4可得,在门分类学水平上,变形菌门(Proteobacteria)在S0和S1中分别占比73.78%和82.32%,是最优势菌种,厚壁菌门(Firmicutes)在S0和S1中占比分别为25.51%和17.25%。研究表明,在染料降解体系中,大量存在着变形菌门(Proteobacteria)和厚壁菌门(Firmicutes)[9]。例如,谢学辉等[10]通过研究激活剂A对DDMY2混合菌群群落结构的影响,发现在全部样本中,变形菌门(Proteobacteria)的比例最高,说明在RB19的脱色体系中,变形菌门是主要的菌种。由此推断,变形菌门(Proteobacteria)具有较好的生物降解能力[11]。
2.3.2 纲分类学水平
S0和S1在纲分类学水平上的菌群群落组成如图5所示,主要有γ-变形菌纲(Gammaproteobacteria)和杆菌纲(Bacilli)2种,其中γ-变形菌纲(Gammaproteobacteria)在S0和S1中分别占比73.79%和82.32%;而芽孢杆菌纲(Bacilli)在S0和S1中分别占比25.51%和17.25%。γ-变形菌纲(Gammaproteobacteria)在S0和S1中占有较高的比例,故γ-变形菌纲(Gammaproteobacteria)为混合菌群的优势菌种。γ-变形菌纲是一种革兰氏阴性细菌,它在染料废水的处理中广泛存在[12-14]。

图5 纲分类学水平上样品S0和S1的微生物群落结构Fig.5 Microbial community structure of samples S0 and S1 at the class level
2.3.3 科分类学水平

图6 科分类学水平上样品S0和S1的微生物群落结构Fig.6 Microbial community structure of samples S0 and S1 at the family level
由图6可得,在科分类学水平上,肠球菌科(Enterococcaceae)在S0和S1中分别占比40.10%和29.82%,黄单胞菌科(Xanthomomdaceae)在S0和S1中分别占比33.68%和16.86%;在S0中产碱杆菌科(Alcaligenaceae)占比较低,而在S1中产碱杆菌科(Alcaligenaceae)占比增至35.63%,说明大豆秸秆作为碳氮源有利于产碱杆菌科(Alcaligenaceae)的生长。
2.3.4 属分类学水平
为了进一步研究强化前后属分类学水平上微生物群落结构的变化情况,绘制2个样品最丰富50个属的Heatmap图,如图7所示。总体来看,在属分类学水平上,寡氧单胞菌(Stenotrophomonas)、肠球菌属(Enterococcus)、柠檬酸杆菌属(Citrobacter)和大肠杆菌志贺菌属(Escherichia-Shigella)都是优势菌种,寡氧单胞菌属(Stenotrophomonas)在S0和S1中分别占比33.68%和16.86%,柠檬酸杆菌属(Citrobacter)在S0和S1中占比27.14%和15.68%。肠球菌属(Enterococcus)在S0和S1中占比为25.51%和17.25%,大肠杆菌志贺菌属(Escherichia-Shigella)在S0和S1中占比为12.95%和14.15%。值得注意的是,鲍特菌属(Bordetella)在S0中占比几乎为0,而在S1中占比为35.63%,成为样品S1的最优势菌种,说明大豆秸秆有利于鲍特菌属(Bordetella)的生长。另外,研究表明,鲍特菌属(Bordetella)对活性黑5有一定的脱色潜力[15]。

图7 样品S0和S1种最丰富50个属的 Heat map 图Fig.7 Heat map of the 50 most abundant genera of samples S0 and S1
3 结 论
本研究利用大豆秸秆作为氮碳源,代替牛肉膏和蛋白胨,促进混合菌群脱色降解活性黑5,结果表明,混合菌群对50 mg/L活性黑5溶液的脱色率为51.84%(反应72 h),具有较好的脱色效果。在不同分类学水平(门、纲、科、属)上,分析2组样品中混合菌群群落的物种组成情况,结果表明,变形菌门(Proteobacteria)是所有样品的优势菌,大豆秸秆有利于鲍特菌属(Bordetella)的生长,且鲍特菌属(Bordetella)在脱色活性黑5过程中可能扮演重要角色。本文的研究结果可以为今后利用劣质碳氮源强化实际染料废水处理效果提供理论依据。

