UPLC-MS/MS法测定犬血浆中阿莫西林和克拉维酸片剂的生物等效性研究
徐一丹,郭凡溪,刘利锋,2,张冯奕驰,王俊丽,邹远鹏,余元倩,余祖功*
(1.南京农业大学动物医学院,江苏 南京 210095;2.南京朗博特动物药业有限公司,江苏 南京 210032)
阿莫西林属半合成广谱青霉素类抗生素,化学名称为(2S,5R,6R)-3,3-二甲基-6-[(R)-(-)-2-氨基-2-(4-羟基苯基)乙酰氨基]-7-氧代-4-硫杂-1-氮杂双环[3.2.0]庚烷-2-甲酸三水合物,通过抑制细菌细胞壁的合成而发挥杀菌作用[1]。它对金葡菌、链球菌、棒状杆菌等革兰阳性菌以及大肠杆菌、沙门氏菌、巴氏杆菌等革兰阴性菌均有较强作用[2]。阿莫西林耐胃酸但不耐β-内酰胺酶,易被β-内酰胺酶水解破坏。克拉维酸是一种β-内酰胺酶抑制剂,化学名称为(2R,3Z,5R)-3-(2-羟基亚乙基)-7-氧代-4-氧杂-1-氮杂双环[3.2.0]庚烷-2-羧酸,仅有微弱的抗菌活性,不单独用于抗菌治疗,通常与阿莫西林等β-内酰胺抗生素合用以克服细菌的耐药性[3]。阿莫西林克拉维酸钾片在宠物临床应用于敏感菌所致的各种感染,如皮肤及软组织感染、尿道感染、呼吸道感染等[4]。农业农村部已将宠物用阿莫西林克拉维酸钾片列入《兽药比对试验目录(第一批)》。近年来,宠物医疗行业在我国发展迅猛,国内宠物用阿莫西林克拉维酸钾制剂生产企业稀少,应用前景广阔。本研究首先建立犬血浆中阿莫西林和克拉维酸浓度的UPLC-MS/MS检测方法,并应用该方法开展国产阿莫西林克拉维酸钾片与进口产品(参比制剂)在犬体内的生物等效性试验,为国内宠物制药企业生产的阿莫西林克拉维酸钾片的申请上市提供技术支持。
1 材料与方法
1.1 药品与试剂
阿莫西林对照品,中国食品药品鉴定研究所,批号130409-201913,纯度87.0%;克拉维酸标准品,中国食品药品鉴定研究所,批号130429-201708,纯度95.1%;阿莫西林D4标准品(阿莫西林的内标):ISOREAG®,批号21B029-A4,化学纯度98.6%,同位素纯度98.2%;阿莫西林克拉维酸片参比制剂,意大利豪普特制药厂,批号01925600,规格为500 mg;阿莫西林克拉维酸片受试制剂,南京朗博特动物药业有限公司,批号202012311,规格为500 mg;超纯水,由Millipore公司生产的Direct-Q5UV型水纯化系统制备。甲醇和乙腈,德国Merck公司,色谱级;甲酸,美国ASC公司,质谱级;二氯甲烷、正己烷、乙酸铵、冰醋酸均为分析纯级试剂。
1.2 仪器设备
AcquityTMUPLC系统超高效液相色谱仪(美国Waters公司);Xevo TQD型三重四极杆串联质谱仪,配有电喷雾离子源(美国Waters公司);QUINTIX125D-1CN型电子天平(北京赛多利斯天平有限公司);Centrisart D-16C型和D-14C型低温高速离心机(德国Sartorius公司);Direct-Q5UV型水纯化系统(美国Millipore公司);XW-80A型涡旋混合仪(上海驰唐电子有限公司);M1800H-J型超声波清洗仪(美国BRASON公司);SLK-03000-S型振荡器(Scilogex公司);BCD-458WDVNU1型冰箱(海尔集团);ULTS1490型超低温冰箱(赛默飞世尔仪器有限公司)。
1.3 实验动物
26只成年健康比格犬,雌雄各半,体重为(9.35±1.28)kg,来源于江苏亚东实验动物研究中心。将实验犬饲养于南京农业大学实验动物中心普通动物房内,饲喂不含任何抗菌药物的实验犬维持饲料,试验前进行7 d的适应性饲养和观察。
1.4 相关溶液的制备
1.4.1 对照品储备液阿莫西林储备液:精确称量阿莫西林对照品置于50 mL量瓶,用50%甲醇水溶解并稀释至刻度,摇匀,制成200 μg·mL-1的储备液。克拉维酸储备液:精确称量克拉维酸对照品置于10 mL量瓶,用90%乙腈水超声溶解并稀释至刻度,摇匀,制成1 mg·mL-1的储备液。对照品储备液平行制备2份,分别用于标准曲线和质控样品的制备。阿莫西林D4储备液:精确量取50%甲醇水1 mL溶解阿莫西林D4(1 mg)后将全部溶液转移至10 mL容量瓶中,用50%甲醇水稀释至刻度,摇匀,即得内标储备液。储备液均置于-80 ℃冷冻保存。
1.4.2 系列工作液用超纯水精确稀释阿莫西林储备液,制成0.2、1、5、10、25、50、100 μg·mL-1的阿莫西林系列标准曲线工作液和0.2、0.5、40、80 μg·mL-1的阿莫西林质控工作液;用超纯水精确稀释克拉维酸储备液,制成1、4、10、20、40、60、100 μg·mL-1的克拉维酸系列标准曲线工作液和1、2、50、75 μg·mL-1的克拉维酸质控工作液。精确量取内标储备液适量,用超纯水稀释20倍,即得5 μg·mL-1内标工作液。工作液于2~8 ℃保存备用。
1.5 LC-MS/MS测定方法
1.5.1 色谱条件色谱柱为Acquity UPLC HSS T3 column(100 mm×2.1 mm,1.8 μm),流速0.3 mL·min-1,进样量5 μL,柱温30 ℃。阿莫西林:进样室温度4 ℃,流动相A为乙腈,流动相B为体积分数0.1%的甲酸水溶液。洗脱程序:0~0.1 min,0% A;0.1~3.0 min,0%~90% A;3.0~5.0 min,90% A;5.0~5.1 min,90%~0% A;5.1~9.0 min,0% A。克拉维酸:进样室温度6 ℃,流动相A为乙腈,流动相B为体积分数0.01%的甲酸水溶液。梯度洗脱程序:0~0.5 min,0% A;0.5~2.5 min,0%~65% A;2.5~3.6 min,65% A;3.6~3.7 min,65%~0% A;3.7~5.5 min,0% A。
1.5.2 质谱条件采用电喷雾离子源使分析物离子化,并在多反应监测(MRM)模式下分别对阿莫西林及内标进行正离子(ESI+)监测,对克拉维酸及内标进行负离子(ESI-)监测。阿莫西林:毛细管电压3.0 kV,离子源温度150 ℃,脱溶剂温度350 ℃,脱溶剂气流速800 L·h-1,锥孔气流速50 L·h-1。克拉维酸:毛细管电压3.0 kV,离子源温度150 ℃,脱溶剂温度500 ℃,脱溶剂气流速800 L·h-1,锥孔气流速50 L·h-1。各化合物的定量定性离子对、锥孔电压和碰撞能见表1。
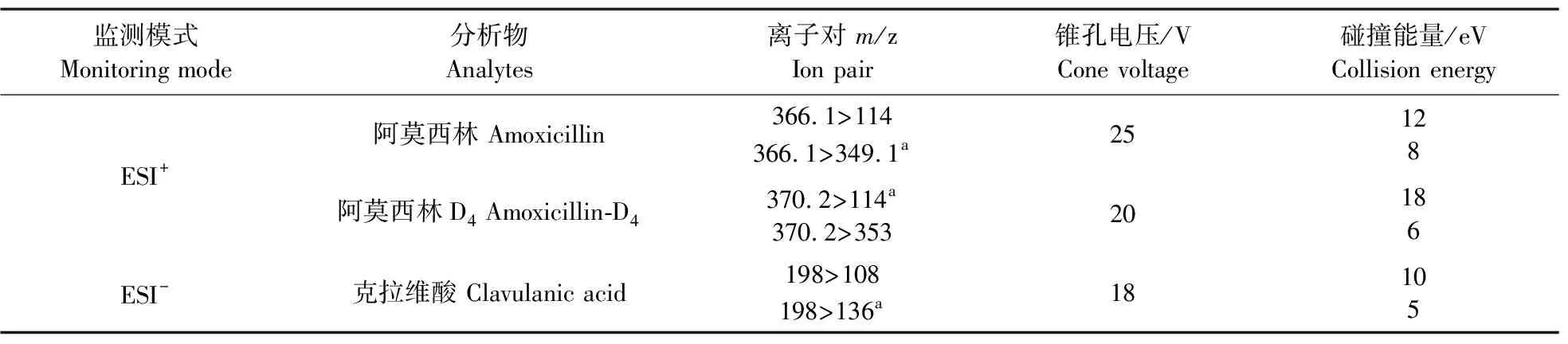
表1 阿莫西林、克拉维酸和内标的质谱参数Table 1 Mass parameters of amoxicillin,clavulanic acid and internal standard
1.6 血浆样品预处理
1.6.1 阿莫西林血样预处理1)取血浆样品200 μL,精确加入内标工作液50 μL,涡旋30 s,加入醋酸铵缓冲液(pH6.0)250 μL和乙腈400 μL,涡旋2 min,200 r·min-1振荡10 min,4 ℃、12 000 r·min-1离心 10 min;2)取上清液0.5 mL,加入二氯甲烷1 mL,涡旋2 min,4 ℃、6 000 r·min-1离心10 min;3)取上层水相100 μL,加超纯水300 μL,涡旋混匀,0.22 μm滤头过滤后进样分析。
1.6.2 克拉维酸血样预处理1)取血浆样品400 μL,加入670 μL乙腈,涡旋3 min,4 ℃、13 000 r·min-1离心10 min;2)转移上清液置干净的离心管中,加入二氯甲烷1 mL,涡旋1 min,4 ℃、8 000 r·min-1离心6 min;3)取上层液体,加入正己烷400 μL,涡旋1 min,4 ℃、13 000 r·min-1离心10 min;4)取下层水相,0.22 μm滤头过滤后进样分析。
1.7 方法学验证
1.7.1 专属性阿莫西林:取6只不同犬的空白血浆样品、空白血浆加100 μg·mL-1阿莫西林标准溶液,空白血浆加100 μg·mL-1克拉维酸标准溶液,空白血浆加内标工作液,按1.6.1节方法处理样品后检测。克拉维酸:取6只不同犬的空白血浆样品、空白血浆加100 μg·mL-1阿莫西林标准溶液,空白血浆加100 μg·mL-1克拉维酸标准溶液,按1.6.2节方法处理样品后检测。
1.7.2 标准曲线及线性分析取空白血浆180 μL,分别加入相应浓度的阿莫西林系列标准工作液20 μL,制成20、100、500、1 000、2 500、5 000、10 000 ng·mL-1的阿莫西林标准曲线血浆样品;取空白血浆380 μL,分别加入相应浓度的克拉维酸系列标准工作液20 μL,制成50、200、500、1 000、2 000、3 000和5 000 ng·mL-1的克拉维酸标准曲线血浆样品。按1.6节方法处理后进样检测,以阿莫西林浓度(x,ng·mL-1)为横坐标,峰面积比值(y)为纵坐标,绘制阿莫西林标准曲线。以克拉维酸样品浓度(x,ng·mL-1)为横坐标,克拉维酸峰面积(y)为纵坐标,绘制克拉维酸标准曲线。2种分析物标准曲线计算均采用加权(W=1/x)最小二乘法线性回归分析。
1.7.3 准确度和精密度取空白血浆180 μL,分别加入相应浓度的阿莫西林质控工作液20 μL,制备阿莫西林质量浓度为20、50、4 000、8 000 ng·mL-1的质控样品;取空白血浆380 μL,分别加入相应浓度的克拉维酸质控工作液20 μL,制备克拉维酸质量浓度为50、100、2 500、3 750 ng·mL-1的质控样品。每个浓度5个平行样品,连续制备并测定3个分析批,根据当日的标准曲线方程求得质控样品浓度,计算准确度、批内(n=5)及批间(n=15)精密度。
1.7.4 基质效应空白基质加标样品制备:取6只不同犬的空白血浆,用乙腈沉淀蛋白并涡旋离心后,取全部上清液,分别加入低、高浓度质控工作液(阿莫西林样品加内标工作液),再按1.6节方法继续处理。每个浓度6个平行样品。纯溶液样品制备:以超纯水替换空白血浆,其余步骤相同。记录检测空白基质加标样品的阿莫西林峰面积为As,内标峰面积为Ais;检测纯溶液样品的阿莫西林峰面积平均值为Bs,内标峰面积平均值为Bis。计算经内标归一化的基质因子[(As/Bs)/(Ais/Bis)×100%]及其精密度。记录检测空白基质加标样品的克拉维酸峰面积为C,纯溶液样品的克拉维酸峰面积平均值为D,计算基质因子(C/D×100%)及其精密度。
1.7.5 稀释可靠性制备20 000 ng·mL-1的阿莫西林血浆样品,用空白血浆稀释4倍;制备8 000 ng·mL-1的克拉维酸血浆样品,用空白血浆稀释4倍。每种药物各制备5个平行样品,分别按1.6节方法处理后检测。根据当日的标准曲线获得稀释后样品的检测浓度,将检测浓度乘以稀释倍数与制备浓度比较,计算准确度和精密度。
1.7.6 稳定性对低、中、高浓度的质控样品进行如下条件的稳定性考察:血浆样品-80 ℃反复冻融3次的稳定性;血浆样品-80 ℃长期放置(克拉维酸和阿莫西林血浆样品分别放置45 d和112 d)的稳定性;预处理后样品进样室放置24 h稳定性;阿莫西林血浆样品室温放置8 h稳定性和克拉维酸血浆样品2~8 ℃放置8 h稳定性。
1.8 药动学试验
采用单剂量、双处理、双周期交叉试验设计,选26只成年健康比格犬随机分为2组(TR和RT组),每只受试犬进行2个周期试验,各服用1次受试制剂(T)和1次参比制剂(R),每次服用半片(含阿莫西林200 mg,克拉维酸50 mg),清洗期设置为14 d。受试犬给药前禁食12 h,除给药前1 h和给药后2 h禁止饮水外,任意饮水。次日早晨空腹取血样后,给犬口服受试制剂或参比制剂,并灌服5 mL水促其吞服,4 h后统一饲喂犬维持饲料。分别在口服给药前及给药后10 min、20 min、30 min、45 min、1 h、1.25 h、1.5 h、1.75 h、2 h、2.5 h、3 h、3.5 h、4 h、4.5 h、5 h、6 h、8 h、10 h、12 h、14 h和24 h于犬的前肢静脉采集血液3~3.5 mL。采集的血样在预冷的离心机(2~8 ℃)以2 150g离心10 min,分离的血浆转移至干净的离心管中,置于-80 ℃冰箱冷冻保存待测。阿莫西林血浆样品检测时间点为给药前和给药后10 min、20 min、30 min、45 min、1 h、1.25 h、1.5 h、1.75 h、2 h、3 h、4 h、6 h、8 h、10 h、12 h、14 h和24 h,克拉维酸血浆样品检测时间点分别为给药前和给药后10 min、20 min、30 min、45 min、1 h、1.25 h、1.5 h、1.75 h、2 h、2.5 h、3 h、3.5 h、4 h、4.5 h、5 h、6 h、8 h和10 h。
1.9 数据处理与分析
采用Phoenix Winnonlin 8.1药动学软件以非房室模型分析药动学血浆样品的浓度数据,获得药动学参数,对参比制剂和受试制剂药动学参数峰值浓度Cmax、药物浓度-时间曲线下面积AUC0-t和AUC0-∞对数转换后进行方差分析及双向单侧t检验并计算90%置信区间范围,达峰时间Tmax需经非参数检验,进而评价生物等效性。
2 结果与分析
2.1 方法学验证结果
2.1.1 专属性从图1可以看出,阿莫西林的保留时间约为2.6 min,内标的保留时间约为2.6 min;从图2 可以看出,克拉维酸的保留时间约为3.0 min。以上结果表明,来源不同的空白基质中分析物保留时间处无杂峰干扰,且各分析物之间无相互干扰,方法专属性良好。
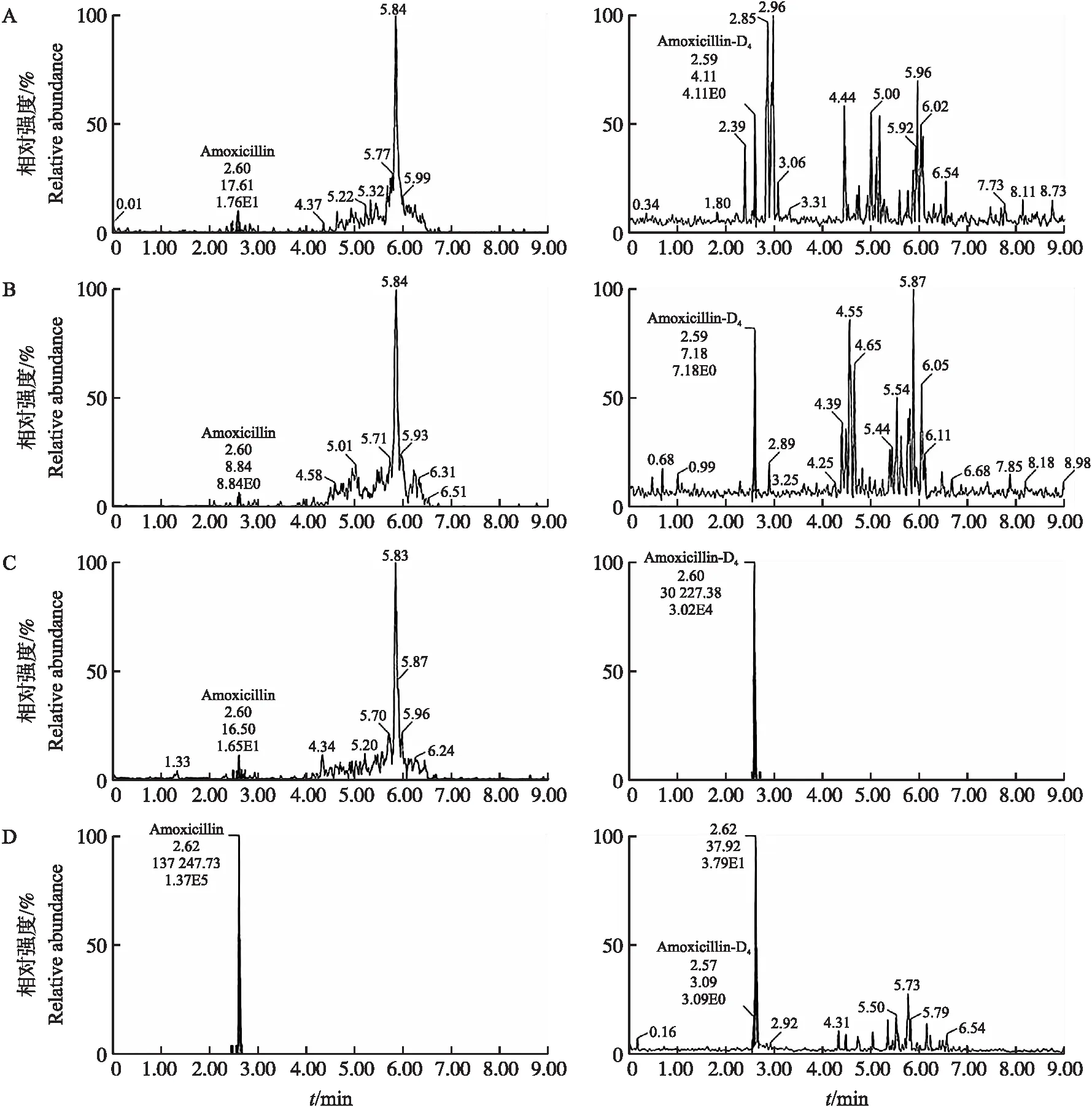
图1 血浆中阿莫西林和内标(阿莫西林D4)的典型MRM色谱图Fig.1 Typical MRM chromatogram of amoxicillin and internal standard(amoxicillin-D4)in plasma A. 空白血浆 Blank plasma;B. 空白血浆添加100 μg·mL-1克拉维酸标准溶液 Blank plasma spiked with a concentration of 100 μg·mL-1 clavulanic acid standard solution;C. 空白血浆添加5 μg·mL-1内标工作液 Blank plasma spiked with a concentration of internal standand working solution;D. 空白血浆添加100 μg·mL-1阿莫西林标准溶液 Blank plasma spiked with a concentration of 100 μg·mL-1 amoxicillin standard solution.
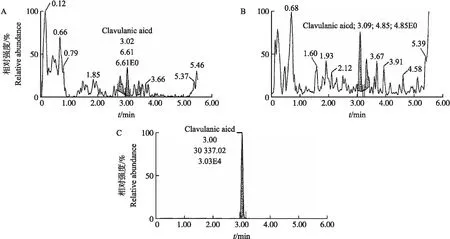
图2 血浆中克拉维酸的典型MRM色谱图Fig.2 Typical MRM chromatogram of clavulanic acid in plasma A. 空白血浆 Blank plasma;B. 空白血浆添加100 μg·mL-1阿莫西林标准溶液 Blank plasma spiked with a concentration of 100 μg·mL-1 amoxicillin standard solution;C. 空白血浆添加100 μg·mL-1克拉维酸标准溶液 Blank plasma spiked with a concentration of 100 μg·mL-1 clavulanic acid standard solution.
2.1.2 标准曲线和线性犬血浆中阿莫西林在20~10 000 ng·mL-1浓度范围内线性关系良好,其回归方程为y=0.000 494 291x-0.000 021 446 9(R2=0.999 7)。犬血浆中克拉维酸在50~5 000 ng·mL-1浓度范围内线性关系良好,其回归方程为y=4.384 69x+5.984 01(R2=0.997 7)。
2.1.3 准确度和精密度由表2可见,阿莫西林和克拉维酸质控样品的准确度均在标示值的15%范围内,批内(n=5)、批间(n=15)精密度均小于15%,表明该方法检测重复性良好。

表2 方法的准确度和精密度结果Table 2 Accuracy and precision results of the detection method
2.1.4 基质效应阿莫西林在低、高浓度下,经内标归一化后基质因子的平均值分别为105.5%、104.6%,RSD分别为4.0%、1.2%;克拉维酸在低、高浓度下,基质因子的平均值分别为102.7%、97.6%,RSD分别为1.3%、1.4%,表明不同来源的血浆基质对阿莫西林和克拉维酸的测定结果没有影响。
2.1.5 稀释可靠性阿莫西林稀释样品检测的准确度为95.2%~98.8%,RSD为1.6%;克拉维酸稀释样品检测的准确度为94.9%~105.1%,RSD为3.9%,表明该稀释方法不影响样品检测的准确度和精密度。
2.1.6 稳定性考察结果血浆中药物稳定性考察结果见表3,结果显示血浆中药物浓度检测的准确度均在85%~115%范围内,RSD小于15%,表明血浆样品中阿莫西林和克拉维酸在不同储存条件下稳定性良好。

表3 不同条件下犬血浆中阿莫西林和克拉维酸的稳定性检测结果Table 3 Stability result of amoxicillin and clavulanic acid in dog plasma in different
2.2 药物的药动学参数
共有25只受试犬完成试验,1只受试犬因呕吐时间在2倍中位达峰时间(Tmax)内而退出试验。采用Phoenix Winnonlin 8.1药动学软件的非房室模型计算得到25只犬单剂量口服阿莫西林克拉维酸钾片受试制剂和参比制剂后平均药动学参数,结果见表4,绘制的平均血药浓度-时间曲线如图3所示。
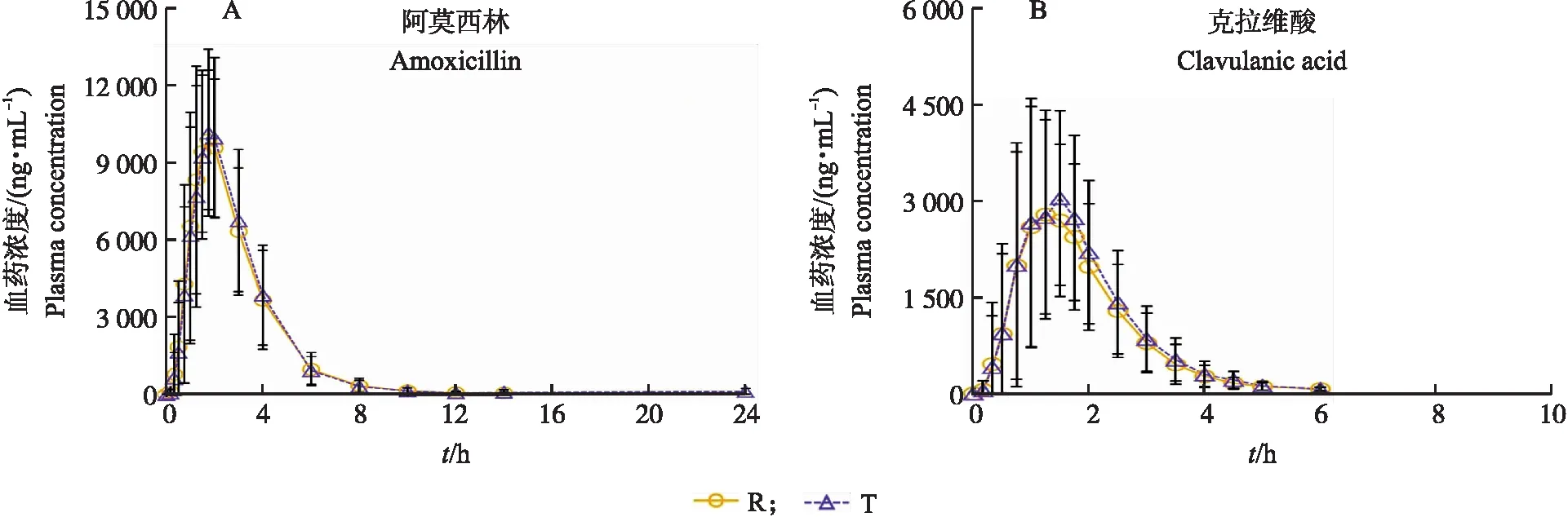
图3 犬口服参比制剂(R)或受试制剂(T)后阿莫西林和克拉维酸平均血药浓度-时间曲线Fig.3 Mean plasma concentration-time curve of amoxicillin and clavulanic acid in dogs after oral administration of reference(R)or test
表4 犬口服阿莫西林和克拉维酸受试制剂和参比制剂后的药动学参数Table 4 Pharmacokinetic parameters of amoxicillin and clavulanic acid after oral administration of test and reference preparations in
2.3 药物的生物等效性分析
将阿莫西林和克拉维酸主要药动学参数Cmax、AUC0-t及AUC0-∞对数转换后进行方差分析,结果见表5。两制剂间各参数均无显著差异(P>0.05),双向单侧t检验结果表明t1和t2均大于单侧t0.05,几何平均值的90%置信区间均在80%~125%等效范围内,Tmax经非参数检验在受试制剂和参比制剂间无统计学差异(P>0.05),表明两制剂生物等效。
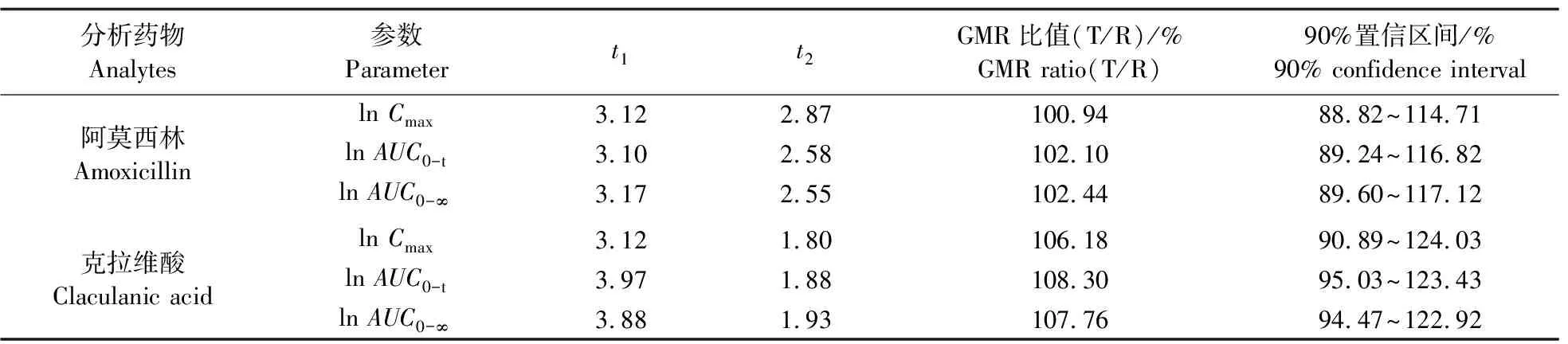
表5 受试制剂(T)和参比制剂(R)主要药动学参数经对数转换后几何平均值(GMR)比值的90%置信区间
3 讨论
本文首先建立了一种准确、便捷的犬血浆中阿莫西林和克拉维酸浓度测定的UPLC-MS/MS法。阿莫西林是两性化合物,结构式中有氨基和羧基,在电喷雾离子源(ESI)的正离子(ESI+)和负离子(ESI-)模式下均有响应。克拉维酸的结构式中仅有羧基,难以带正电荷,仅在ESI-模式下有响应。文献[5-8]报道中应用MS/MS监测阿莫西林和克拉维酸一般有2种方式:一种是分开检测,阿莫西林应用ESI+模式,而克拉维酸应用ESI-模式;另一种是在ESI-模式下同时监测阿莫西林和克拉维酸。同时监测2种成分能大大缩短分析时间,因此本试验开始时首选这一方式。而试验过程中发现,ESI-模式下,当克拉维酸浓度为50~2 000 ng·mL-1时阿莫西林和克拉维酸之间互不干扰,均能准确定量,但当克拉维酸浓度超过2 000 ng·mL-1时,对阿莫西林的响应有抑制作用,目前未见有文献报道这一现象,这可能与生物样品基质或质谱型号有关。在生物等效性试验中,方法的定量准确为必要条件,而这种抑制现象影响样品检测的准确度,考虑到阿莫西林在ESI-模式下的响应远低于ESI+模式,因此最终选择应用ESI+模式监测阿莫西林,ESI-模式监测克拉维酸。在ESI+模式下,在流动相中加入甲酸可促进阿莫西林分子的离子化,增强其响应,因此在仪器允许条件下甲酸添加量至0.1%;而ESI-模式下,降低甲酸的含量能使克拉维酸获得更好的峰型和更高的响应,因此在克拉维酸流动相条件中将甲酸水溶液中甲酸的含量调至0.01%。阿莫西林和克拉维酸均选择梯度洗脱模式,当初始比例中含有机相时,分析物峰形变差,响应减弱,因此初始比例中乙腈比例为0%。
根据Xi等[5]报道的血浆样品前处理方法,以乙腈沉淀样品中蛋白后,直接用超纯水稀释后进样。我们在重复该处理方法时,发现处理后的样品中乙腈含量较高时,阿莫西林和克拉维酸均出现响应减弱,色谱峰分叉、分裂的现象,因此选择在乙腈沉淀蛋白后,加入二氯甲烷萃取乙腈,取水层分析,峰型明显改善且响应也明显提高[9-10]。在本文建立的方法下,阿莫西林定量限血浆浓度为20 ng·mL-1,进样分析浓度低至2 ng·mL-1,比Xi等[5]、Zhang等[7]和Yoon等[11]报道方法的灵敏度更高。克拉维酸经二氯甲烷去除乙腈后进样分析,发现基线噪声较高而影响定量限和低浓度样品的定量,经筛选考察后发现二氯甲烷去除乙腈,取水层添加同体积正己烷涡旋除脂,可降低出峰处的基线噪声,提高样品检测准确度和灵敏度。
本文阿莫西林检测方法中选择同位素内标(阿莫西林D4),由于其具有相同的结构和性质,可有效消除基质效应,提高准确度和精密度及稳定性。此外,基于克拉维酸高浓度下对阿莫西林响应存在抑制作用,而给药后克拉维酸的Cmax远高于2 000 ng·mL-1,故未选用阿莫西林D4为内标,且无内标条件下,克拉维酸定量检测的准确度和精密度良好。经方法学验证,本研究建立的犬血浆中阿莫西林、克拉维酸浓度的检测方法均特异性强、准确度高、精密度好,适用于犬口服阿莫西林克拉维酸钾片的生物等效性测定。
犬分别经单剂量(阿莫西林 200 mg,克拉维酸 50 mg)口服受试制剂和参比制剂后,受试制剂阿莫西林、克拉维酸的平均血药浓度-时间曲线与参比制剂基本吻合,显示两制剂口服后在犬体内的药动学行为基本一致。经药动学软件分析获取主要药动学参数Cmax、AUC0-t和AUC0-∞并将其对数转化,方差分析结果表明阿莫西林和克拉维酸的主要药动学参数在受试和参比制剂间差异均不显著,双向单侧t检验符合要求,且几何平均值比(T/R)的90%置信区间均在80.00%~125.00%规定范围内,Tmax经非参数分析后无统计学差异。按照《兽用化学药品血药浓度法生物等效性试验指导原则》[12]和《中国药典》(2020年版)四部附录9011《药物制剂人体生物利用度和生物等效性试验指导原则》[13]规定,可以判定受试制剂和参比制剂生物等效。

