3,3′-联(1,2,4-噁二唑)-5,5′-二甲醇(BOD)的水解反应机理与合成工艺
薛 达,王小军,徐子帅,王守飞,李永祥,刘 威,曹端林
(1.中北大学化学与化工学院,山西 太原 030051; 2.甘肃银光化学工业集团有限公司,甘肃 银光 730900; 3.中北大学环境与安全工程学院,山西 太原 030051)
0 引 言
熔铸炸药是一种将液相载体炸药和固体高能炸药以熔融态进行铸装的混合炸药,具有加工制造工艺简单、成型时间短、可在战时快速补充等优点,因而成为目前世界上应用最为广泛的军用混合炸药之一[1-5]。理想的熔铸炸药载体需要具备密度高、熔点低、能量高、感度低、力学性能良好、蒸汽压低、工艺绿色等特点。目前,我国最常用的熔铸炸药载体是梯恩梯(TNT),但由于其存在渗油、缩孔、有毒、能量低等缺陷[6-7],难以满足新型熔铸炸药载体的发展需求,面临淘汰[8]。
为了寻求能够替代TNT 的性能更加优异的熔铸炸药载体,近年来各国学者开展了广泛的研究[9-12]。其中,美国陆军研究实验室报道的3,3'-联(1,2,4-噁二唑)-5,5'-二甲硝酸酯(BOM)[13]是新型熔铸炸药载体的典型代表,因其具有优异的高能钝感性能而被评为2018年美国陆军十大创新技术之一[14]。BOM 的熔点为84.5 ℃,与TNT 相当。密度(1.832 g·cm-3)和爆速(8180 m·s-1)及爆压(29.4 GPa)显著高于TNT(密度:1.65 g·cm-3;爆速:6950 m·s-1;爆压:20.5 GPa)。撞击感度为8.7 J,摩擦感度为282 N,其安全性能优于黑索今(RDX,撞击感度:6.2 J;摩擦感度:156 N)。因此,BOM 被认为是一种相对安全的材料,在熔铸炸药领域有望作为TNT 的替代品[15-20]。目前,BOM 主要以二氨基乙二肟为原料通过三步合成法来制备[13],其中间体3,3'-联(1,2,4-噁二唑)-5,5'-二甲醇乙酸酯(BODM)通过水解反应生成3,3'-联(1,2,4-噁二唑)-5,5'-二甲醇(BOD)是合成BOM 的关键步骤之一。然而,目前有关该水解反应工艺的研究相对匮乏,尤其是其制备机理尚不明确,相关文献[13,21]仅对其制备方法进行了报道,而对其合成机理及工艺的研究尚未开展,亟待开展BOD 的合成工艺研究。
本研究对BODM 通过水解反应制备BOD 进行了系统的研究,首次报道了BOD 的单晶结构,通过过渡态搜索,对水解反应的机理进行了分析,探究了BOD的制备工艺,通过正交实验优化了工艺条件,期望对BOD 进一步的研究提供参考,同时也对后续BOM 的放大和规模化生产提供一定的参考。
1 实验部分
1.1 试剂与仪器
试剂:乙腈、N,N-二甲基甲酰胺、无水碳酸钾,上海阿拉丁生化科技股份有限公司;二氨基乙二肟,上海毕得医药科技有限公司;乙酰氧基乙酰氯,安耐吉化学;甲醇,上海麦克林生化科技有限公司;发烟硝酸,成都科隆化学品有限公司,以上均为分析纯;去离子水,实验室自制。
仪器:DF-101S 集热式恒温加热磁力搅拌器,上海力辰邦西仪器科技有限公司;真空干燥箱,上海一恒科学仪器有限公司;Therm Fisher Nicolet 1S5 型傅里叶变换红外光谱仪,赛默飞世尔科技公司;Bruker-DRX400 型超导核磁共振仪,瑞士布鲁克公司;X6 型精密熔点测定仪,北京中仪博腾科技有限公司;Bruker-SMART 型X 射线衍射仪,瑞士布鲁克公司;Bruker APEX-II CCD 型单晶衍射仪,瑞士布鲁克公司;差示扫描量热仪,德国耐驰仪器公司。
1.2 BOD 的制备[13]
参考文献[13],向三口烧瓶中依次加入BODM(3.0 g,10.64 mmol),碳酸钾(0.147 g,1.064 mmol)和90 mL 甲醇。将反应物在45 ℃下搅拌反应8 h,然后减压蒸馏得到粗品。加入20 mL 去离子水搅拌30 min,过滤收集固体,在60 ℃下烘干过夜,得到白色固体,为BOD,得率为94%,纯度为99%。
BOM 的合成:以二氨基乙二肟为原料,经过环化脱水缩合反应得到BODM,经过水解反应得到BOD,经过硝化反应得到最终产物BOM。具体合成路线如Scheme 1 所示。
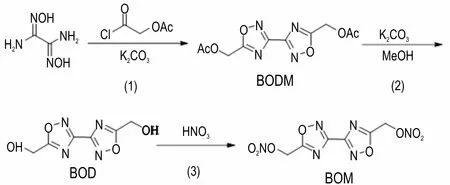
Scheme 1 Synthesis route of BOM
1.3 BOD 水解反应机理
采 用 密 度 泛 函 理 论(DFT)[22]的 方 法,在B3LYP/def2svp 的水平上对BOD 水解反应中可能的过渡态、中间体及产物的分子结构进行优化和振动分析计算,确认了过渡态结构振动频率分析只存在一个虚频,内禀反应坐标(IRC)反应路径连接的是反应物和产物,用于确认过渡态的准确性。在同样基组下优化反应物和产物,得到振动频率分析无虚频的分子结构,此结构为能量的最低点。活化能的计算如式(1)[23]:
式中,ΔH为化学反应焓变,kJ·mol-1;HTS为过渡态焓的总量,kJ·mol-1;HR为反应物焓的总量,kJ·mol-1。在DFT 计算过程中得到其焓、热能和吉布斯自由能等数据用于计算活化能。反应中的速率常数K 由Eyring 方程[23]计算得出(式(2)):
式中,kB为玻尔兹曼常数,1.38064×10-23J·K-1;h 为普朗克常数,6.6260696×10-34J·s;T为温度,298~500 K;n为总反应的计算系数;P0为压力,1.0×105Pa;R 为摩尔气体常数,8.31480 J·mol-1·K-1。ΔS≠为过渡态和反应物的熵变,J·mol-1;ΔH≠为过渡态和反应物的焓变,J·mol-1。
1.4 BOD 的的制备工艺优化
采用单因素实验探究了BODM 水解制备BOD 反应中,BODM 与碳酸钾的摩尔比、反应时间、反应温度、溶剂甲醇的用量对BOD 得率的影响,根据单因素实验结果,选取合适的因素水平进行正交实验,探究较优的工艺条件。
1.5 BOD 的表征与测试
单晶检测:布鲁克公司的Bruker APEX-II CCD 衍射仪,测试温度150 K,晶体结构通过Olex2 软件的SHELXT[24]结构解析程序以固有相位法解出,并采用全矩阵最小二乘法通过SHELXL 软件包进行精修。
核磁共振:布鲁克公司的Bruker-DRX400 型超导核磁共振仪测试BOD 的氢谱(1H NMR)和碳谱(13C NMR),氘代试剂采用二甲基亚砜(DMSO)。
红外光谱:赛默飞世尔科技公司的Therm Fisher Nicolet 1S5 型傅里叶变换红外光谱仪,采用KBr 压片测试,测试波数范围400~4000 cm-1。
X 射线衍射:布鲁克公司的Bruker-SMART 型X 射线衍射仪,测试靶材为铜靶,测试角度10°~80°,扫描速度5 °·min-1。
DSC 测试:耐驰仪器公司的差示扫描量热仪,升温速率为5,10,15,20 K·min-1,测试温度范围0~350 ℃。
2 结果与讨论
2.1 结构表征
1H NMR(600MHz,DMSO-d6)δ:4.87(s,4H),6.16(s,2H);13C NMR(151MHz,DMSO-d6)δ:178.50,156.94,52.74;IR(KBr,v/cm-1):3334(m),2928(w),2853(w),1576(m),1430(m),1248(m),1200(m),1080(s),979(m),896(m),732(m),688(m)。其中v=3334 cm-1处为羟基(缔合)的伸缩振动峰,v=2928 cm-1处为亚甲基(─CH2)的对称伸缩振动峰,v=2853 cm-1处为亚甲基(─CH2)的反对称伸缩振动峰。DSC(5 K·min-1):278.37 ℃(dec.)
将BOD 溶于N,N-二甲基甲酰胺(DMF)溶液,在室温下缓慢挥发得到其单晶,在Bruker APEX-II CCD 衍射仪上进行测试。晶体数据见表1,单晶图和晶胞堆积图如图1 所示。可知BOD 晶体属于单斜晶系,空间群为C2/c,晶胞参数为a=15.0958(16) Å,b=4.1594(5) Å,c=12.799(3) Å,α=90°,β=105.361(7)°,γ=90°,V=774.9(2) Å3,z=4。在BOD 分子中,1,2,4-噁二唑环是共面的,并且醇羟基相对于环采用反式构型。C3原子几乎与环共面(原子到平均平面的距离为0.0258(4) Å),C(3)—O(2)键稍微扭曲出平面,扭转角O(1)—C(2)—C(3)—O(2)为166.2(12)°,N(1)—C(2)—C(3)—O(2)为-14.5(2)°。
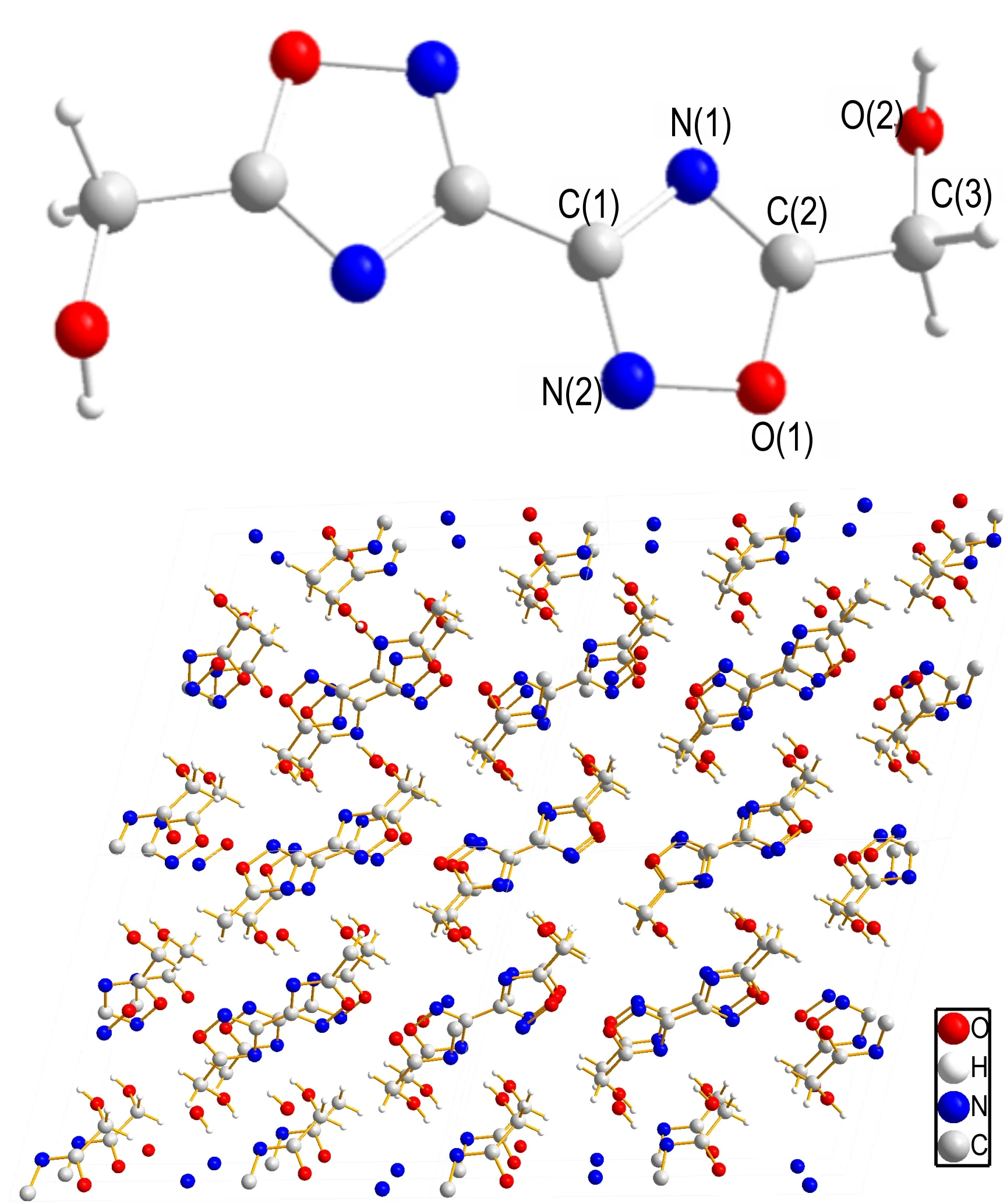
图1 BOD 的单晶图和晶胞堆积图Fig.1 Single crystal diagram and cell stacking diagram of BOD

表1 BOD 的晶体数据Table 1 Crystal data of BOD
2.2 BOD 水解机理
通过密度泛函理论(DFT)的方法,在B3LYP/def2svp 的水平上计算了BODM 水解生成BOD 的过渡态,得到了过渡态的结构、能量、振动频率等信息,最终得到BODM 水解生成BOD 反应的活化能,结果如图2所示,水解反应机理如图3所示。可以看出在水解反应中,首先由BODM 中的—[O]—中的孤对电子与H2O中的H 形成OH…O 氢键,随后—[O]—[C=O]—中的O—C 键 断 裂,H2O 中 的H 和OH 键 距 离 由 稳 态 的0.971 Å(图3 R3)增加到1.167 Å(图3 TS3)。H2O 中的H 和OH 键分别于—[O]—和—[C=O]—成键形成—OH 和—COOH 基团。由R3 到P3 的正向反应活化能为179.565 kJ·mol-1,其逆向反应的活化能为183.072 kJ·mol-1,逆向反应的活化能大于正向反应的活化能,正向反应进行较为容易。但由于二者之间相差仅为3.507 kJ·mol-1,反应存在可逆性,水解和脱水加成反应可同时存在。
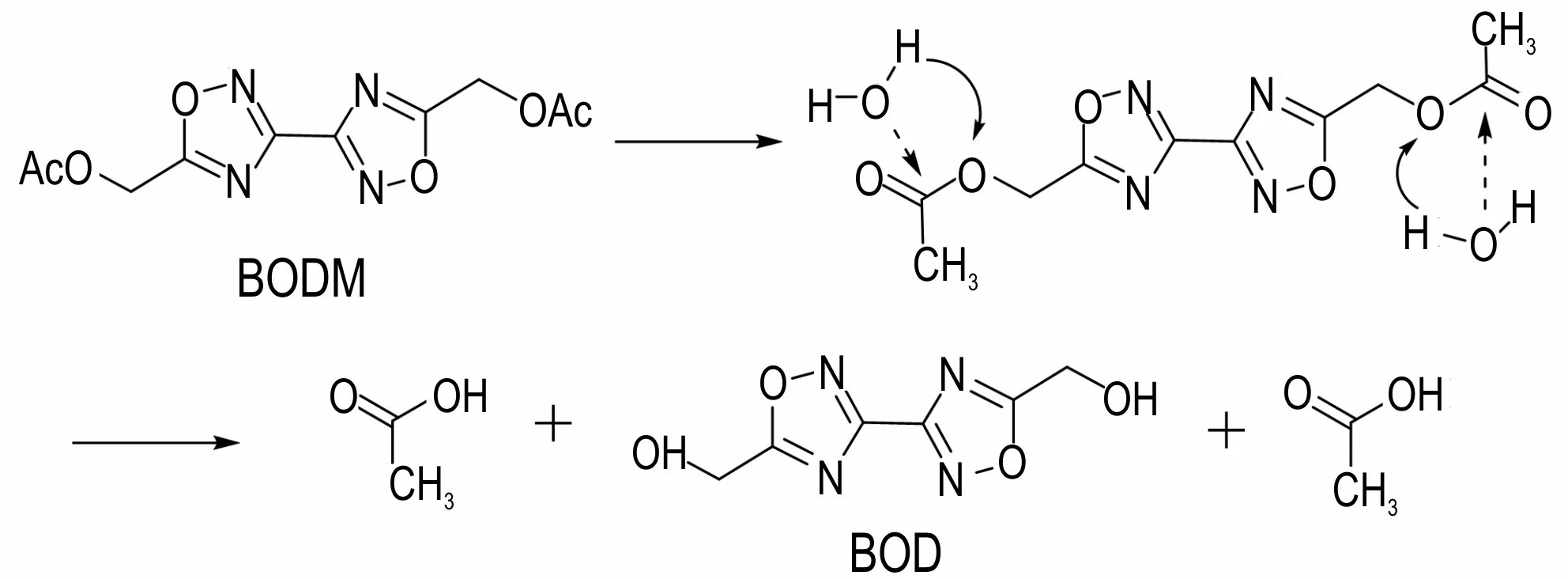
图3 水解反应机理示意图Fig.3 Schematic diagram of hydrolysis reaction mechanism
2.3 BOD 工艺优化
2.3.1 BODM 与碳酸钾的摩尔比对得率的影响
在反应温度为25 ℃,反应时间为48 h,溶剂甲醇为10 mL 的条件下,探究不同BODM 与碳酸钾摩尔比对1 g BODM 反应生成BOD 得率的影响,其中BODM与碳酸钾的摩尔比分别为2∶1,6∶1,10∶1,14∶1,15∶1,18∶1,20∶1,结果如图4 所示。由图4 可以看出随着BODM 与碳酸钾摩尔比的增加,BOD 的得率呈现出先增加后减少的趋势,BODM 与碳酸钾的最佳摩尔比为15∶1。分析认为这可能是由于摩尔比为15∶1 时刚好完全反应,继续增加摩尔比,会使反应体系中碳酸钾用量过高,从而与其它物质反应生成副产物,使得率降低。
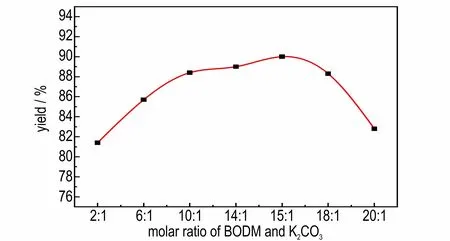
图4 BODM 与碳酸钾的摩尔比对BOD 得率的影响Fig.4 Effect of molar ratio of BODM to potassium carbonate on yield of BOD
2.3.2 反应时间对得率的影响
在反应温度为35 ℃,BODM 与碳酸钾摩尔比为15∶1,溶剂甲醇为20 mL 的条件下,探究不同的反应时 间(2,4,8,12,16,24,36,48,60,72 h)对1 g BODM 反应生成BOD 得率的影响,结果如图5 所示。由图5 可以看出在0~8 h 内,随着反应时间的增加,得率逐步上升,反应时间为8 h,反应完全,得率最大;在8~72 h 内,随着反应时间的增加,得率曲线较为平稳。说明在温度为35 ℃,溶剂为20 mL 的条件下,8 h 的时间已经足够完全反应。相较于文献[13]报道的25 ℃下,1 g BODM 在2 mL 溶剂下反应48 h,增大了反应温度和溶剂用量,大大减少了反应时间。
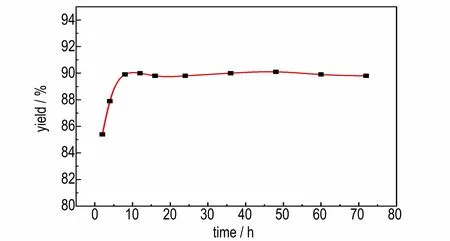
图5 反应时间对BOD 得率的影响Fig.5 Effect of reaction time on yield of BOD
2.3.3 反应温度对得率的影响
在反应时间为8 h,BODM 与碳酸钾摩尔比为15∶1,溶剂甲醇为20 mL 的条件下,探究不同的反应温度(25,35,45,55,65 ℃)对1 g BODM 反应生成BOD 得率的影响,实验结果如图6 所示。由图6 可以看出在0~40 ℃内,随着温度的升高,BOD 的得率缓慢上升;在40~65 ℃之间,随着温度的升高,BOD 的得率明显下降。说明在高温条件下可能会导致副产物增多使得率明显降低。相较于文献[21]报道的1 g BODM在50 mL 溶剂下升温至回流2 h,增大了反应时间,降低了反应温度和溶剂的用量。
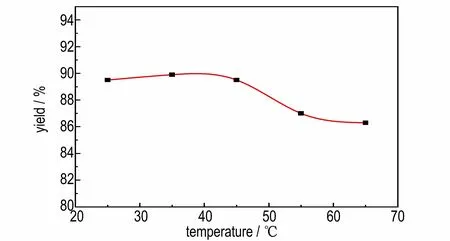
图6 温度对得率的影响Fig.6 Effect of reaction temperature on yield of BOD
2.3.4 溶剂用量对得率的影响
在反应时间为8 h,反应温度为35 ℃,BODM 与碳酸钾摩尔比为15∶1 的条件下。探究不同的溶剂用量(10,20,30,40,50 mL)对1 g BODM 反 应 生 成BOD 得率的影响,实验结果如图7 所示。由图7 可知随着溶剂用量的增多,BOD 的得率呈现出先增大后趋于平稳的情况。说明在温度为35 ℃,溶剂为20 mL 的条件下,反应物已经基本反应完全,继续增大溶剂用量并不会使得率有明显的提高。
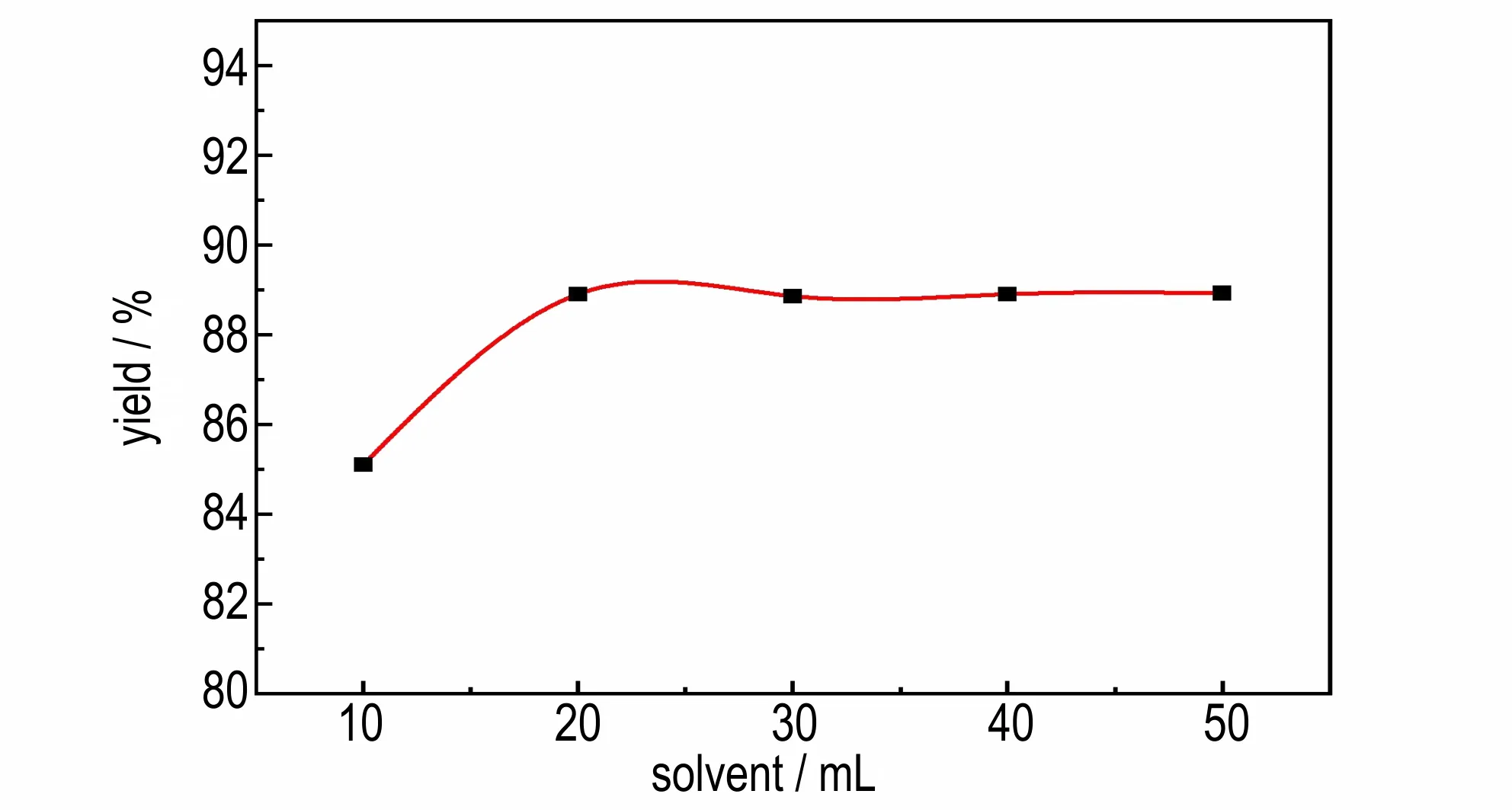
图7 溶剂用量对BOD 得率的影响Fig.7 Effect of solvent dosage on yield of BOD
2.3.5 正交实验
通过单因素实验可知,反应时间、反应温度、溶剂用量这3 个因素对BOD 的得率有明显的影响,因此对以上3 个因素进行正交实验来探索较优的工艺条件。反应时间选取2,4,8 h;反应温度选取25,35,45 ℃;溶剂用量选取20,30,40 mL。因素水平表如表2 所示,正交实验及结果如表3 所示。通过极差分析确定影响得率大小的影响因素为:反应温度>反应时间>溶剂用量。得出较优的工艺条件为:反应时间为8 h,反应温度为45 ℃,溶剂用量为30 mL,得率为94%。
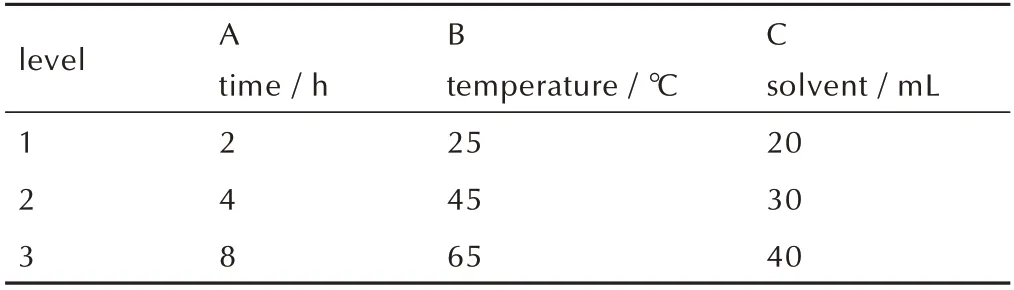
表2 正交实验因素水平表Table 2 Orthogonal experimental factor level table
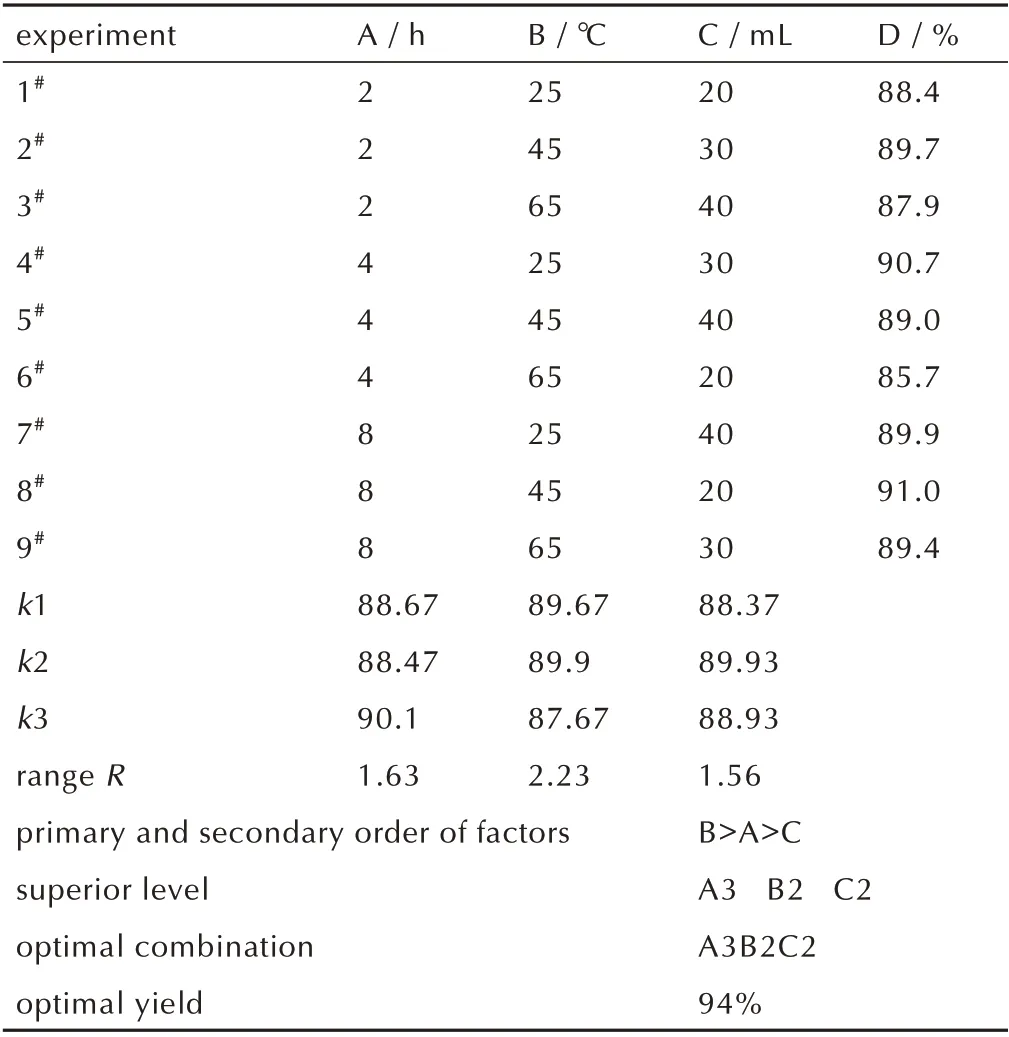
表3 正交实验表及实验结果Table 3 Orthogonal experiment table
2.4 BOD 的性能
对BOD 进行DSC 测试来表征其热分解性能,升温速率设置为5 K·min-1,如图8 所示,可以看出BOD在50~350 ℃之间,先吸热融化,后放热分解。BOD在196.41 ℃开始融化,融化峰温Tm为197.18 ℃,初始分解温度To为249.98 ℃,分解峰温Tp为278.37 ℃,外推起始温度Te为239.74 ℃。
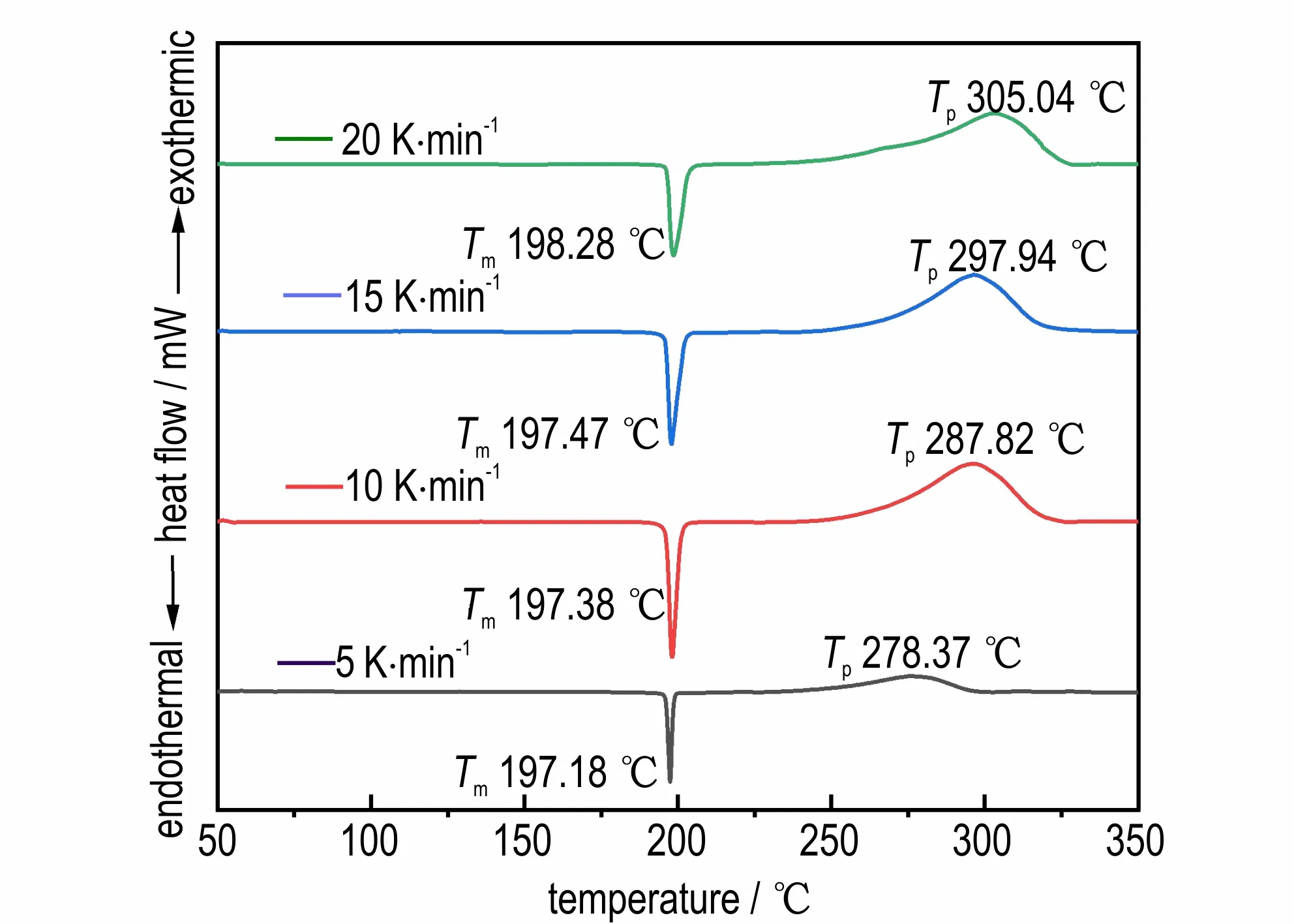
图8 不同升温速率下BOD 的DSC 曲线Fig.8 DSC curves of BOD at different heating rates
不同升温速率下的BOD 的DSC 测试结果如图8 所示,由图8 可以看出,BOD 的融化峰温在不同升温速率下基本保持不变,但随着升温速率的升高,分解峰温也随之升高。这是由于在高升温速率下,样品内部温度分布不均匀,体系不能很快响应,存在滞后性。因此升温速率越快,分解峰温越高,峰面积越大,峰形也越尖锐。
表4 为BOD 的DSC 数据。根据测得的DSC 数据,结合Kissinger 法[25]可以算出BOD 的活化能,相关动力学方程如下(式(3)):
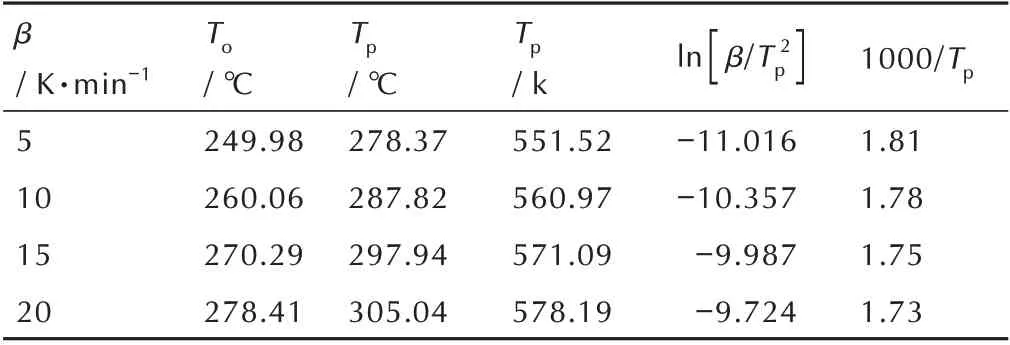
表4 BOD 的DSC 数据Table 4 DSC results of the BOD
式 中,β为 升 温 速 率,K·min-1;To为 热 分 解 起 始 温度,℃;Tp为热分解峰值温度,℃;R 为理想气体常数,8.314 J·mol-1·K-1;Ea为活化能,J·mol-1;A为指前因子。
Note:βis heating rate.Tois thermal decomposition starting temperature.Tpis thermal decomposition peak temperature.
根据式(3)可以计算出BOD 的活化能Ea为131.71 kJ·mol-(1r=0.989),指前因子lnA为27.4。
3 结 论
(1)水解反应中,BODM中的—[O]—中的孤对电子与H2O中的H形成OH…O氢键,随后—[O]—[C=O]—中的O—C 键断裂,H2O 中的H 和—OH 键分别于—[O]—和—[C=O]—成键形成—OH 和—COOH基团。
(2)通过单晶、XRD、FTIR、核磁等对BOD 的结构进行了证实。结果表明BOD 的单晶结构属于单斜晶系,分 子 式 为C6H6N4O4,空 间 群 为C2/c,z=4,a=15.0958(16) Å,b=4.1594(5) Å,c=12.799(3) Å,α=90°,β=105.361(7)°,γ=90°,v=774.9(2) Å3,Dc=1.698 g·cm-3。
(3)通过单因素实验和正交实验确定了较优的工艺条件为:45 ℃下,BODM 在碳酸钾的甲醇溶液(30 mL)中水解反应8 h,得率为94%,相比文献报道的工艺有所改进。
(4)BOD 的热性能及动力学参数显示其融化峰温为197.18 ℃,分解峰温为278.37 ℃,分解活化能为131.71 kJ·mol-1。

