柑橘黄脉病毒一步法RT-PCR 快速检测技术探究
刘顺民, 杜丹超, 蒲占湑, 朱莉, 张利平, 吕佳, 黄振东, 陈国庆, 鹿连明
(浙江省农业科学院 浙江省柑橘研究所, 浙江 台州 318020)
柑橘黄化脉明病是由柑橘黄化脉明病毒(citrus yellow vein clearing virus, CYVCV) 引起的一种柑橘病毒病害, 是α 线性病毒科印度柑橘病毒属的成员之一, 基因组为正义单链RNA 病毒,由7 529 个核苷酸组成, 包含6 个开放阅读框 (图1), 编码6 种分子量大小分别为187.0、25.0、12.0、6.4、34.0 和 23.0 ku 的 蛋 白 质[1-2]。CYVCV 能够危害绝大多数柑橘种类, 受害植株的叶片卷曲黄化, 叶脉发黄变成透明化, 以柠檬和酸橙最为敏感[3-7], 葡萄柚、琯溪蜜柚和部分甜橙、宽皮柑橘品种感病后仅春梢嫩叶表现出轻微脉明,枝梢老熟后症状消失[8], 枸橼、墨西哥莱檬、椪柑感病后症状不明显[9]。研究[10]还显示, CYVCV在不同寄主上引起的症状差异与植株中的病毒含量无显著关联。CYVCV 除了可侵染柑橘属的大多数种外, 还可以侵染豇豆、菜豆、辣椒、藜麦等草本植物[4-5,9]。近年来在锦葵、龙葵、野芥、葡萄和田野毛茛上也检测出了CYVCV[6,11]。前期研究[5]发现,可通过豆蚜和绣线菊蚜在菜豆之间, 以及从柠檬到菜豆间进行传播; 近期研究[11-12]发现, CYVCV 可通过柑橘粉虱、绣线菊蚜和棉蚜在柑橘品种之间传播。截至目前未找到该病毒可通过种子传毒的证据[13]。
柑橘黄脉病最早于1988 年在巴基斯坦的柠檬和酸橙上被发现[14-15]。随后在土耳其和印度也有报道[16-18]。2009 年在中国云南瑞丽[9]的柠檬上发现后, 已陆续在四川、重庆、江西、湖南、浙江等多个柑橘主产省区检测出[2,7,19-20]。当下国内外并无针对CYVCV 的特效药和抗CYVCV 的柑橘品种,为了强化对该病的检验检疫, 严防该病在国内柑橘产区传播, 迫切需要快速评价田间柑橘CYVCV 侵染情况, 对柑橘安全生产具有重要的指导意义。
现已有一些对CYVCV 的诊断方法, 20 世纪90 年代初, 有学者用柠檬和酸橙来当作CYVCV 的指示植物[14]; 另外在土耳其首次报道锦葵、龙葵、野芥和田毛茛也可作为CYVCV 的指示植物[5];2003 年, Ahlawat 等[16]从感病的菜豆中分离纯化CYVCV, 制备了多克隆抗体, 建立了DAS-ELISA检测 体系; 2012 年, Loconsole 等[1]利用电镜首次观察到CYVCV 的病毒粒子, 将纯化的CYVCV 粒子注射兔子获得多克隆血清, 利用Western-blot 区分了CYVCV 和印度柑橘环斑病毒 (India citrus ringspot virus, ICRSV), 对CYVCV-Y1 全基因序列测定, 设计出一对特异性检测引物, 但灵敏度有待进一 步 优 化 提 高。2015 年, 宾 羽 等[21]通 过 对CYVCV 的多克隆一抗及羊抗兔二抗的最佳稀释度进行优化, 建立了CYVCV 的DTBIA 检测方法, 既保持了ELISA 的灵敏度和特异性, 还简化了操作,延长了样品保存时间。同年, 刘宏科等[22]利用CYVCV 的外壳蛋白设计特异性引物, 建立了简单、快速、特异性强且灵敏度高的RT-LAMP CYVCV检测体系。2016 年, 周彦等[23]根据CYVCV RNA结合蛋白基因的保守序列设计2 对特异引物, 建立了巢式RT-PCR 检测体系, 与常规RT-PCR 相比,灵敏度提高了100 倍。2017 年, 宋震等[24]选择CYVCV 比较保守的外壳蛋白基因为靶标设计引物,建立染料类实时荧光定量PCR 检测方法, 较RTPCR 提高了100 倍。2021 年, 马志敏等[25]利用逆转录重组聚合酶扩增技术 (reverse transcriptionrecombinase polymerase amplification, RT-RPA), 结合侧向流层析试纸条, 建立了一种快速、裸眼可视的新检测方法, 该方法灵敏度与RT-PCR 检测方法相近。目前, 常规PCR 扩增技术应用于CYVCV 的诊断鉴定是基于对其基因组序列设计引物而进行的, 不同基因片段设计出的引物其检测特异性和灵敏度也各不相同。本文旨在根据CYVCV 基因组序列设计筛选特异性引物对, 通过优化PCR 条件,建立特异性强、灵敏度高的CYVCV 一步法RTPCR 鉴定诊断技术, 提高检测效率, 对及时防控该病在柑橘产区的传播具有重要的生产意义。
1 材料与方法
1.1 试验材料
感染了柑橘黄化脉明病毒的红美人柑橘材料和无感病的柑橘实生苗均由柑橘研究所保存。田间检测样品于2022 年在浙江省内各橘园随机采集。
1.2 一步法RT-PCR 检测体系的建立
根据超纯总RNA 提取试剂盒 (SIMGEN, 杭州) 操作说明书提取100 mg 的红美人柑橘叶片总RNA, 并用30 μL DEPC 水溶解, 使用NANODROP ONE 微量分光光度计RNA 读数系统 (Thermo scientific, 美国) 检测RNA 浓度为638 ng·μL-1,将D280/D260比值为2.10 的总RNA 作为一步法RTPCR 的模板。
通过NCBI 数据库下载柑橘黄化脉明病毒全基因组 序 列, 分 别 选 取 黄 脉 病 毒TGB1、TGB2、TGB3、CP和 23K基 因 为 靶 标, 使 用 Primer Explorer 5.0 设计的特异性引物 (表1), 利用SuperRT One Step RT-PCR Kit 试剂盒 (诺唯赞, 中国), 根据每对引物的Tm 值进行优化。

表1 一步法RT-PCR 引物
1.3 RT-PCR 检测性能测定
1.3.1 引物特异性检测与筛选
将柑橘黄脉病树叶片组织提取的总RNA 作为阳性模板, 健康实生苗柑橘叶片组织提取的总RNA 作为阴性对照, 采用诺唯赞公司提供的SuperRT One Step RT-PCR Kit 试剂盒, 反应体系为One Step Enzyme Mix (Dye Plus) 25 μL、One Step Enzyme Mix 2.5 μL、Primer Forward (10 μmol·L-1) 2 μL、Primer Reverse (10 μmol·L-1) 2 μL、模板RNA 2 μL、RNase-free Water 加至总体系50 μL。PCR 扩增程序为: 50 ℃逆转录30 min, 94 ℃裂解变性3 min, 随后的34 个循环包括94 ℃变性30 s, 退火温度30 s, 72 ℃延伸按照0.5 ~1.0 min·kb-1设置; 72 ℃终延伸 10 min, 4 ℃保存。供试的7 对引物中若上下游引物退火温度值差别较大,在采用上述PCR 扩增程序时发现不能有效扩增,采用Touch Down 两步法PCR, 该方法程序为50 ℃逆转录30 min, 94 ℃裂解变性3 min, 随后的10个循环包括94 ℃变性30 s, 引物1 (退火温度较低) 30 s, 72 ℃延伸按照0.5 ~1.0 min·kb-1设置; 紧接着24 个循环包括94 ℃变性30 s, 引物2(退火温度较高) 30 s, 72 ℃延伸按照0.5 ~1.0 min·kb-1设置; 最后72 ℃终延伸10 min, 4 ℃保存。通过上述各引物对及反应程序进行PCR 扩增,根据特异性扩增DNA 条带的有无进行分析。
1.3.2 引物灵敏度检测
将浓度为638 ng·μL-1的总RNA 原液按照20、400、8 000、40 000、80 000 和160 000 倍进行稀释, 分别对上述每对引物进行一步法RT-PCR检测, 比较各引物的灵敏度。
1.4 一步法RT-PCR 扩增产物的克隆和测序
将一步法RT-PCR 扩增获得的目的片段经过电泳, 用凝胶回收试剂盒 (TaKaRa, 日本) 回收纯化后, 将目的片段与pMD19-T 载体 (TaKaRa,日本) 连接, 通过热转化将连接产物转化Mach1-T1 Phage Resistant 菌株 感 受 态 细 胞。通 过 挑 取 单菌落经PCR 筛选后, 送上海生物工程有限公司测序鉴定。
1.5 一步法RT-PCR 检测体系应用
在不同地区随机采集柑橘叶片样品, 用建立的一步法RT-PCR 检测技术进行快速检测, 并评价田间CYVCV 感染情况。
2 结果与分析
2.1 RT-PCR 反应体系优化与引物筛选
利用上述引物和反应体系对CYVCV 阳性样品和阴性样品进行一步法RT-PCR 扩增, 扩增结果如图2 所示, 引物TGB-F/R 扩增目的条带不明显,且出现了非特异性扩增条带。TGB1-F/R、CP-F/R、TGB2-F/R、TGB3-F/R、23K-F/R 和Fn/En 这6 对引物具有较强的特异性。

图2 CYVCV 各引物RT-PCR 扩增图
2.2 一步法RT-PCR 检测引物灵敏度比较
为比较上述7 对引物通过一步法RT-PCR 检测CYVCV 的灵敏度, 将638 ng·μL-1的总RNA 原液依次 按 照20、400、8 000、40 000、80 000 和160 000 倍进行稀释, 结果如图3 ~9 所示, TGB1-F/R 引物灵敏度最佳, 能够检测出CYVCV 的总RNA 最大稀释倍数为160 000 倍, 在本次检测中该引物通过一步法RT-PCR 能从浓度为0.004 ng·μL-1总RNA 中检测出CYVCV。其次灵敏度较高的引物为23K-F/R 和Fn/Rn, 能检测出CYVCV 的总RNA 最大稀释倍数为80 000 倍。引物TGB2-F/R、CP-F/R、三基因盒TGB-F/R 和TGB3-F/R 在本次试验中能检测出的总RNA 最大稀释倍数分别为8 000、8 000、8 000 和20 倍, 从试验结果可看出TGB3-F/R 引物灵敏度最差, 三基因盒TGB-F/R 引物特异性最差。

图3 不同核酸稀释倍数下TGB1-F/R 引物扩增结果
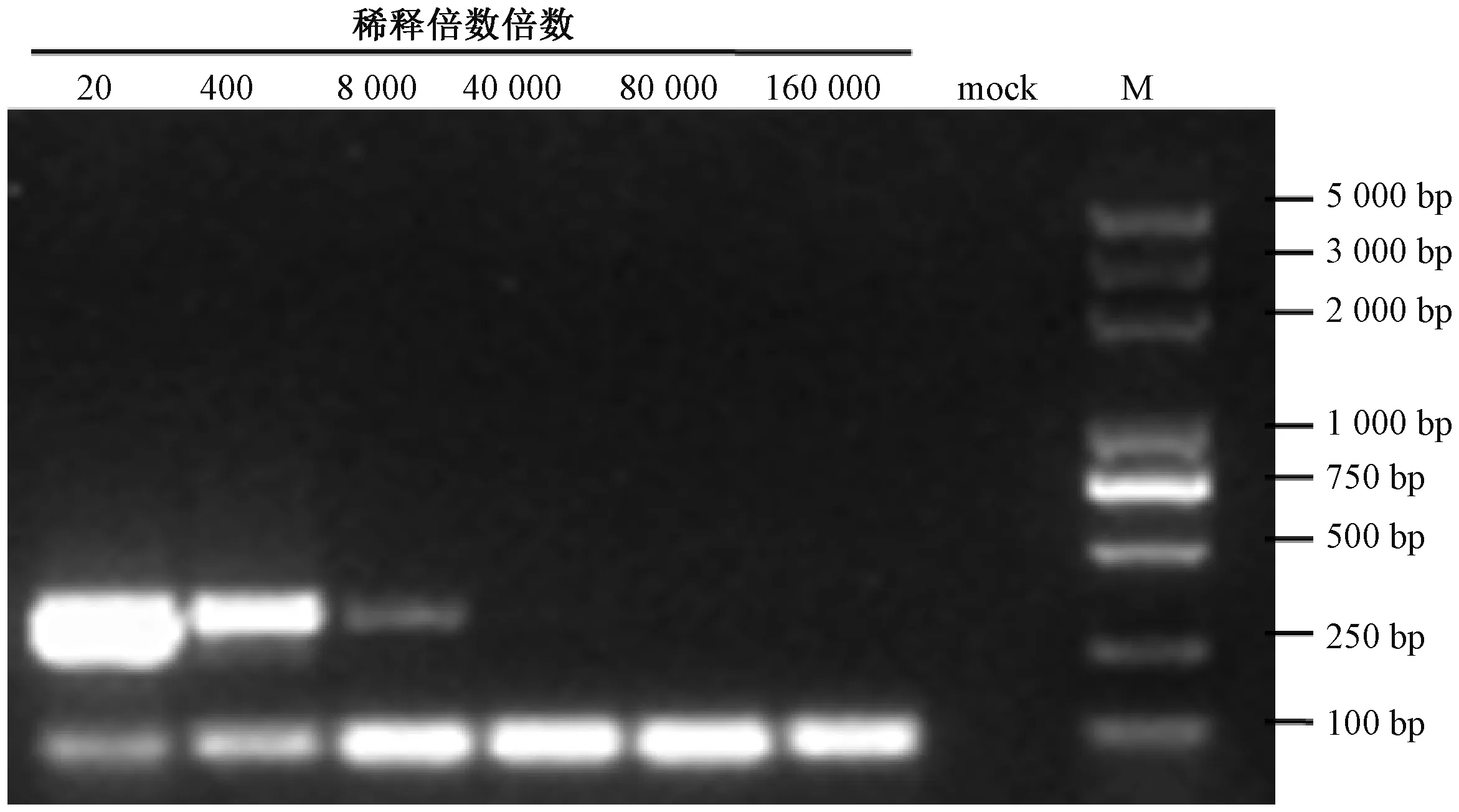
图4 不同核酸稀释倍数下TGB2-F/R 引物扩增结果
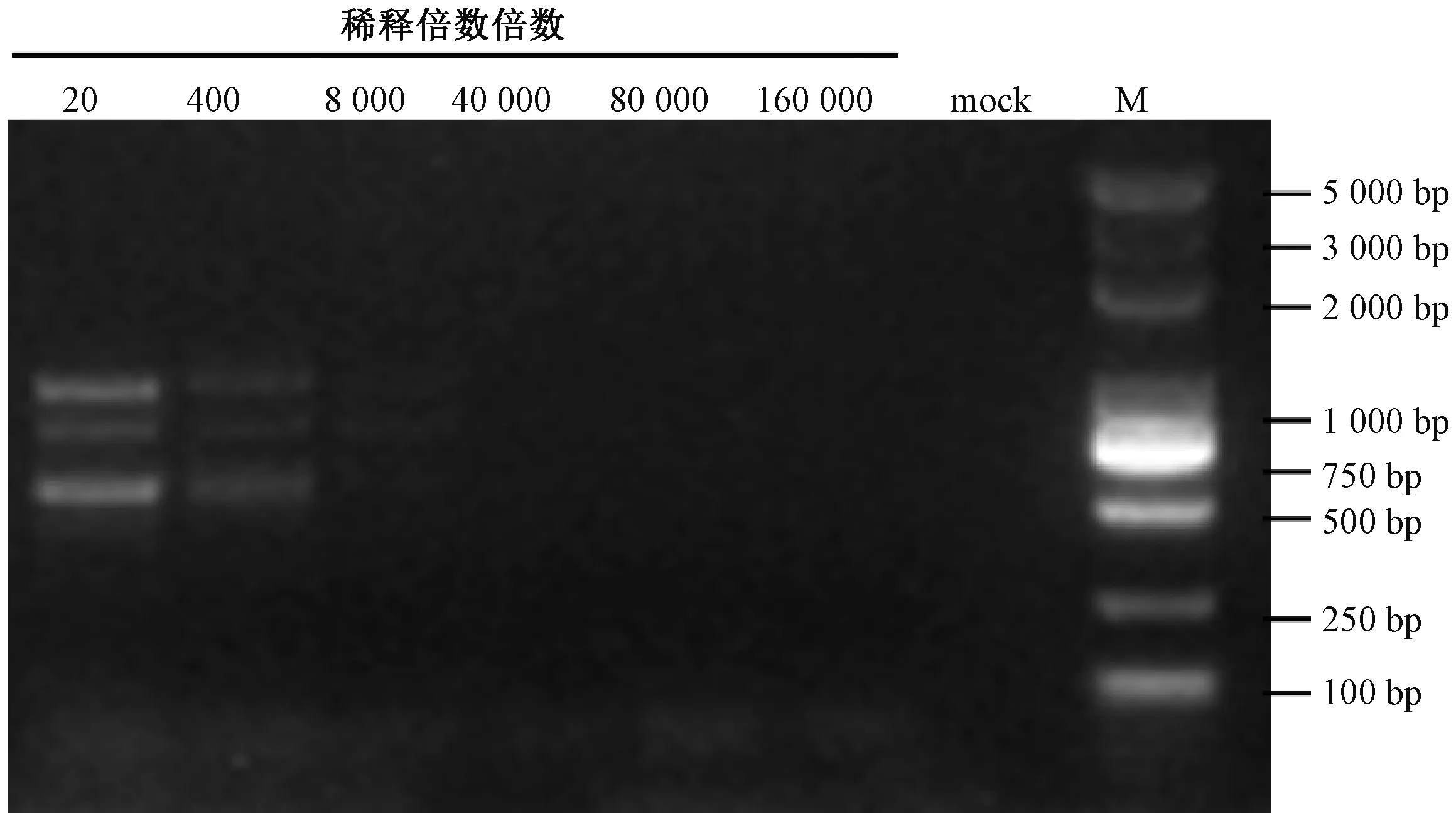
图6 不同核酸稀释倍数下三基因盒TGB-F/R 引物扩增结果

图7 不同核酸稀释倍数下23K-F/R 引物扩增结果

图8 不同核酸稀释倍数下CP-F/R 引物扩增结果

图9 不同核酸稀释倍数下Fn/Rn 引物扩增结果
2.3 一步法RT-PCR 扩增产物的克隆与测序分析
一步法RT-PCR 扩增获得的DNA 片段经电泳后回收, 连接到pMD19-T 载体上后热转化到Mach1-T1 Phage Resistant 菌株感受态细胞, 经菌落PCR 检测后将阳性克隆送测序, 测序结果在NCBI 上进行同源性比对。结果如表2 显示, CYVCV 的TGB1 基因特异性片段与重庆分离物 (KP313240.1) 同源性高达99%,TGB2 基因特异性片段与重庆分离物(KX156736.1) 同源性高达99%,TGB3 基因特异性片段与江西分离物 (MF563877.1) 同源性高达99%,CP基因特异性片段与重庆分离物(KP313240.1) 同源性高达99%, 23K基因特异性片段与重庆分离物 (KX156736.1) 同源性高达99%。

表2 CYVCV 各基因片段克隆测序结果
2.4 一步法RT-PCR 检测体系应用评价
随机在台州市、宁波市和丽水市共采集607 个柑橘叶片样品, 结合已知阴性参照和阳性参照, 应用上述检测体系进行检测, 结果如表3 所示, 共检出CYVCV 的阳性样品61 个, 检出率为10.05%,表明该检测体系具有较强的稳定性和实用性, 可运用于实验室大规模样品检测。
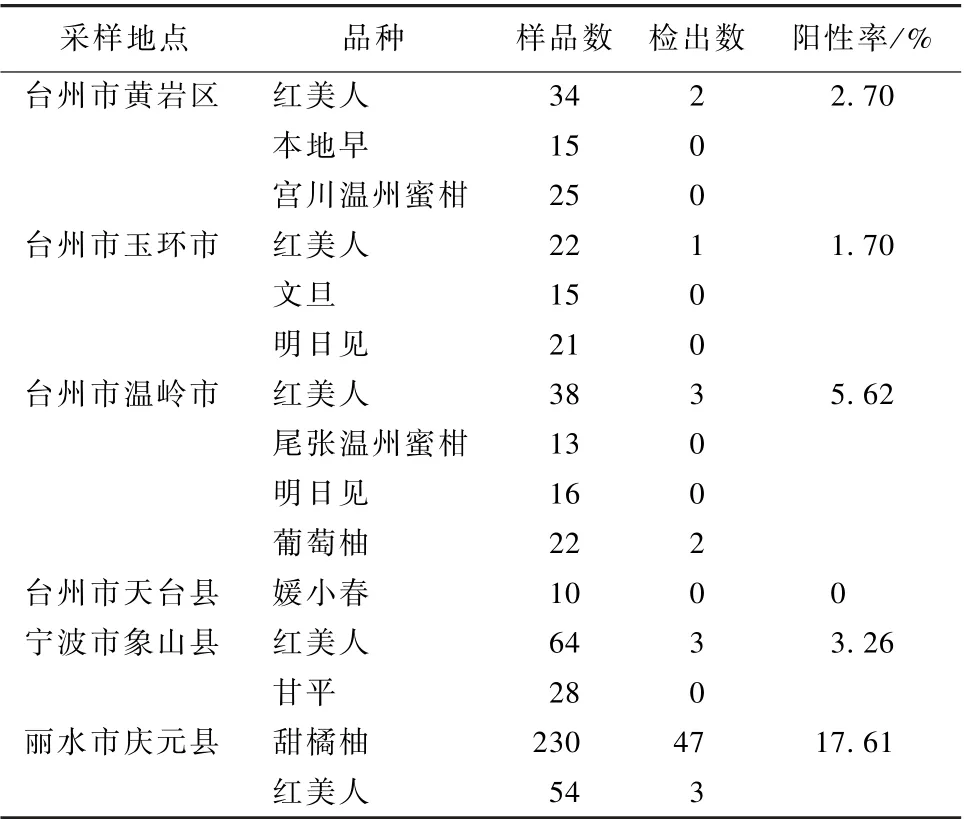
表3 CYVCV 一步法RT-PCR 检测结果
3 结论与讨论
CYVCV 是近些年报道的危害较为严重的一种柑橘病毒病害, 主要依靠苗木和嫁接枝条进行远距离传播, 为防止该病进一步在浙江省内乃至全国范围内大面积扩散传播, 加强苗木检疫是关键措施。当前针对CYVCV 检测手段有很多种, 考虑到田间检测的快速性、高效性和成本控制等诸多因素, 一步法RT-PCR 检测由于操作简便、成本较低和反应过程无须开盖等优点是目前较为合适的CYVCV 检测方法之一。本试验通过设计、筛选引物, 建立的CYVCV 一步法RT-PCR 检测体系具有特异性强、灵敏度高、稳定性好的特点, 可应用于实验室大规模检测。但是该方法仍受诸多因素影响, 在反应体系中上下游引物退火温度差别较大, 常规PCR 程序扩增效果不佳 (结果未列出), 为获得最适宜的扩增效果, 可采用Touch Down 两步法进行扩增,本试验中所提及的TGB2-F/R 和三基因盒TGB-F/R引物对均采用上述方法进行扩增。目前, 国内外对柑橘黄脉病的PCR 检测技术大多只停留在实验室阶段, 在提取总RNA 时, 对多糖多酚、蛋白酶抑制剂的处理较为繁琐, 且在检测过程中要加入各反应试剂, 从而人为导入加样误差或污染, 不适用于快速、大规模检测应用, 本试验筛选出检测灵敏度高、特异性强的引物, 结合总RNA 纯化试剂盒及反应试剂预混液试剂盒, 在保证检测结果可靠的前提下, 将全部检测时间压缩至2.5 h, 这有利于实验室检测程序的快速化和高效化。
近几年由于红美人等杂柑有着较高的经济效益, 在全国各大柑橘产区的推广种植面积越来越大。由于国内柑橘苗木培育、贩卖、运输等过程缺乏相关监管制度, 以及基层农技人员缺乏相应的检测技术, 导致柑橘病毒病未经检测监管便流通于市场, 远距离传播。因此, 相关部门应注意, 提前制定相应的措施, 防止柑橘黄脉病大规模传播造成经济损失。

