重楼皂苷在miR-125a-5p 靶向调控GAB2诱导乳腺癌细胞增殖和凋亡中的作用及机制研究
吕世文 朱亚兰 王婧婧
乳腺癌的发生、发展是一个涉及多因素、多机制参与的过程[1]。目前对乳腺癌的化疗有了更多的药物选择。传统中药具有靶点多、不良反应少、疗效好等特点,能起到良好的抗肿瘤作用。重楼皂苷(rhizoma paridis saponins,RPS)是重楼的主要生物活性化学成分,分为螺甾烷醇、异前列醇、呋甾烷醇和假螺内酯等4 类,主要包括多酚类黄酮Ⅰ、多酚类物质Ⅱ、多酚类物质Ⅳ、多酚属物质Ⅶ、格拉西林等皂苷类活性成分。研究表明,RPS 具有抗肿瘤活性[2-3]。有文献报道,miR-125a-5p 可以通过靶向调控Grb2 相关结合蛋白2(Grb2 related binding protein 2,GAB2)来抑制胶质瘤细胞和乳腺癌细胞的侵袭和转移[4],但是否可以通过调控GAB2 来影响乳腺癌细胞的增殖和凋亡未见报道。对此,本研究在探讨RPS 抗肿瘤活性作用机制时,观察了miR-125a-5p调控GAB2 对乳腺癌细胞增殖和凋亡的影响,现将结果报道如下。
1 材料和方法
1.1 细胞与试剂 人乳腺癌细胞系MCF-7 和人正常乳腺上皮细胞系MCF-10A 均购自上海生工细胞实验中心。Trizol 试剂(批号:G3013-100ML)、qRT-PCR 试剂盒(批号:G3330-50)购自武汉赛维尔生物公司;反转录试剂盒(批号:K1623)购自美国Fermentas 公司;蛋白提取试剂盒(批号:YB130890-56)购自上海钰博生物科技有限公司;BCA 定量试剂盒(批号:ZY-6C3003)购自上海泽叶生物科技有限公司;兔抗人GAB2(批号:A00634)、B 淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)(批号:A00412)和Bcl-2 相关X 蛋白(Bcl-2-associated X protein,Bax)(批号:A00523)一抗以及羊抗兔二抗(批号:A00554)均购自上海禾午生物科技有限公司;LipofectamineTM2000 转染试剂(批号:11668-019)、anti-miR-125a-5p 试剂(批号:12356-022)购自美国Invitrogen 公司;空白质粒(批号:C0012)和过表达miR-125a-5p 质粒(批号:C0045)均购自上海吉玛制药有限公司,质粒名称为pcDNA3.0;Promega 双荧光素酶系统测定试剂盒(批号:KFS305)购自北京百奥莱博科技有限公司;RPS(粉剂,规格:5 mg/瓶,批号:CYR-C0012)购自上海陶术生物科技有限公司;噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide,MTT)试剂盒(批号:M1022)购自北京索莱宝科技有限公司;原位末端转移酶标记(terminal deoxynucleotidyl transferase- mediated dUTP-biotin nick end labeling,TUNEL)细胞凋亡试剂盒(批号:22851)购自西安百萤生物科技有限公司。
1.2 细胞培养与分组 (1)MCF-7 和MCF-10A 细胞在含10%FBS 和100 mg/mL 青霉素和链霉素的DMEM培养基中孵育,置于37 ℃、5%CO2的培养箱中培养,隔天换液,待细胞生长至80%融合度时进行传代培养。将对数生长期MCF-7 与MCF-10A 细胞接种于96孔板,细胞浓度设为3×103个/孔,分别采用qRT-PCR和Western blot 法检测miR-125a-5p 和GAB2 表达水平。(2)取对数生长期MCF-7 细胞接种于96 孔板,细胞浓度为3×103个/孔,按随机数字表法分为6 组:RPS 0 μg/mL 组、RPS 80 μg/mL 组、RPS 80 μg/mL+阴性抗体组、RPS 80 μg/mL+anti-miR-125a-5p 组、RPS 80 μg/mL+ anti-miR-125a-5p+阴性干扰组和RPS 80 μg/mL+anti-miR-125a-5p+si-GAB2 组,使用移液枪分别加入相应的药物和试剂。每组设3 个复孔,结果取平均值。GAB2 阴性质粒序列为GTGGCCAACGTGCGTACG,si-GAB2 质粒序列为CAGGTTGTGTGAACA。
1.3 miR-125a-5p 表达水平检测 采用qRT-PCR法。细胞体外培养48 h 后按照说明书步骤依次提取细胞中总RNA,反转录合成cDNA,然后进行PCR 扩增。反应体系为cDNA 2 μL+SYBR Green Mix 10 μL+正向引物0.5 μL+反向引物0.5 μL+反应水7 μL。反应条件设置为95 ℃预变性2 min,95 ℃变性30 s,60 ℃退火30 s 和72 ℃延伸30 s,共进行40 个循环。最后进行熔解曲线分析,以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参,采用2-ΔΔCt法计算miR-125a-5p 表达水平。miR-125a-5p的引物序列:正向引物5'-AACCTGTGTGCGAC-3',反向引物5'-TTGGCGCGCGACATGC-3';GAPDH 的引物序列:正向引物5'-GGTTCGCACGTGCG-3',反向引物5'-CCGTGTGCGCGACGTGCG-3'。
1.4 GAB2、Bax 和Bcl-2 表达水平检测 采用Western blot 法。细胞体外培养48 h 后根据试剂盒提示步骤依次提取细胞总蛋白,使用BCA 试剂盒进行蛋白定量,并以GAPDH 为内参进行剂量标准化。取各组样品蛋白和标准品蛋白(均为30 μg)进行上样水浴,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳后转移至聚偏二氟乙烯膜上。用5%脱脂牛奶室温封闭90 min,分别加入相应的一抗,4 ℃孵育过夜。经PBS 洗涤干净后加入二抗,室温孵育2 h。PBS 洗涤后在暗室中曝光显影,使用Quantity One 凝胶分析软件测定蛋白条带灰度值,以目的蛋白条带与GAPDH 条带的灰度值比值表示目的蛋白表达水平。
1.5 细胞增殖率检测 采用MTT 法。各组细胞培养48 h 后,每孔加入20 μL MTT 后继续培养4 h,再每孔加入二甲基亚砜150 μL,振荡10 min 使沉淀溶解,快速置于酶标仪上检测波长490 nm 处的吸光度,计算细胞增殖率。细胞增殖率=(吸光度对照组-吸光度实验组)/吸光度对照组×100%。
1.6 细胞凋亡率检测 采用TUNEL 法。细胞培养48 h 后,按2×106个/孔的浓度接种于6 孔板中,4%多聚甲醛固定,0.3%Triton-X100 透化5 min。使用TUNEL 细胞凋亡检测试剂盒进行测定,即加入50 μL TUNEL 工作溶液,于37 ℃避光孵育60 min;PBS 洗涤后,加入250 μL PBS 使细胞充分悬浮,在荧光显微镜下观察荧光效果并使用软件自动计算细胞凋亡率。
1.7 miR-125a-5p 与GAB2 的靶向作用检测 采用荧光素酶Promega 检测法。构建GAB2 野生型(GAB2-wt)和GAB2 突变型(GAB2-mut)荧光素酶表达载体,使用LipofectamineTM2000 转染试剂将GAB2 与空白质粒、过表达miR-125a-5p 质粒共转染到MCF-7 细胞中培养48 h,使用Promega 双荧光素酶系统检测试剂盒检测荧光活性。
1.8 统计学处理 采用SPSS 25.0 统计软件。计量资料两组间比较采用两独立样本t检验;多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 MCF-7 与MCF-10A 细胞中miR-125a-5p 和GAB2表达水平比较 与MCF-10A 细胞比较,MCF-7 细胞中miR-125a-5p 表达水平较低,GAB2 表达水平较高,差异均有统计学意义(均P<0.05),见图1。
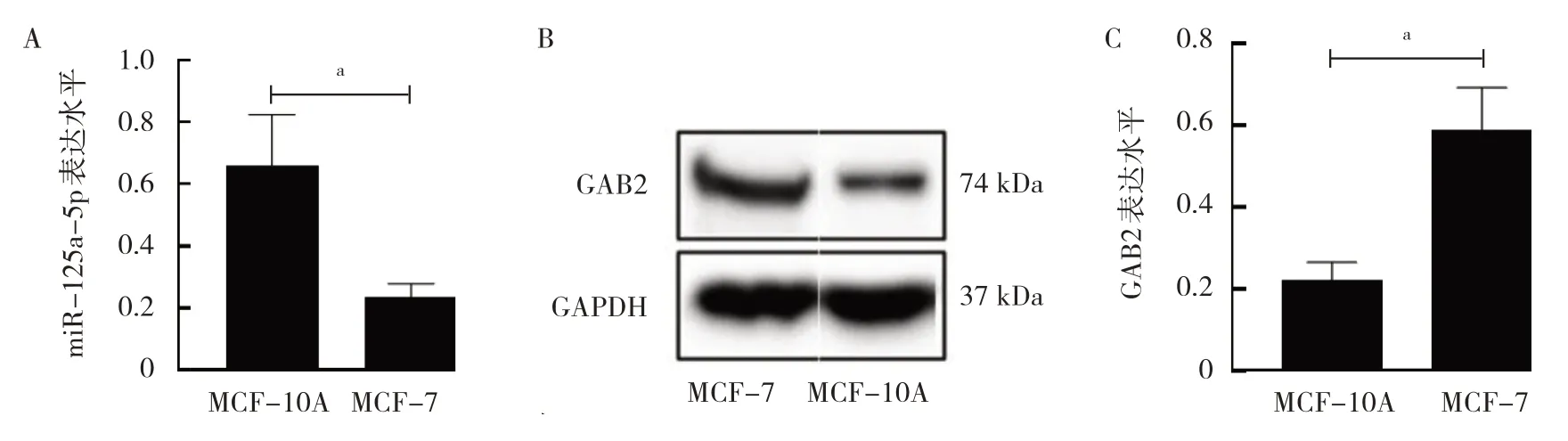
图1 MCF-7 与MCF-10A 细胞中miR-125a-5p 和GAB2 表达水平比较(A:miR-125a-5p 表达水平比较;B、C:GAB2 表达的电泳图和水平比较)
2.2 RPS 对MCF-7 细胞中miR-125a-5p 和GAB2 表达水平的影响 与RPS 0 μg/mL 组比较,RPS 80 μg/mL组和RPS 80 μg/mL+阴性抗体组miR-125a-5p 表达水平均明显升高(均P<0.05),RPS 80 μg/mL 组和RPS 80 μg/mL+ anti-miR-125a-5p+阴性干扰组GAB2 表达水平均明显降低(均P<0.05);与RPS 80 μg/mL 组、RPS 80 μg/mL+阴性抗体组比较,RPS 80 μg/mL+antimiR-125a-5p 组miR-125a-5p 表达水平均明显降低(均P<0.05);与RPS 80 μg/mL 组、RPS 80 μg/mL+ anti-miR-125a-5p+阴性干扰组比较,RPS 80 μg/mL+anti-miR-125a-5p+si-GAB2 组GAB2 表达水平均明显降低(均P<0.05),见图2。
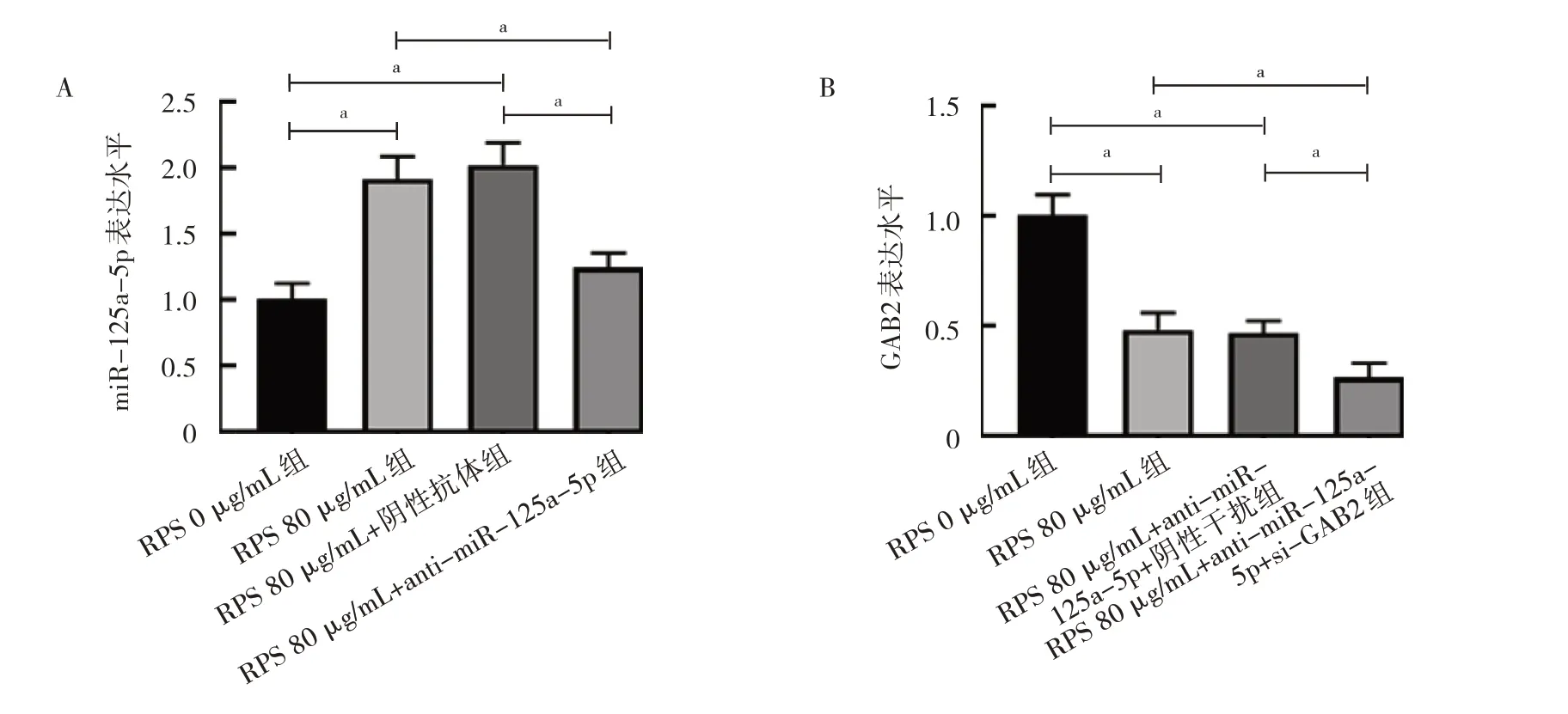
图2 RPS 对MCF-7 细胞中miR-125a-5p 和GAB2 表达水平的影响(A:miR-125a-5p 表达水平比较;B:GAB2 表达水平比较)
2.3 RPS 对MCF-7 细胞增殖和凋亡的影响 与RPS 0 μg/mL 组比较,RPS 80 μg/mL 组和RPS 80 μg/mL+阴性抗体组细胞增殖率和Bcl-2 表达水平均明显降低(均P<0.05),细胞凋亡率和Bax 表达水平均明显升高(均P<0.05);与RPS 80 μg/mL 组、RPS 80 μg/mL+阴性抗体组比较,RPS 80 μg/mL+anti-miR-125a-5p 组和RPS 80 μg/mL+ anti-miR-125a-5p+阴性干扰组细胞增殖率和Bcl-2 表达水平均明显升高(均P<0.05),细胞凋亡率和Bax 表达水平均明显降低(均P<0.05);与RPS 80 μg/mL+anti-miR-125a-5p 组、RPS 80 μg/mL+anti-miR-125a-5p+阴性干扰组比较,RPS 80 μg/mL+anti-miR-125a-5p+si-GAB2 组细胞增殖率和Bcl-2 表达水平均明显降低(均P<0.05),细胞凋亡率和Bax 表达水平均明显升高(均P<0.05),见图3。
2.4 miR-125a-5p 与GAB2 的靶向作用 荧光素酶报告显示GAB2 与miR-125a-5p 的结合位点为CAGGGA,GAB2 的突变位点为AGUCCC,见图4A。miR-125a-5p与GAB2-wt 结合能明显降低荧光活性比(P<0.05),但与GAB2-mut 结合不影响荧光活性比(P>0.05),见图4B。提示GAB2 是miR-125a-5p 的靶标。

图4 miR-125a-5p 与GAB2 的靶向关系(A:靶向结合位点;B:荧光活性比)
3 讨论
RPS 在多种肿瘤细胞中表现出较强的抗肿瘤活性,包括乳腺癌、结直肠癌、肝细胞癌和胃癌等[5-6]。研究表明,miRNA可以通过调控生物体内相关靶基因的表达,从而发挥抑制或促进肿瘤细胞侵袭和增殖的作用[7]。miR-125a-5p 是miR-125 家族成员之一,来源于pre-miR-125a 的5'端。越来越多研究证实,成熟的miR-125a-5p在肝癌[8]、结肠癌[9]、前列腺癌[10]以及非小细胞肺癌[11]等多种恶性肿瘤中起到抑制肿瘤细胞侵袭与转移的作用。作为GAB 家族重要成员之一的GAB2 支架蛋白被酪氨酸激酶磷酸化激活后,可以活化下游信号转导通路,在肿瘤细胞的增殖、分化、侵袭以及转移中发挥重要作用[12-13]。因此,笔者推测在乳腺癌细胞的侵袭和转移机制中,GAB2可能参与相关信号的传导。
本研究结果发现,MCF-7 细胞体外培养后低表达miR-125a-5p,且高表达GAB2;提示miR-125a-5p 可能抑制乳腺癌细胞的增殖,进而发挥抑癌作用;而GAB2可能是促进乳腺癌细胞增殖的效应蛋白。董建兰等[14]研究表明,人乳腺癌淋巴结转移、组织分期以及雌激素受体均与miR-125a-5p 表达水平有关,肿瘤恶性程度越高,则miR-125a-5p 表达水平越低;此外,miR-125a-5p 高表达可抑制乳腺癌细胞的侵袭和转移,与负向调控GAB2 有关。Minini 等[15]研究证实,miR-125a-5p 通过IP6K1 靶向降低乳腺癌细胞的转移潜能。磷脂酰肌醇-3-激酶(phosphatidylin-ositol-3-kinase,PI3K)/Akt 信号转导的解除是诱导乳腺癌症细胞获得转移表型的最主要原因之一,进而导致上皮-间充质转化。肌醇可以通过发挥多效性抗肿瘤作用来抑制PI3K/蛋白激酶B(protein kinase B,Akt)信号通路活性,可能与肌醇通过miR-125a-5p 转录和随后的IP6K1 抑制肿瘤转移有关。Shi 等[16]研究表明,miR-98-5p 通过靶向GAB2 调节MCF-7 乳腺癌细胞的增殖和转移。本研究还发现,RPS 80 μg/mL 能明显上调miR-125a-5p 并下调GAB2 表达,提示RPS 发挥抗肿瘤活性可能与激活miR-125a-5p 表达有关,而miR-125a-5p表达水平升高能发挥抑癌效应,并抑制GAB2 基因和蛋白的生物学功能。RPS 80 μg/mL 能够显著降低细胞增殖率和Bcl-2 表达水平,升高细胞凋亡率和Bax 表达水平,提示适宜浓度的RPS 能够发挥抑制乳腺癌细胞增殖和诱导凋亡的作用。比较RPS 80 μg/mL+antimiR-125a-5p 组与RPS 80 μg/mL 组结果发现,通过特异性拮抗miR-125a-5p 活性能够降低RPS 的抗肿瘤活性,提示miR-125a-5p 可能是RPS 发挥抗肿瘤活性的重要靶点。Yao 等[17]研究表明,RPS 具有强大的抗骨肉瘤活性,在体外和体内抑制骨肉瘤细胞的增殖、转移和血管生成拟态的形成,且呈剂量依赖性;RPS 通过下调迁移诱导基因7(migration-inducing gene 7,MIG-7)的表达,进而抑制PI3K/基质金属蛋白酶/Ln-5γ2 信号通路传导和细胞突起形成,同时通过上调miR-520d-3p 表达水平来下调MIG-7,即RPS 通过调节miR-520d-3p/MIG-7 信号轴来抑制骨肉瘤血管生成拟态的形成和转移。本研究比较RPS 80 μ g/mL+ antimiR-125a-5p+si-GAB2 组与RPS 80 μg/mL+antimiR-125a-5p 组结果发现,特异性敲除GAB2 能够部分逆转拮抗miR-125a-5p 对乳腺癌细胞增殖和凋亡的影响,提示RPS 通过影响miR-125a-5p/GAB2 轴活性继而调控乳腺癌细胞的增殖和凋亡。Jiang 等[18]研究表明,lncRNA HOXA11-AS 沉默可抑制大脑胶质瘤U251 细胞的迁移、侵袭、增殖和促进细胞凋亡,同时上调胱天蛋白酶3、胱天蛋白酶8、胱天蛋白酶9 和Bax 的表达,抑制Bcl-2 和GAB2 的表达;miR-125a 抑制剂可以部分逆转lncRNA HOXA11-AS 沉默对U251 细胞的这些作用;体内试验表明,lncRNA HOXA11-AS 抑制剂可以通过调节miR-125a 的表达来抑制大脑胶质瘤的体内生长,故推测lncRNA HOXA11-AS 通过与miR-125a 相互作用在大脑胶质瘤中起致癌基因的作用。本研究证实了GAB2 与miR-125a-5p 具有靶向结合位点。徐新伟等[19]也研究指出,miR-125a-5p 可负性调节GAB2 表达,抑制胶质瘤细胞的侵袭和转移,同时靶向负调控GAB2 抑制乳腺癌细胞的迁移能力。Wang 等[20]研究显示,miR-125a-5p 通过靶向GAB2 抑制乳腺癌症细胞的增殖和侵袭并诱导凋亡。
综上所述,RPS 能够介导miR-125a-5p/GAB2 轴发挥抗肿瘤活性,具体机制可能与miR-125a-5p 发挥抑癌效应来负向调控GAB2 蛋白表达,进而影响乳腺癌细胞的增殖和凋亡能力有关,有望成为新型抗肿瘤的中药成分。

