超声浸提-电感耦合等离子体原子发射光谱法测定土壤有效硅的含量
双 龙 ,白 杰 ,唐 琦 ,董天姿 ,滕朝阳
(1.自然资源部呼和浩特矿产资源检测中心(内蒙古自治区矿产实验研究所)内蒙古岩石矿物综合分析重点实验室,呼和浩特 010031;2.呼和浩特实验中学,呼和浩特 010010)
土壤有效硅是指土壤中可溶于水或弱酸溶液的可被植物生长吸收的硅[1]。有效硅是植物生长发育的必需元素,可以被植物根系直接吸收利用[2],是耕地土壤中的微量有益元素之一。土壤有效硅可以促进土壤中磷元素转化成植物易吸收的有效态磷[3],减少植物对重金属元素的吸收,降低矿物质毒害和非生物胁迫效应,提高植物叶绿素含量和增强植物抗病性和抗逆性等[4],能使经济作物的质量和产量显著提高[5]。生长期间的植物对硅的吸收量主要取决于土壤有效硅的含量,而土壤有效硅的供应主要受土壤母质及其理化性质(如酸度等)的影响[6]。但是,土壤有效硅含量会随着化肥的大量施用而逐渐降低[7],当土壤有效硅缺乏时,将影响植物的生长代谢,因此在研究土壤地球化学特征、土地质量地球化学等级划分、生态风险评价[8]、土壤潜力评价时,土壤有效硅含量是必需的检测指标。为满足全国土地质量地球化学调查、生态地球化学调查、农业地质调查[9]、全国农用地土壤污染详查、全国土壤普查等项目对样品数量、检测效率、准确度、重现性等方面更高、更具体要求,有必要建立一种简捷、快速、高效、准确的测定土壤有效硅含量的方法。
国家林业标准LY/T 1266-1999《森林土壤有效硅的测定》和农业标准NY/T 1121.15-2006《土壤检测 第15部分:土壤有效硅的测定》均采用硅钼蓝分光光度法测定土壤有效硅含量,该方法采用浸提剂浸泡土壤样品,浸提液中的硅会与钼酸铵反应生成硅钼酸,利用草酸掩蔽溶液中的磷干扰,硅钼酸被硫酸亚铁铵还原生成硅钼蓝,进而被分光光度法测定,这种方法操作繁琐,所用试剂种类多、用量大。并且LY/T 1266-1999所用的乙酸-乙酸钠浸提剂不适用于酸度较低土壤有效硅的提取[10];NY/T 1121.15-2006虽然加入还原剂抗坏血酸稳定了标准曲线,但显色温度、显色时间和酸度对检测结果的准确度有极大的影响,需严格控制[11-13],同时样品数量较多时检测时效性差、分析效率低。文献报道的土壤有效硅相关检测方法有氟硅酸钾容量法、重量法、电感耦合等离子体原子发射光谱法(ICPAES)和电感耦合等离子体质谱法(ICP-MS)。文献[14]采用氟硅酸钾容量法测定土壤有效硅含量,该方法操作简单、成本低,但受冷却时间、淋洗温度、指示终点温度影响较大,且终点不易判断,测定误差较大。文献[15]采用重量法测定土壤有效硅含量,该方法分析高硅含量样品时准确度较高,但是操作繁琐、分析周期较长。文献[16]采用ICP-MS测定土壤有效硅含量,该方法灵敏度较高,但是待测样品溶液稀释倍数较大,空白值偏高,测定准确度较差,同时质谱分析受14N2+、12C16O+等多原子离子干扰严重[17]。文献[18-19]采用ICP-AES测定土壤有效硅含量,该方法的准确度和稳定性较好,但是浸提时间较长(采用柠檬酸溶液于30 ℃恒温箱浸提5 h),批量检测周期长、分析效率低。在上述工作基础上,本工作改进了提取方法,优化了超声浸提功率、浸提时间、浸提温度、分析谱线、射频功率、雾化气流量等试验条件,提出了超声浸提-ICP-AES测定土壤有效硅含量的方法,并采用19种土壤标准物质进行验证。与标准方法以及文献报道的相关检测方法相比,本方法缩短了分析周期,提高了分析效率,且准确度和精密度较高,适用于不同酸度、不同类型土壤样品的分析。
1 试验部分
1.1 仪器与试剂
Optima 8300型全谱直读电感耦合等离子体原子发射光谱仪;DS-060S 型数控超声波清洗仪;AL104型电子天平;双极反渗透EDI型超纯水仪。
浸提剂:取5.25 g 一水合柠檬酸于塑料烧杯中,用去离子水溶解后,转入1000 mL 塑料容量瓶中,用水稀释至刻度,摇匀备用,配制成0.025 mol·L-1柠檬酸溶液。
硅单元素标准溶液:1 000 mg·L-1。
硅标准溶液系列:取适量硅单元素标准溶液,用浸提剂稀释至塑料容量瓶中,配制成0,10.0,20.0,40.0,60.0,80.0,100.0 mg·L-1硅标准溶液系列。
7 种土壤有效态成分分析标准物质GBW 07412a(ASA-1a)、GBW 07413a(ASA-2a)、GBW 07414a(ASA-3a)、GBW 07416a(ASA-5a)、GBW 07459(ASA-8)、GBW 07460(ASA-9)、GBW 07461(ASA-10);6种黄土土壤有效态成分分析标准物质GBW 07493(HTSB-1)、GBW 07494(HTSB-2)、GBW 07495(HTSB-3)、GBW 07496(HTSB-4)、GBW 07497(HTSB-5)、GBW 07498(HTSB-6);6种农业土壤有效态成分分析参比标准物质NSA-1、NSA-2、NSA-3、NSA-4、NSA-5、NSA-6。
一水合柠檬酸为优级纯;试验用水为超纯水。
1.2 仪器工作条件
射频功率1 150 W;雾化气压力0.206 8 MPa;雾化气流量0.55 L·min-1,辅助气流量1.0 L·min-1,冷却气流量15.0 L·min-1;蠕动泵速110 r·min-1;积分时间10 s,清洗时间20 s;硅分析谱线251.611 nm。
1.3 试验方法
取5.00 g样品置于150 mL 塑料瓶中,加入浸提剂50.00 mL,盖好瓶塞,摇匀,置于数控超声波清洗仪中,在300 W 超声功率下于30 ℃浸提2.0 h。取出塑料瓶,用定性滤纸干过滤,滤液按照仪器工作条件测定。同时做空白试验。
2 结果与讨论
2.1 浸提时间的选择
合适的浸提时间不仅有助于提取更多的待测成分,还能保证提取效率[20]。以农业土壤有效态成分分析参比标准物质NSA-1、NSA-3、NSA-5 以及土壤有效态成分分析标准物质ASA-1a为待测对象,比较了0.5,1.0,1.5,2.0,2.5,3.0 h浸提时间下土壤有效硅的测定值,结果见图1。

图1 浸提时间对土壤有效硅测定值的影响Fig.1 Effect of extraction time on the determined value of available silicon in soil
由图1可知,土壤有效硅测定值随着浸提时间的延长呈逐渐增加的趋势,在浸提时间为2.0 h时基本达到提取平衡,且测定值与认定值基本一致。因此,试验选择的浸提时间为2.0 h。
2.2 浸提温度的选择
在进行超声浸提时,受超声过程中空化效应和机械效应的影响,浸提液的温度会逐渐升高,影响土壤有效硅的测定[21]。以2.1节4种标准物质为待测对象,考察了浸提温度分别为20,25,30,35,40℃时对土壤有效硅测定的影响,结果见图2。
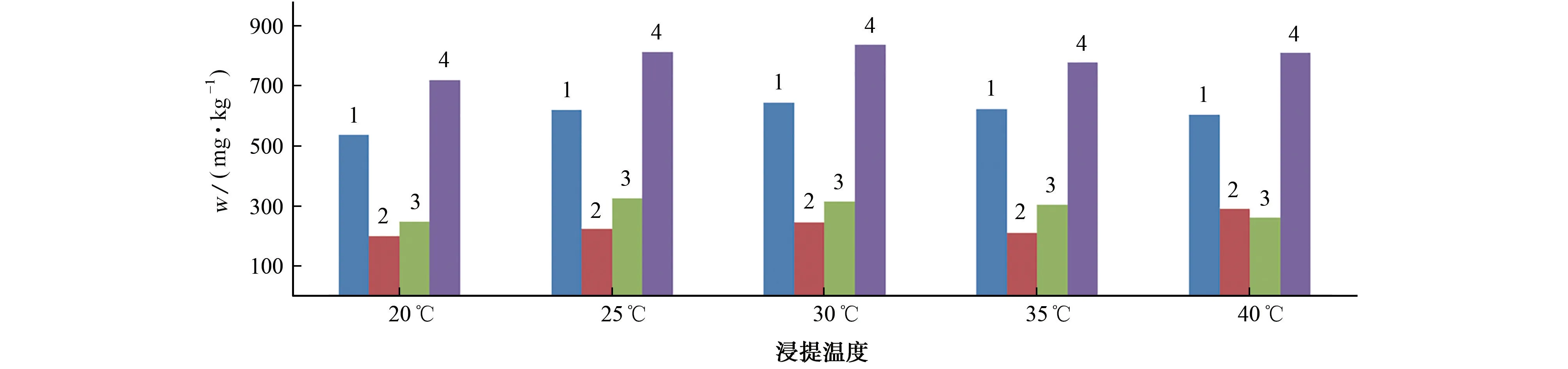
图2 浸提温度对土壤有效硅测定值的影响Fig.2 Effect of extraction temperature on the determined value of available silicon in soil
由图2可知:浸提温度为20 ℃时,土壤有效硅的测定值较低;浸提温度为25,30℃时,土壤有效硅的测定值与认定值基本一致;浸提温度高于30 ℃时,土壤有效硅测定值相较25,30℃时的变化较大。以HTSB-4标准物质为待测对象,试验进一步比较了25,30℃浸提温度下平行测定6次时硅测定值的相对标准偏差(RSD),结果分别为3.9%和2.0%,说明30℃下的精密度较好,因此试验选择的浸提温度为30 ℃。
2.3 超声浸提功率的选择
以HTSB-4标准物质为待测对象,比较了200,300,400 W 超声浸提功率下土壤有效硅的测定值。结果显示:3种超声浸提功率下土壤有效硅测定值分别为472.3,520.3,553.7 mg·kg-1;当超声浸提功率为300 W 时HTSB-4标准物质中土壤有效硅的测定值较高,且与认定值[(522+18)mg·kg-1]基本一致。因此,试验选择的超声浸提功率为300 W。
2.4 分析谱线的选择
硅分析谱线有251.611,212.412,288.158,252.851,221.667 nm 等[22],以HTSB-4标准物质为待测对象,试验比较了这5条分析谱线下硅的背景当量浓度(BEC)、响应强度和信噪比,结果见表1。
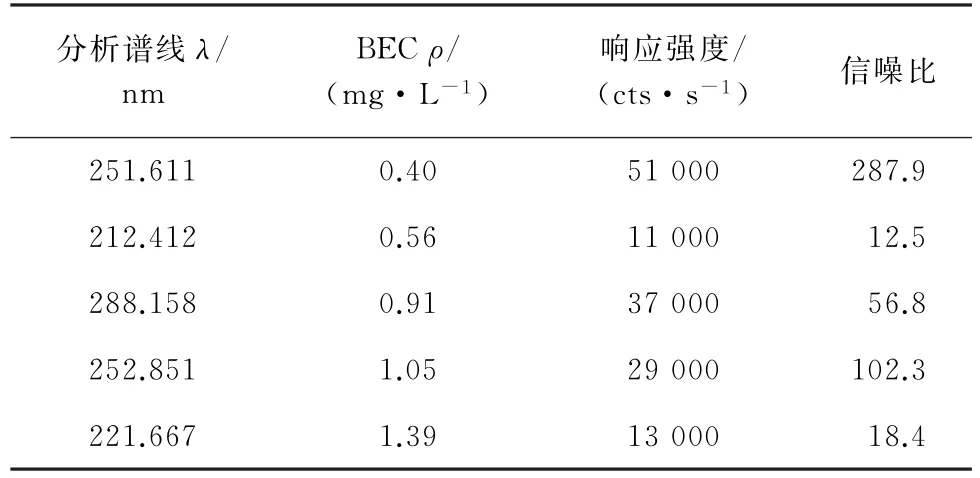
表1 不同硅分析谱线下的仪器响应Tab.1 Instrumental response with different analytical spectral lines of silicon
由表1 可知:当分析谱线为251.611 nm 时,BEC较低、信噪比较高,同时该分析谱线处无重叠干扰,基线平稳。因此,试验选择的硅分析谱线为251.611 nm。
2.5 射频功率和雾化气流量的选择
以HTSB-4标准物质为待测对象,比较了1 000,1 150,1 300 W 射频功率下土壤有效硅的测定值。结果显示,3个射频功率下有效硅的测定值分别为517.3,524.4,533.4 mg·kg-1,和认定值基本一致,但是背景响应会随着射频功率的增大而升高。综合考虑,试验选择的射频功率为1 150 W。
以2.00 mg·L-1硅标准溶液为待测对象,固定射频功率为1 150 W,比较了0.45,0.55,0.65,1.00 L·min-1雾化气流量下硅的响应强度和12次测定值的RSD,结果见表2。

表2 不同雾化气流量下硅的响应(n=12)Tab.2 Response of silicon with different atomizing gas flows(n=12)
由表2可知:当雾化气流量为0.55 L·min-1时,硅的响应强度较高,而且测定值的RSD 较小。因此,试验选择的雾化气流量为0.55 L·min-1。
2.6 标准曲线和检出限
按照仪器工作条件测定硅标准溶液系列,以硅质量浓度为横坐标,对应的响应强度为纵坐标绘制标准曲线。结果显示,硅质量浓度在100.0 mg·L-1以内与对应的响应强度呈线性关系,线性回归方程为y=3 053x+1 589,相关系数为0.999 7。
按照试验方法制备并测定12份空白溶液,计算土壤有效硅测定值的标准偏差(s),以3s计算检出限,结果为0.012 mg·kg-1,优于文献[18]和文献[19]提出的检出限(0.09 mg·kg-1和0.03 mg·L-1),满足DZ/T 0295-2016《土地质量地球化学评价规范》和DD 2005-03《生态地球化学评价样品分析技术要求(试行)》对土壤有效硅检出限的要求。
2.7 精密度和准确度试验
土壤理化性质会随着土壤种类、酸度的变化而改变,进而影响作物根系对矿物质有效态的吸收和利用。土壤酸度不同,土壤中硅形态及其含量也不同[16]。为考察本方法对各种类型以及各酸度土壤的适用性,按照试验方法测定19种土壤标准物质,每种标准物质平行测定12份,计算测定值的RSD和相对误差,结果见表3。
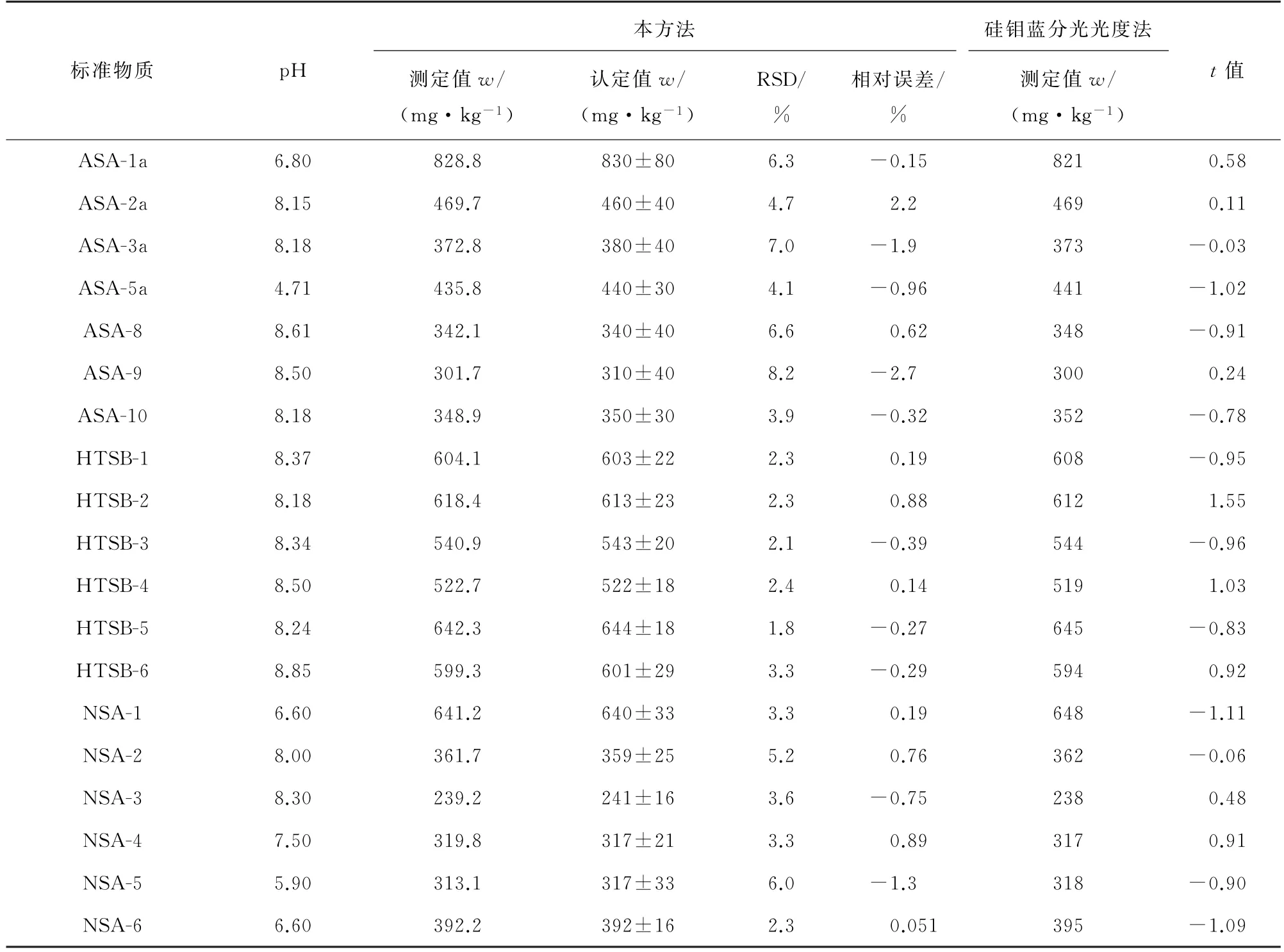
表3 精密度和准确度试验结果(n=12)Tab.3 Results of tests for precision and accuracy(n=12)
按照LY/T 1266-1999 或NY/T 1121.15-2006中硅钼蓝分光光度法平行测定19种标准物质12次,并在95%置信度下采用t检验法比较硅钼蓝分光光度法和本方法的显著性差异[23-24],结果见表3。
由表3可知:不同类型、不同酸度土壤中有效硅的测定值与认定值基本一致,测定值的相对误差绝对值均在3.0%以内,测定值的RSD 均小于10%,满足DZ/T 0295-2016和DD 2005-03的检测要求;所得t值绝对值均小于临界值(t0.05,11=2.20),说明本方法和硅钼蓝分光光度法没有显著性差异。
本工作采用超声浸提-ICP-AES测定不同类型、不同酸度土壤有效硅的含量,方法操作简单、分析快速、灵敏度高、准确度优、精密度好,满足批量样品的准确快速测定要求,可为全国土地质量地球化学调查、生态地球化学调查、农业地质调查、全国农用地土壤污染详查、全国土壤普查等项目开展提供分析技术支持。针对土壤有效硅测定值随着浸提时间的延长而增大的现象,还需进一步研究土壤中硅赋存状态以及不同硅形态与浸提剂的关系。

