自身免疫性大疱性皮肤病的实验室诊断进展
乌心怡,潘 萌,朱海琴
(上海交通大学医学院附属瑞金医院皮肤科,上海 200025)
自身免疫性大疱性皮肤病(autoimmune bullous dermatoses,AIBD)是一组由针对皮肤及黏膜组织中结构蛋白的自身抗体引起的器官特异性异质性疾病,抗原抗体反应导致了表皮内细胞间以及真表皮之间的连接破坏,皮肤黏膜黏附能力丧失,临床出现水疱[1-2]。根据水疱所在部位,可分为表皮内大疱病和表皮下大疱病。寻常型天疱疮(pemphigus vulgaris,PV)是表皮内大疱病中最常见的亚型,至少有2/3 的患者属于此类型[3-4]。在亚洲地区,PV 的发病率为每年1.6~16.1 人/百万人[3,5]。绝大部分患者的年龄都在40~60 岁,且以女性患病更为常见[5]。表皮下大疱病中大疱性类天疱疮(bullous pemphigoid,BP)是最常见的亚型[6],在亚洲地区的发病率为每年2.6~7.5 人/百万人[6]。随着年龄的增长,BP 的发病率也会随之增加,与PV 不同的是,在高于75岁的人群中,男性患者更为常见[7-8]。
在天疱疮中,自身免疫系统主要针对的是桥粒的组成部分(见表1);而在类天疱疮疾病中,自身抗体主要针对的是真表皮连接的结构蛋白[9(]见表2)。根据自身免疫系统针对的成分不同,临床应用的治疗方法也不同,因此需要依靠实验室诊断予以鉴别。目前,两者的实验室诊断以直接免疫荧光法(direct immunofluorescence,DIF)为金标准,血清学方法为辅,后者包括间接免疫荧光法(indirect immunofluorescence,IIF)、酶联免疫吸附试验(enzyme-linked immunosorbent assays,ELISA)和免疫印迹法(immunoblotting,IBT)等。近年来不断有新型实验室技术出现,包括生物芯片技术、EUROTide™孵育技术、MESACUP anti-Skin profile TEST、侧向流动免疫层析技术(lateral flow immunoassay,LFIA)、化学发光酶免疫技术、荧光叠加抗原定位-激光扫描共焦显微镜技术(fluorescence overlay antigen mapping using laser-scanning confocal microscopy, FOAM-LSCM)等。目前国内缺少对AIBD 实验室诊断方法的综合性总结,因此本文将基于AIBD 的传统实验室诊断方法,将其与新型实验室技术进展进行比较,探讨后者在AIBD 诊断中的临床应用价值。
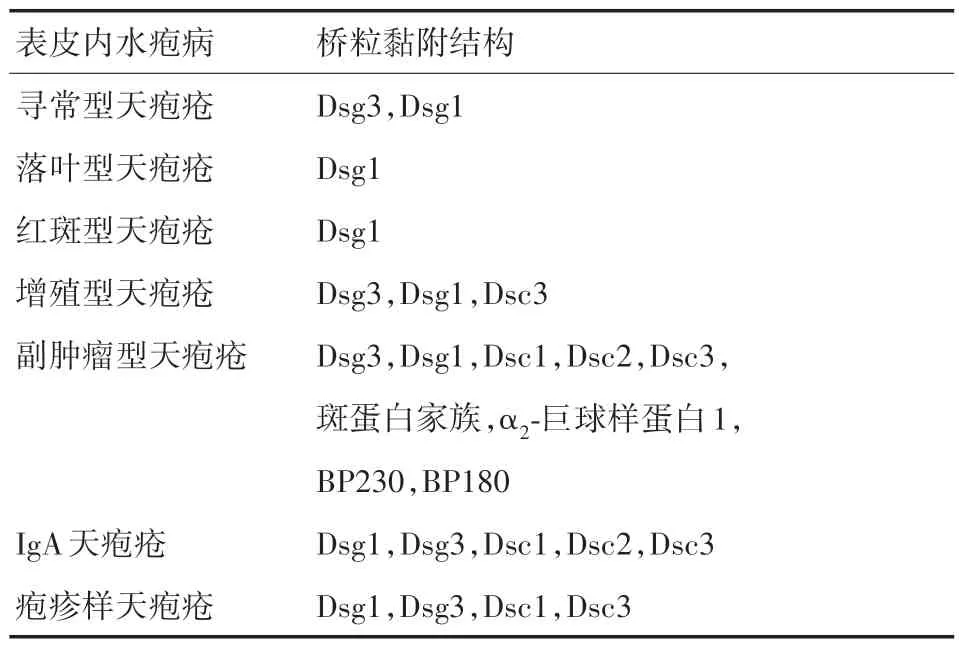
表1 表皮内水疱病的特异性抗原Table 1 Specific antigens of epidermal bullous dermatosis
1 传统实验室诊断方法
1.1 病理检查
基于受累皮肤或黏膜的组织病理学检查是鉴别诊断大疱性皮肤病最基本的实验室方法[10]。取患者的新鲜(24 h内)、完整水疱置于4%甲醛溶液中,固定后进行常规石蜡切片和苏木精-伊红染色,用光学显微镜观察浸润细胞的类型以及表真皮裂隙的部位,可以区分表皮内水疱与表皮下水疱[11-12]。
1.2 DIF
取皮损周围1~2 cm范围内的正常皮肤,通过冰冻切片技术和荧光结合物标记的抗人抗体,对沉积于皮损局部的自身抗体进行直接检测。DIF 是AIBD 最可靠、最特异性的诊断方法,其灵敏度可达到82%~91%,特异度可达到98%[13-14]。笔者团队对25 例PV 患者的分析研究发现,DIF的阳性率可以达到80%[15]。但DIF 对于明确靶抗原具有一定局限性,只能通过产生荧光沉积的抗体类型和荧光沉积的模式来辅助诊断。例如棘细胞间的IgG 和C3的荧光沉积常出现在PV、PF 和PNP 中,而基底膜带的IgG 和C3线性荧光沉积通常出现在类天疱疮疾病中。
1.3 血清学诊断
血清学诊断可以用来区分不同类型的循环自身抗体,其优势是侵入性最小,尤其对于难以进行皮肤取样的患者是比较好的检测方法。AIBD 的血清学诊断方法包括IIF、ELISA和IBT等[9]。
1.3.1 IIF
猴子或豚鼠的食管是高度灵敏的IIF 底物。在底物上先滴加样本血清,孵育后加入荧光结合物标记的抗人抗体,在荧光显微镜下通过不同的荧光沉积模式,可清楚地分辨天疱疮与类天疱疮疾病,类似DIF。猴食管底物对天疱疮的诊断灵敏度达到81%~100%,特异度达到89%~100%[16]。在类天疱疮的诊断中,猴食管底物的检测灵敏度达到68%~73%,特异度达到97%[13]。
1.3.2 盐裂皮肤试验
盐裂皮肤试验采用1 mol/L 氯化钠溶液浸泡(4 ℃,24~48 h),使皮肤的真皮和表皮在透明板处分裂,抗原决定簇充分暴露以利于抗体结合,便于观察区分基底膜带的荧光沉积位于表皮侧或真皮侧。盐裂皮肤检测AIBD 的灵敏度可以达到73%~96%,特异度可以达到97%[13]。试验优势在于可区分不同的自身抗体,如抗BP180、抗BP230、抗α6β4整合素抗体位于盐裂皮肤的表皮侧,对类天疱疮、线状IgA大疱性皮病等具有一定检出率;而抗Ⅶ型胶原、抗层粘连蛋白332、抗层粘连蛋白γ1抗体结合在盐裂皮肤的真皮侧,对EBA、抗p200类天疱疮有一定检出率[5,8]。
1.3.3 ELISA
ELISA 已经广泛应用于AIBD 循环抗体的检测,除了可以明确靶抗原,其优势在于能够定量监测抗体水平、判断疾病发展和预后评估[5,17],同时操作比较简便。将标准血清和样本血清加入预先包埋抗原的微孔中,孵育后加入酶标二抗,最后加入底物显色,用分光光度计测定吸光度。笔者团队研究发现,ELISA 法对PV 患者的抗Dsg3 抗体检出率为92%,对PF患者的抗Dsg1抗体检出率为90%[18]。
1.3.4 IBT
IBT 能够辅助检测相对少见的自身抗体。人类表皮提取物经过处理后期蛋白质分子通过电泳转移到硝酸纤维素膜上,加入样本血清和过氧化物酶结合的抗人抗体进行孵育,判读最终显色条带位置即可确定相应的抗体[5,19-20]。一项对23 例天疱疮患者的分析研究发现,PV 患者中92%可检出抗Dsg3 抗体,PF 患者中90%可检出抗Dsg1 抗体[18]。同时,Meijer 等[21]研究发现,在类天疱疮疾病中IBT 的灵敏度和特异度分别达到70%和95%。然而,IBT的不足之处在于操作复杂耗时,且技术要求比较高。
2 实验室诊断方法进展
2.1 生物芯片技术
传统IIF需要专业技术人员的正确解读,而重组底物可以简化IIF 的判读,通过选取抗原上的免疫活性表位,去除非特异性反应的区域,增加和该抗原结合的抗体数量,显著提高检测的灵敏度和特异度[9]。目前,重组底物可以分为2种类型。第一种是将靶抗原表达于人类HEK293 细胞,比如将经过转染Dsg1、Dsg3 和未经过转染Dsg1、Dsg3 的HEK293 细胞都包被在生物芯片上,如果是真阳性,则仅有经过转染处理的细胞内出现均匀细致的荧光沉积;如果是假阳性,则在2种细胞中均出现荧光沉积[19,22]。第二种是将纯化的重组抗原如BP180-NC16A-4X 直接包被在生物芯片上,如果试验呈阳性,则会呈现特定的荧光沉积形态,如钻石状或环状[9]。标准的生物芯片检测是将不同的底物结合在一起放在同一个反应孔中进行自身抗体的筛选,能够在孵育后一次性检出不同的自身抗体,辅助诊断AIBD[9]。与传统的多步骤检测方法相比,生物芯片检测的优势在于成本较低且高效,尤其是对于Dsg3和BP180的检出率较高[23],分别达到97%~100%和94%,仅有<5%的患者需要通过传统方法(如DIF 等)进一步诊断[24]。目前还有更多的微型抗原正在开发中,如Ⅶ型胶原的NC1 区域、BP180 胞外域、桥粘素蛋白1、2、3以及层粘连蛋白332、γ1等[25]。
2.2 EUROTide™孵育技术结合EUROPath 系统的新型自动化DIF技术
该检查是取患者皮损周围1~2 cm范围内的正常皮肤,行冰冻切片。将组织冰冻切片放置在EUROPath 的生物芯片M14 上,对异硫氰酸荧光素标记的抗人抗体(包括IgA、IgM、IgG、C3c 和纤维蛋白原)进行梯度稀释后与样本在室温下避光摇床孵育(EUROTideTM孵育技术),然后EUROPath 系统进行自动清洗,封片后荧光显微镜下观察结果[26]。与传统的手工DIF 方法相比,EUROTideTM孵育技术能够避免荧光结合物的分布不均匀,加快抗原抗体反应速度,荧光更强,背景荧光更少。另外,该方法能够在一次反应中同时完成1例患者的5种染色,更加高效。
2.3 MESACUP anti-Skin profile TEST(ASPT)
多参数抗原特异性ELISA 能够在邻近的反应孔内同时检测多种抗体[27],ASPT 可在不同的反应孔中同时包被Dsg1、Dsg3、BP180、BP230和VII型胶原重组抗原,则可以在一列共8 个ELISA 反应孔(包括阳性对照和阴性对照孔)中对所有抗体进行检测,并且孵育时间相比传统ELISA 缩短一半[27]。Orsolya N. HORV 'ATH 等研究发现,与单参数ELISA 相比,ASPT 可以达到88%的符合率,并且其对Dsg1、Dsg3、BP230 和Ⅶ型胶原的检测特异度可以达到100%,对BP180 的特异度可以达到98%。另外,ASPT 对抗Dsg1、抗Dsg3、抗BP180、抗BP230 和抗Ⅶ型胶原抗体的检测灵敏度分别达到92%、93%、66%、62%和81%,与传统的单参数ELISA相比灵敏度更高[27]。除了能够定量监测抗体水平外,ASPT 还能够在患者随访过程中检测到抗原扩展现象[27],但需要注意的是,ASPT 对BP180 和BP230 的检测可能存在假阳性结果,应结合DIF 检测结果以及临床症状进行综合判断[22]。
2.4 LFIA
LFIA 是基于抗人抗体、His 标记Dsg3 和胶体金颗粒偶联抗His 抗体,对患者样本中的抗Dsg3 抗体进行检测。此方法对PV 的检测灵敏度和特异度分别达到73%和94%[28]。LFIA 的优势在于检测时间短,可肉眼观察结果,并且可以使用血清、血浆、唾液、尿液和全血等样本。其不足之处在于缺少酶反应可能会降低反应的灵敏度,且无法给出定量或半定量结果,只适用于快速定性检测,与传统单参数ELISA相比,无法准确地描述抗体的滴度变化情况。
2.5 化学发光酶免疫技术
该技术是基于重组Dsg1、Dsg3 和BP180 包被的磁珠与碱性磷酸酶标记的多克隆IgG 抗体,对患者血清中的抗Dsg1、抗Dsg3 和抗BP180 抗体进行检测,其检出率分别为48%、65% 和86%,与ELISA 相比符合率可达到94%~99%[29]。此方法的优势在于抗原抗体为共价结合,因此检测范围相比物理结合的ELISA 更宽,目前已被广泛应用于检测类风湿性关节炎的抗环瓜氨酸肽抗体[30]。与传统手工ELISA 相比,该技术检测时间短、自动化程度高,将有望成为检测AIBD患者自身抗体的有力方法。
2.6 荧光叠加抗原定位-激光扫描共焦显微镜技术(Fluorescence overlay antigen mapping using laser-scanning confocal microscopy,FOAM-LSCM)
FOAM-LSCM 是指从患者皮损周围的正常皮肤取样,行冰冻切片,先对基底膜带的抗原(如β4整合素、层粘连蛋白332、Ⅳ型胶原等)采用相应的鼠抗人抗体进行结合,清洗后使用Cy5 和异硫氰酸荧光素2 种荧光素分别标记的抗鼠和抗人抗体进行孵育,在对应的2 种荧光波长下对致密板和透明板的不同结构进行观察[31-32]。与传统手工DIF 检测相比,FOAM 能够一次性对基底膜带的不同成分进行区别染色,效率更高且操作简单。目前国际大疱病组织已经认可FOAM 作为诊断获得性大疱性表皮松解症的有力工具[33]。同时,LSCM 能够解决传统荧光显微镜在失焦区域的荧光干扰问题,可获得更为清晰的荧光图片[34]。FOAM-LSCM 联合有助于临床诊断黏膜类天疱疮等在传统方法下难以与BP或获得性大疱性表皮松解症区分的AIBD,对无法检测出循环抗体的患者具有重要意义。
3 小结
AIBD 的实验室诊断对于疾病的治疗和预后都有着极其重要的作用。目前常规的组织病理学检查、DIF 和血清学诊断法具有一定局限性,新型的生物芯片、自动化DIF、多参数抗原特异性ELISA、LFIA、化学发光酶免疫技术和FOAM-LSCM 技术的应用为诊断AIBD 提高了便捷性、特异度和灵敏度,但目前尚未广泛应用于临床。随着对AIBD 发病机制的深入研究,及对生物检测技术的进一步利用和开发,更为特异有效、便捷的抗体检测手段将不断涌现,为疾病的精确诊断提供更多更好的方法。
利益冲突说明/Conflict of Interests
所有作者声明不存在利益冲突。
伦理批准及知情同意/Ethics Approval and Patient Consent
本文不涉及伦理批准及知情同意。
作者贡献/Authors’Contributions
乌心怡撰写,朱海琴收集资料,潘萌设计并审核论文。

