负载白藜芦醇的大麦醇溶蛋白/海藻酸丙二醇酯复合纳米颗粒的制备及表征
赵天瑜,唐荣,金雨楠,梅晓宏*
(1 中国农业大学食品科学与营养工程学院 北京100083 2 农业农村部农业转基因生物安全评价(食用)重点实验室 北京 100083)
白藜芦醇(resveratrol)化学名称为3,4,5-三羟基-二苯乙烯,分子式为C14H12O3,是一种天然植物多酚[1],主要存在于虎杖、葡萄的果皮和种子中[2]。近年来,白藜芦醇因具有抗氧化、抗衰老、抗肥胖、抗糖尿病、抗肿瘤等功效而备受关注。然而,白藜芦醇在水中溶解度很小,化学稳定性较差,导致其生物利用率很低,难以发挥作用[3]。相关研究表明,利用相关递送系统对白藜芦醇进行包封,可有效改善其水溶性低及稳定性差等缺点,从而有助于扩大它在食品领域的应用[4]。与人工合成的包封载体相比,天然动植物来源的高分子聚合物,如蛋白质和多糖,具有安全无毒及生物可降解等优点,更适用于对白藜芦醇等生物活性成分进行包封和递送[5]。
大麦醇溶蛋白(hordein)是大麦中的重要贮藏蛋白,含有较高比例的脯氨酸、缬氨酸等疏水性氨基酸,该蛋白不溶于水,具有很强的疏水活性[6]。此外,该蛋白还具有良好的生物可降解性、生物相容性和抗氧化性。有学者已开展基于大麦醇溶蛋白纳米颗粒的Pickering 乳液及递送系统等方面的研究[7]。然而,该蛋白存在高疏水性及在其等电点附近的pH 值环境下易发生聚集等缺陷,限制了其在相关食品领域中的应用。海藻酸丙二醇酯(propylene glycol alginate,PGA)是由海藻酸盐和氧化丙烷发生酯化反应生成的多糖[8],其主链由α-L-古洛糖醛酸(G)和β-D-甘露糖醛酸(M)组成,丙二醇基团与G 和M 的羧基相连[9]。PGA 分子结构的两亲特性(亲水性和亲脂性)使其具有良好的表面活性和乳化稳定性,被广泛用于食品的稳定剂、乳化剂和增稠剂等[10]。此外,海藻酸丙二醇酯还可与蛋白通过静电、疏水或氢键等分子间作用力相结合形成复合纳米颗粒,被用于对白藜芦醇等功能成分的包封和递送,明显提高了基于单一蛋白递送系统的亲(疏)水活性、稳定性及缓释能力等[11]。截止目前,通过制备大麦醇溶蛋白/海藻酸丙二醇酯复合纳米颗粒来包封白藜芦醇尚未见研究报道。
本研究通过溶剂蒸发法制备大麦醇溶蛋白/海藻酸丙二醇酯复合纳米颗粒,对白藜芦醇进行包封。对上述复合纳米颗粒进行物理表征,分别测定被包封白藜芦醇的热稳定性、光稳定性,综合评价用大麦醇溶蛋白/海藻酸丙二醇酯复合纳米颗粒作为载体包封递送白藜芦醇的可行性。
1 材料与方法
1.1 材料与试剂
大麦,当地超市;海藻酸丙二醇酯(PGA,酯化度为87.9%),上海函俊糖业有限公司;白藜芦醇(纯度>98%),北京索莱宝科技有限公司。其余试剂均为分析纯级。
1.2 仪器与设备
pH 计(DS89723),德国赛多利斯公司;激光粒度分析仪(Zetasizer Nano-ZS90),英国Malvern 公司;荧光光谱仪(F-4600 FL),美国安捷伦科技有限公司;傅里叶红外光谱仪(Spectrum 100),英国PerkinElmer 公司;超声波细胞破碎仪(SCIENTZIID),宁波新芝生物科技股份有限公司;差示扫描量热仪(DSC-60),日本岛津公司;D8X 射线衍射仪(D8 ADVANCE),德国布鲁克公司;紫外分光光度计(TU-1901),北京普析通用仪器有限公司。
1.3 方法
1.3.1 大麦醇溶蛋白(hordein)的提取 Hordein的提取是参考Boostani等[12]的研究方法并做一定的修改。将大麦磨成粉,以料液比为1∶5(m∶V)的比例加入正己烷,在25 ℃下连续搅拌2 h,使用高速冷冻离心机在25 ℃下以4 000×g 离心5 min,弃上清液;按照料液比1∶6(m∶V)的比例向上述沉淀物中加入去离子水,连续搅拌30 min,于4 000×g离心5 min,弃上清液;按照料液比1∶6(m∶V)的比例向上述沉淀物中加入0.1 mol/L NaCl 溶液,连续搅拌30 min,于4 000×g 离心5 min,弃上清液。最后按照料液比1∶10(m∶V)的比例向沉淀物中加入体积分数70%乙醇水溶液,连续搅拌2 h,于4 000×g 离心5 min,收集上清液,于45 ℃下旋转蒸发去除乙醇,使用冻干机将样品冷冻干燥(-80 ℃,48 h)获得粉末样品,放置于干燥器中保存备用。
1.3.2 Hordein/PGA 复合纳米颗粒的制备 将上述冻干的hordein 粉末溶于70%乙醇水溶液中,以获得5 mg/mL 的hordein 分散液。同时将PGA 分散于去离子水中,制备5 mg/mL 的储备溶液。使用0.1 mol/LHCl 溶液或NaOH 溶液将hordein 及PGA 储备溶液的pH 值分别调节为4。将上述hordein 溶液与PGA 溶液逐滴混合,分别制备hordein 与PGA 质量比为5∶1,4∶1,3∶1,2∶1 和1∶1 的分散液,于25 ℃下分别连续搅拌(600 r/min)5 min。随后,将上述分散液中的乙醇在45 ℃下旋转蒸发除去,添加去离子水补足体积,并使用0.1 mol/L 的HCl 溶液或NaOH 溶液将各分散液的pH值调节为4,最后将各分散液在200 W 下超声5 min。部分分散液样品在4 ℃下保存,其它样品冻干(-80 ℃,48 h)备用。将hordein 与PGA 质量比分别为5∶1,4∶1,3∶1,2∶1,1∶1 的复合纳米颗粒分别命名为:H-P5∶1、H-P4∶1、H-P3∶1、H-P2∶1、H-P1∶1。
1.3.3 Hordein/PGA 复合纳米颗粒的表征 参考Yang等[13]的方法对各Hordein/PGA 复合纳米颗粒粒径和Zeta 电位进行测定。采用激光粒度仪在25 ℃下进行测量,平衡时间60 s,每一样品重复测定3 次,结果以平均值表示。
参考Sun等[14]的方法对各Hordein/PGA 复合纳米颗粒进行荧光光谱分析,并做一些修改。用去离子水将复合纳米颗粒中蛋白质的浓度稀释为1 mg/mL,激发波长固定在280 nm,在290~450 nm的范围内收集发射光谱,扫描速度为240 nm/min。激发缝隙和发射缝隙宽度均设置为5 nm。所有数据的测量均在室温下进行。
参考Liu等[15]的方法对各Hordein/PGA 复合纳米颗粒进行傅里叶变换红外光谱(FTIR)分析,并做一些修改。将2.0 mg 样品与200 mg 溴化钾混合,研磨均匀后进行压片处理。在波数400~4 000 cm-1范围进行红外光谱扫描,扫描次数32次,分辨率为4 cm-1。
利用透射电子显微镜观察样品的微观形貌。用去离子水将样品稀释到一定浓度,并取适量滴于铜网格上,可观察到不同放大倍数下的图像。
1.3.4 负载白藜芦醇的大麦醇溶蛋白-海藻酸丙二醇酯复合纳米颗粒(Hordein/PGA/Res)的制备参照Sun等[16]的方法并作一些改动,将0.5 g hordein 溶于100 mL 70%乙醇水溶液中,充分溶解后,按照hordein 与白藜芦醇的质量比为5∶1,10∶1,15∶1,20∶1 和25∶1 分别加入不同质量的白藜芦醇,在600 r/min 下避光搅拌1 h。称取0.5 g PGA加入 到100 mL去离子水中,600 r/min下搅拌直至充分溶解,用0.1 mol/L HCl 溶液或NaOH溶液调节pH 值至4。在600 r/min 的转速下,将PGA 溶液缓慢加入到白藜芦醇-大麦醇溶蛋白溶液中,在45 ℃下旋转蒸发除去乙醇,并用去离子水补足体积。最后将分散液在200 W 下超声5 min,于2 000×g 离心10 min。部分纳米颗粒分散液置于4 ℃下冷藏,其余分散液冻干(-80 ℃,48 h)得到粉末样品备用。负载不同含量白藜芦醇的纳米分散液分别命名为H-P-R5∶1、H-P-R10∶1、H-P-R15∶1、H-P-R20∶1、H-P-R25∶1。
1.3.5 负载白藜芦醇的大麦醇溶蛋白-海藻酸丙二醇酯复合纳米颗粒(Hordein/PGA/Res)的表征复合纳米颗粒的粒径、Zeta 电位测定及傅里叶变换红外光谱分析方法同1.3.3 节。
参考Huang等[17]的方法对复合纳米颗粒进行X-射线衍射(XRD)分析。将冻干样品研磨均匀后平铺于样品池上,在室温下,用D8X 射线衍射仪进行X 射线衍射测量。X 射线衍射仪采用Cu 靶作为标准,电压40 kV,电流40 mA,分辨率为0.0001,以0.02°/s 的速率扫描,2θ 扫描范围为5°~90°。
1.3.6 白藜芦醇包封率和负载率的测定 参考Wei等[18]的方法测定复合颗粒中白藜芦醇的含量。取1 mL 新鲜制备的颗粒分散液与4 mL 无水乙醇混合,涡流振荡2 min。将混合液以10 000×g 的速度离心30 min。此后,用80%乙醇水溶液将上清液中的白藜芦醇稀释至适当浓度。用紫外分光光度计在307 nm 处测量吸光度。以相同条件下制备的白藜芦醇标准曲线计算白藜芦醇的浓度。包封率(EE)和负载能力(LC)通过以下方程式计算:
1.3.7 白藜芦醇热稳定性分析 取5 mL 1.3.4 节制备的复合纳米颗粒H-P-R20∶1分散液装入离心管中,在避光条件下,分别在55,65,75 ℃和85 ℃的水浴锅中加热30 min,然后立即冰浴冷却至室温(25 ℃),以10 000×g 的速度离心30 min,此后,用80%乙醇水溶液将上清液中的白藜芦醇稀释至适当浓度,在307 nm 处测定吸光度,计算白藜芦醇的保留率。以游离白藜芦醇的乙醇溶液为对照。
1.3.8 白藜芦醇光稳定性分析 白藜芦醇光稳定性测定参考夏威[19]的方法略作修改。取10 mL 1.3.4节制备的复合纳米颗粒H-P-R20∶1分散液放于培养皿中,使用30 W 紫外线灯短距离对其进行照射(20 cm),于1,2,3,4,5,6 h 时分别取样,以10 000×g 的速度离心30 min,此后,用体积分数80%乙醇水溶液将上清液中的白藜芦醇稀释至适当浓度,测定在307 nm 处的吸光度,计算白藜芦醇的保留率。以游离白藜芦醇的乙醇溶液为对照。
1.3.9 数据分析 所有试验数据至少重复3 次,结果以平均值±标准差表示。采用SPSS Statistics 17.0 软件对数据进行分析,P<0.05 被认为数据具有显著性差异。采用Origin 2018 软件作图。
2 结果与分析
2.1 Hordein/PGA 复合颗粒的表征
2.1.1 粒径及Zeta 电位 如图1a 所示,单一hordein 纳米颗粒的粒径为306 nm。加入PGA 后,Hordein/PGA 复合胶体颗粒粒径明显增加。图1b Zeta 电位的结果表明在分散液pH 值为4.0 时,hordein 带正电荷(等电点pI 为6.5),PGA 带负电荷(解离常数pKa 为3.5),二者可通过静电引力作用结合,导致形成粒径较大的复合物。
随着PGA 添加量的增加,复合纳米颗粒粒径逐渐减小,同时多分散指数PDI 逐渐降低。图1b Zeta 电位结果证实Hordein/PGA 复合胶体颗粒整体表现为带负电荷,并且随着PGA 添加量的增加,二元复合胶体颗粒的电位绝对值逐渐增加,表明Hordein/PGA 复合胶体颗粒的外层由PGA 主导。因此随着PGA 浓度增高,复合胶体颗粒之间的静电排斥作用增强,从而导致颗粒尺寸减少。Hu等[20]也报道了阴离子多糖(海藻酸钠)的存在主导了玉米醇溶蛋白-多糖复合颗粒整体的电特性。
本研究中,确定hordein 和PGA 的最佳复配比例为1∶1。此时,一方面复合纳米颗粒电位绝对值最大,有足够的静电斥力;另一方面,足够量的多糖的引入可以增加复合纳米颗粒的空间阻力以及降低颗粒之间的疏水相互作用。所以该比例下复合纳米颗粒的粒径最小,保持稳定而不发生聚集沉淀。
2.1.2 荧光光谱分析 荧光光谱分析可用于研究蛋白质与生物大分子(如多糖)之间的相互作用,蛋白质具有内源性荧光,这与酪氨酸(Tyr)、色氨酸(Trp)和苯丙氨酸(Phe)残基相关,与其它组分相互作用时会导致其荧光强度发生变化[14]。Hordein 和H-P 纳米颗粒的荧光发射光谱如图2a所示。单一hordein 经280 nm 激发后,在339 nm处出现最大的荧光发射峰,这归因于色氨酸残基的荧光发射[21]。与hordein 相比,单一PGA 在300~400 nm 范围内的荧光强度很低,可忽略不计[14]。加入PGA 后,随着PGA 浓度的增加,hordein 在339 nm 处的荧光发射强度逐渐减小。色氨酸残基对蛋白质的局部环境变化高度敏感,PGA 的添加导致hordein 荧光强度减小的原因可能是由于hordein和PGA 之间发生疏水相互作用,使色氨酸基团的暴露减少,导致荧光猝灭[22]。
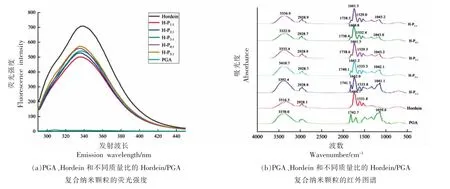
图2 PGA、Hordein 和不同质量比的Hordein/PGA 复合纳米颗粒的荧光、红外光谱图Fig.2 Fluorescence and fourier transform infrared spectra of PGA,Hordein and Hordein/PGA composite nanoparticles with different mass ratios
2.1.3 傅里叶变换红外光谱分析 图2b 显示了hordein、PGA、Hordein/PGA 复合纳 米颗粒 在4 000~400 cm-1波长区域中的FTIR 光谱。单一hordein 和PGA 分别在3 316.3 cm-1和3 370.0 cm-1处显示特征峰,这是由羟基伸缩振动引起的[23]。当添加PGA 后,该谱带分别位移至3 392.4 cm-1(HP1∶1),3 410.7 cm-1(H-P2∶1),3 335.4 cm-1(H-P3∶1),3 322.0 cm-1(H-P4∶1)和3 336.9 cm-1(H-P5∶1),说明hordein 与PGA 之间由于hordein 的酰胺基与PGA 的羟基发生了相互作用而形成了氢键[24]。
Hordein 在1 666.7 cm-1和1 531.8 cm-1处有两个特征峰,分别属于酰胺I 带(1 700~1 600 cm-1)和酰胺II 带(1 600~1 500 cm-1)。酰胺I 带主要是由C=O 基团和C-N 基团伸缩振动引起的[25],而酰胺II 带主要是由N-H 基团的弯曲振动和C-N 基团的伸缩振动引起[26]。当hordein 与PGA 按照不同质量比复合时,可观察到hordein 的酰胺I 带和酰胺II 带峰位置发生移动。酰胺I 带由1 666.7 cm-1分别移动至1 662.0 cm-1(H-P1∶1),1 661.2 cm-1(HP2∶1),1 661.5 cm-1(H-P3∶1),1 660.8 cm-1(H-P4∶1)和1 661.5 cm-1(H-P5∶1)。酰胺II 带由1 531.8 cm-1分别移动至1 533.8 cm-1(H-P1∶1),1 533.3 cm-1(H-P2∶1),1 529.3 cm-1(H-P3∶1),1 532.4 cm-1(H-P4∶1)和1 529.0 cm-1(H-P5∶1)。酰胺I 带和酰胺II 带的峰位置移动,表明PGA 的丙二醇基团和hordein 的疏水性氨基酸之间可能存在疏水相互作用[16]。同时,在pH=4 时,hordein 带正电荷,PGA 带负电荷,所以二者之间也有静电吸引作用[27]。另外,单一PGA在1 742.7 cm-1和1 039.6 cm-1处出现两个特征峰,分别属于C=O 基团[28]和C-O 基团的伸缩振动[29]。总之,FTIR 光谱的整体变化表明hordein 与PGA 之间存在氢键、疏水相互作用和静电吸引作用。
2.1.4 透射电镜分析(TEM)利用TEM 观察单一hordein 纳米颗粒和H-P1∶1样品的微观形貌。如图3a 所示,单一hordein 纳米颗粒形状近似于球形,大小不均一。添加PGA 以后,如图3b 所示,复合纳米颗粒基本为球状,粒径大于单一的蛋白纳米颗粒,颗粒分布较为均一,无聚集体的存在,颗粒大小与2.1.1 节Hordein/PGA 复合纳米颗粒粒径结果较为吻合。基于Hordein/PGA 复合纳米颗粒的粒径、电位及微观形貌结果,后续选择H-P1∶1复合纳米颗粒作为白藜芦醇的包封载体。

图3 大麦醇溶蛋白和Hordein/PGA 复合纳米颗粒的透射电镜图Fig.3 TEM images of Hordein and Hordein/PGA composite nanoparticles
2.2 Hordein/PGA/Res 复合纳米颗粒的表征
2.2.1 粒径及Zeta 电位 Hordein/PGA/Res 复合纳米颗粒分散液的平均粒径、Zeta 电位和PDI 的结果如图4 所示,表明白藜芦醇的添加并没有引起复合纳米颗粒粒径发生明显变化,PDI 值均在0.2 左右(图4a)。

图4 Hordein/PGA/Res 复合纳米颗粒的粒径、电位和PDIFig.4 Particle sizes,zeta potential and PDI of Hordein/PGA/Res composite nanoparticles
电位数据如图4b 所示,Hordein/PGA/Res 复合纳米颗粒表面均带负电荷。当体系中白藜芦醇与蛋白质量比从25∶1 增加至5∶1 时,纳米颗粒表面的电位绝对值无明显变化,这说明白藜芦醇的添加不会对复合纳米颗粒电位产生显著影响。这可能是由于PGA 分子上的阴离子羧酸基团(-COO-)控制着Hordein/PGA/Res 复合颗粒的电特性,此时颗粒之间主要依靠静电斥力稳定。该结果与前人研究结果一致[30]。
2.2.2 FTIR 分析 如图5a 所示,Hordein/PGA 复合纳米颗粒、游离白藜芦醇的红外光谱分别在3 299.7,3 392.4 cm-1处出现一个宽峰,这是由羟基伸缩振动引起的[23]。与Hordein/PGA 复合纳米颗粒、游离白藜芦醇相比,H-P-R5∶1、H-P-R10∶1、H-PR15∶1、H-P-R20∶1、H-P-R25∶1的羟基伸缩振动峰分别移动至3 408.9,3 399.5,3 410.8,3 336.8,3 380.6 cm-1,这表明hordein、PGA 与白藜芦醇之间存在氢键作用。与Hordein/PGA 的FTIR 图相比,Hordein/PGA/Res 酰胺II 带吸收峰发生明显变化,可能是由于白藜芦醇和hordein 之间发生疏水相互作用引起的[31]。

图5 白藜芦醇、H-P1:1 和Hordein/PGA/Res 复合纳米颗粒的红外光谱和XRD图Fig.5 FTIR and XRD spectra of resveratrol,H-P1:1 and Hordein/PGA/Res composite nanoparticles
游离白藜芦醇的特征峰出现在1 589.4,1 512.3,1 330.5,1 153.67,833.1 cm-1,分别归因于烯烃-CC-伸缩振动、芳香环-C=C-伸缩振动、-C-O-伸缩振动、-C-H 面内弯曲振动、-C-H 面外弯曲振动[32]。在Hordein/PGA/Res 的FTIR 光谱中,白藜芦醇的特征吸收峰均消失,这可能归因于白藜芦醇被包封到纳米颗粒中,化学键的弯曲和伸缩受到限制,这与前人研究结果类似[33]。
2.2.3 X-射线衍射(XRD)分析 生物活性物质的结晶状态是影响其稳定性、溶解度和体内药效等特性的重要参数之一[34]。XRD 可用于分析被包封物质或生物聚合物基质的结晶状态。如图5b 所示,hordein 和PGA 分别在19.8°和21.6°出现较宽的缓峰,说明hordein 和PGA 均以无定形结构存在[26]。而游离白藜芦醇分别在16.3°,19.2°,22.4°,23.6°,28.3°显示出多个尖锐的特征峰,这表明白藜芦醇具有高度结晶结构。Hordein/PGA/Res 的XRD 谱图与H-P1∶1类似,白藜芦醇的特征结晶峰几乎完全消失,表明白藜芦醇是以无定形态分散在复合纳米颗粒基质中,证明白藜芦醇被成功包封在Hordein/PGA 复合纳米颗粒中。这与Pardro等[33]的结果类似。白藜芦醇以无定形态存在有利于提高其溶解度,从而增加其生物利用度[35]。
2.3 包封率和负载率
包封率(EE)和负载率(LC)是评价递送系统应用潜力的重要指标。如图6 所示,随着白藜芦醇添加量的增加,其包封率逐渐降低,负载率逐渐增加。而白藜芦醇添加量较高时,负载率的增幅逐渐降低。其中,H-P-R10∶1的负载率最高,为3.2%,但其包封率仅为67%,而H-P-R20∶1的包封率最高,为87%,此时负载率为2.1%,综合考虑包封率和负载率的结果,后续将对H-P-R20∶1进行稳定性分析。
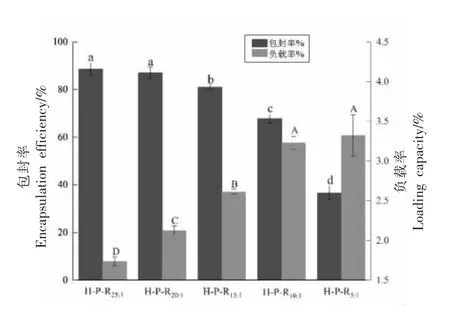
图6 大麦醇溶蛋白/白藜芦醇比例对纳米颗粒包封率及负载率的影响Fig.6 Effect of hordein/resveratrol ratio on encapsulation efficiency and load capacity of nanoparticles
2.4 热稳定性分析
负载功能因子的纳米颗粒在食品加工中可能会经受热处理,良好的热稳定性将有利于其在食品领域的商业化应用。因此,本文研究了不同加热温度(55,65,75,85 ℃)对H-P-R20∶1中白藜芦醇稳定性的影响。
如图7a 所示,随着加热温度的升高,白藜芦醇保留率逐渐下降,与游离白藜芦醇相比,包封后白藜芦醇保留率的下降速率显著降低。在85 ℃水浴中处理30 min 后,H-P-R20∶1中白藜芦醇保留率为88%,显著高于游离白藜芦醇(73%)。这可能是由于白藜芦醇与复合纳米颗粒进行有效结合,白藜芦醇处于复合纳米颗粒的疏水核心中,从而提高了其热稳定性[36]。这与Guo等[37]的研究结果一致。
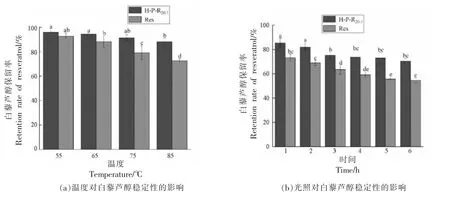
图7 复合纳米颗粒的稳定性分析Fig.7 Stability analysis of composite nanoparticles
2.5 光稳定性分析
白藜芦醇在紫外光照射下,可由反式白藜芦醇异构化为顺式白藜芦醇,而顺式白藜芦醇的生物活性低于反式白藜芦醇[38]。因此,白藜芦醇的光不稳定性限制了其在食品中的应用。
如图7b 所示,随着光照时间的延长,白藜芦醇保留率逐渐下降。与游离白藜芦醇相比,H-PR20∶1中白藜芦醇的光稳定性明显提高,光照处理3 h 后,其保留率趋于稳定。光照6 h 后,游离白藜芦醇的保留率仅为54%,而H-P-R20∶1中,白藜芦醇保留率为70%。结果显示,紫外照射6 h 后,与游离白藜芦醇相比,复合纳米颗粒中的白藜芦醇保留率提高了约16%。这说明用Hordein/PGA 纳米颗粒包封白藜芦醇可以有效提高其光稳定性。这可能是由于白藜芦醇与蛋白之间存在疏水相互作用力,蛋白可以起到保护白藜芦醇的作用,使其降解率减小[39],并且hordein 分子中的芳香侧基和双键可以吸收紫外光,从而提高白藜芦醇的光稳定性[40]。
3 结论
采用溶剂蒸发法成功制备大麦醇溶蛋白-海藻酸丙二醇酯复合纳米颗粒(Hordein/PGA),所制备的复合颗粒粒径较小,分散性良好。在此基础上制备负载白藜芦醇的大麦醇溶蛋白和海藻酸丙二醇酯复合纳米颗粒(Hordein/PGA/Res),红外光谱结果表明白藜芦醇通过氢键和疏水作用与大麦醇溶蛋白、海藻酸丙二醇酯结合。X-射线衍射分析结果揭示白藜芦醇以无定形态分散在复合纳米颗粒中。与游离白藜芦醇相比,Hordein/PGA/Res 中的白藜芦醇热稳定性及光稳定性显著提高。本研究的实验结果为大麦醇溶蛋白的综合利用提供理论基础,并对白藜芦醇等生物活性物质的包封递送提供一种有效的载体系统。

