产柚苷酶菌株改良、性质及其在柑橘酒中的应用研究进展
林 静, 罗 莲, 杨 爽, 李 萍, 张志清, 陈安均, 刘兴艳
(四川农业大学食品学院,四川 雅安 611130)
柚苷酶是由α-L-鼠李糖苷酶(α-L-rhamnosidase,EC.3.2.1.40)和β-D-葡萄糖苷酶(β-D-glucosidase,EC.3.2.1.21)组成的复合酶[1-2]。柚苷酶是一种非常重要的工业酶,在柑橘酒的加工去苦、增强果酒香气等方面具有重要的应用价值[3-4]。目前国内外已有许多关于柚苷酶的研究,但主要集中在菌株筛选[5-6]、发酵条件优化[7-8]及酶的分离纯化[9-11]等方面,对其酶学特性和结构特性的深入研究较少。目前已有大量产柚苷酶的微生物被筛选出来,但在实际应用时,柚苷酶活力低下、生产成本高的问题仍然没有得到解决。柚苷酶来源广泛,不同来源的柚苷酶在酶学特性和分子结构方面存在一定的差异,对柚苷酶的酶学特性和结构特性进行分析将有助于阐明它们的催化反应和底物识别机制,挖掘其潜在应用价值。
柑橘酒是以柑橘为主要原材料,经酒精发酵、脱苦、陈酿、澄清等工艺制成的低度果酒[12]。当前中国柑橘酒工业化生产还很少见,这是因为柑橘酒加工过程中会产生强烈的苦味[13],对产品的口感造成很大的影响。研究结果表明柑橘酒的苦味主要是由柚皮苷和柠檬苦素等物质造成[14]。其中,柚皮苷不仅是典型的黄酮类苦味物质,还为柑橘酒提供了色素、风味物质、抗氧化剂,其含量高低会对酒的色泽、口感、稳定性、生物活性等产生重要的影响[15],因此,它是一种不可忽略的苦味成分。柚苷酶能有效降低柚皮苷的含量,将其转化为无苦味的柚皮素,使柑橘酒苦味降低,保持其稳定性和感官特性。分子末端含有α-鼠李糖苷和β-葡萄糖苷的天然糖苷,均可作为柚苷酶的底物。因此,柚苷酶在食品工业中具有极其重要的作用。目前国内外都有商业化的柚苷酶上市,商业化的柚苷酶一般来源于黑曲霉和青霉菌,但由菌株发酵得到的柚苷酶分离纯化困难,纯化成本高,且发酵产物还含有其他水解酶,易产生副产物,这都不利于柚苷酶的纯化。本文将分别对柚苷酶的来源、酶学特性、结构特性、柑橘酒中苦味物质及柚苷酶在柑橘酒中的应用进行介绍,以期为柚苷酶的高值化利用提供理论支持。
1 柚苷酶菌株筛选及菌株改良技术研究
1.1 柚苷酶
柚苷酶最早从芹菜种子中分离出来,后在柚子叶中也发现了柚苷酶,随着研究深入,陆续从许多植物、动物和某些微生物中分离获得了柚苷酶[16-18]。然而,由于生产成本及环境因素的限制,现在市面上的柚苷酶产品几乎都来自于微生物,微生物来源的柚苷酶大多是胞外酶,且需要在培养基中添加诱导物如柚皮苷来诱导菌株产酶[19],诱导物价格昂贵,这在一定程度上增加了柚苷酶的生产成本。已有研究结果表明,产柚苷酶的微生物菌株主要有两种,一种是曲霉,另一种是青霉。然而,由于黑曲霉菌的培养技术和在食品工业生产中的应用技术更加成熟,同时还由于其次生代谢产物的安全性相对较高,因此更适合食品工业生产的大规模应用。
1.2 柚苷酶菌株筛选方法
柚苷酶菌种可从自然环境中直接筛选得到。筛选产柚苷酶菌株常用到的方法有半固态试管法、定性滤纸显色法、透明圈法等[20-21]。在菌株筛选的早期研究中,主要采用半固态试管法,菌株在试管中生长产酶,柚苷酶将柚皮苷分解形成透明层。随着培养时间的增加,柚苷酶在培养基中扩散,透明层逐渐变大,透明层的大小可判断菌株产酶能力的大小。该方法可初步获得产柚苷酶能力较强的菌株。但由于柚皮苷溶解度低,会影响对透明层的观察,从而降低实验结果的准确性。定性滤纸显色法是利用菌株产生的柚苷酶消耗掉柚皮苷后与柚皮苷显色液发生颜色反应而筛选菌株的方法。该筛选方法操作简单,但由于定性滤纸表面呈现的颜色不能作为确定该菌株产酶能力的定量依据,因此需要对产酶菌株进一步筛选。透明圈法是一种快速初步筛选菌株的方法,利用透明圈法筛选菌株时,在固体培养基中混入一些溶解性差的营养成分,使培养基浑浊、不透明。如果培养基上生长了目的菌株,就会利用这种营养成分,在菌落周围产生透明圈。有学者发现,与半固态试管法形成的透明层相比,透明圈法形成的透明圈不仅更容易观察,且可根据透明圈大小判断菌株产酶能力的强弱[22],实验操作简单,透明圈法是目前筛选产柚苷酶菌株常用方法。
1.3 柚苷酶菌株改良技术
柚苷酶来源广泛,但自然筛选得到的菌株产生柚苷酶活力较低,需要对菌株进行改良以提高产酶活力,目前改良产柚苷酶菌株常用到的技术有物理诱变、化学诱变[23]及基因重组技术[24]等。
1.3.1 物理诱变 物理诱变是目前常用的菌株改良技术之一,即使用紫外线、X射线、中子、微波、超声波等诱变源对菌株进行诱变,使菌株发生突变的技术。物理诱变所用到的设备简单、操作方便,利用诱变源进行诱变,可得到大量的高产菌株,在微生物的诱变育种中发挥了极其重要的作用[25]。袁文博等[26]利用常温室压等离子体技术对1株产柚苷酶菌株互隔交链孢霉(Alternariaalternate)SK.37001进行诱变,获得了1株高产柚苷酶菌株(Alternariaalternate)SK.37002,产酶活力比原始菌株提高了208%。黄超等[27]从腐烂柚皮中筛选到1株黑曲霉(Aspergillusniger),并对其进行紫外诱变,选育得到了1株酶活力达933.3 U/ml的突变菌株,产酶活力是原始菌株的2.25倍。
1.3.2 化学诱变 化学诱变是指利用碱基类似物、脱氨剂、烷化剂等化学诱变剂使菌株发生突变的技术,目前常用的诱变剂有亚硝基胍(NTG)、乙烯亚胺(EI)、硫酸二乙酯(DES)、叠氮化钠(NaN3)等。化学诱变只需少量的药剂和简单的设备,具有经济方便、快速高效的优点[25]。陈玲等[28]采用NTG对出发菌株孢子进行诱变,得到1株突变菌株3-54-NTG-16,测定其酶活力达770.06 U/ml,比出发菌株提高了近100%。但在使用化学诱变剂时,一些化学诱变剂如NTG、DES等对人体健康有一定的危害,操作时应做好防护,减少与诱变剂接触。
1.3.3 基因重组技术 基因重组技术是将生物体内控制特定性状的基因作为外源基因,按照人为意愿定向改变生物遗传形状的技术,外源基因经体外重组后可转入到受体体内并复制、转录、翻译、表达,从而使受体获得供体特定的性状与功能[29]。利用基因重组技术,寻找合适的微生物来源的柚苷酶基因以及合适的表达载体,从而使柚苷酶高效表达,对提高柚苷酶的酶活力及其应用具有重要意义。现已有关于柚苷酶中的α-L-鼠李糖苷酶通过酵母细胞克隆和表达的相关报道[30-32],但由于柚苷酶是一种复合酶,并不是单一的酶系,所以使得产柚苷酶微生物的基因工程育种难度较大,因此在构建产柚苷酶的基因工程菌时需对两种酶的结构性质及相互关系进行进一步的深入研究。
1.3.4 复合诱变 复合诱变是指用两种或两种以上的诱变剂对生物体进行处理,从而获得突变体的方法,包括两种或多种诱变剂先后使用、同一种诱变剂的重复作用、两种或多种诱变剂的同时使用。复合诱变具有协同效应,比单一诱变效果好。朱运平等[23]采用紫外线-亚硝酸钠复合诱变,选育出1株突变菌株UN2,该菌株产柚苷酶活力达147 U/ml,且具有较好的稳定性。Xia等[33]对从发霉的柚皮中分离出的柚皮苷酶生产菌株(Aspergillustubingensis)MN589840进行紫外与常压室温等离子体复合诱变,筛选出1株UA13突变体,酶活力2 475.16 U/mg,产柚苷酶活力提高了206%。这些结果表明复合诱变是筛选高产柚皮苷酶菌株的有效策略。
2 柚苷酶的性质
2.1 柚苷酶的酶学性质
酶的适宜温度范围、pH值和热稳定性是实现工业化生产必需考虑的因素,也是限制很多酶工业化生产的重要因素。反应体系的温度和pH,不仅会影响底物和产物的溶解性和稳定性,而且决定着整个生产流程和对设备的要求,而酶的热稳定性也与酶的利用率、原料损耗和生产成本等息息相关[34]。不同来源的柚苷酶,甚至相同来源不同类型的柚苷酶在酶学性质上都存在一定差异,表1总结了部分不同来源的柚苷酶及其酶学性质,从表中可以看出,不同来源柚苷酶在分子质量、最适温度和最适pH值等方面都各不相同,但总体上其最适温度为50~60 ℃,最适pH值为4.0~6.0。柚苷酶具有α-L-鼠李糖苷酶和β-D-葡萄糖苷酶两种酶的活性,在柚苷酶的作用底物上,多数柚苷酶都能够同时水解多种糖苷键。α-L-鼠李糖苷酶作为柚苷酶中重要组成成分之一,可以特异性地水解聚糖或者糖苷类化合物末端的α-1,2、α-1,3、α-1,4、α-1,6糖苷键,释放L-鼠李糖[35]。柑橘汁和柑橘酒中的柚皮苷能被α-L-鼠李糖苷酶水解,生成苦味稍弱的普鲁宁和鼠李糖,而柚苷酶中的β-D-葡萄糖苷酶则进一步水解普鲁宁,生成无苦味的柚皮素和葡萄糖。柚苷酶水解柚皮苷的流程如图1所示,除柚皮苷外,分子末端含有α-鼠李糖苷和β-葡萄糖苷的天然糖苷,如芸香柚皮苷、橙皮苷、芦丁等,均可作为柚苷酶的底物[4,36]。
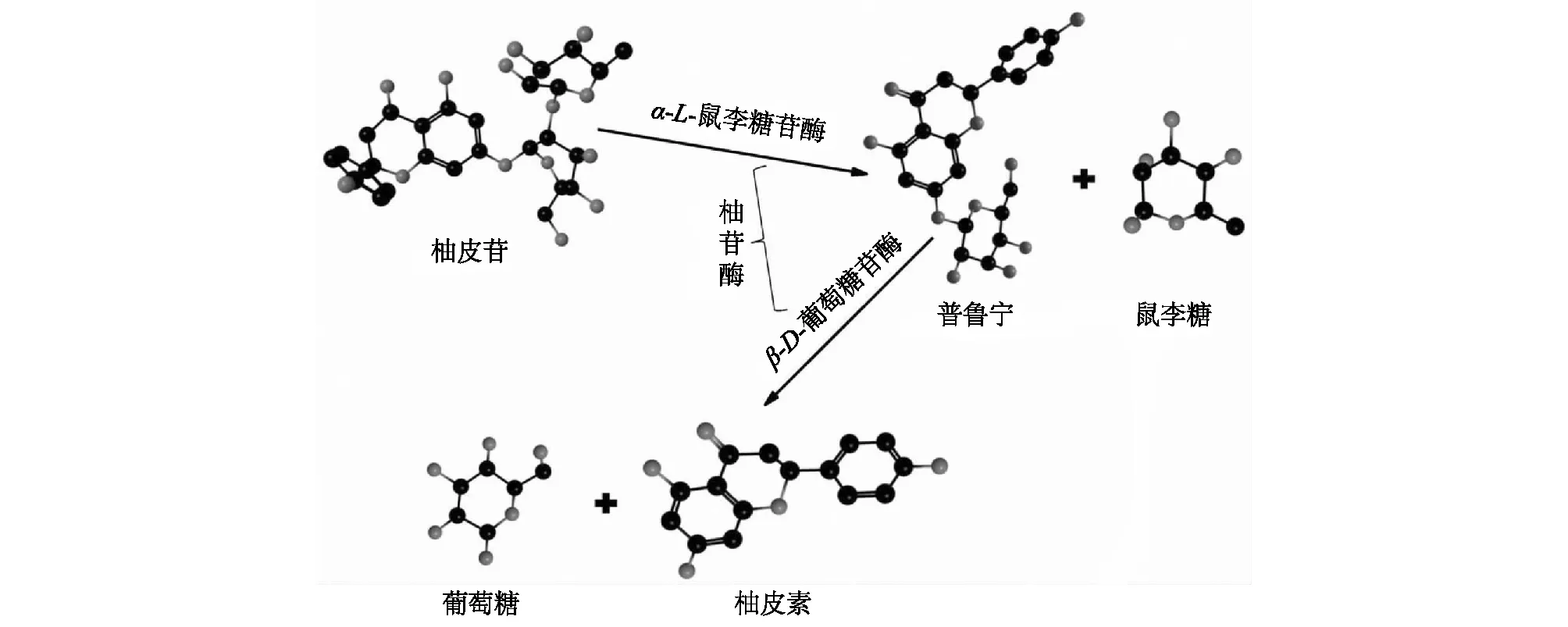
图1 柚苷酶水解柚皮苷的过程

表1 不同来源的柚苷酶及其酶学性质
2.2 柚苷酶的结构特性
柚苷酶的天然来源广泛,它们的功能相似但是结构多变。对柚苷酶的功能域分析有助于对其催化机制与底物识别的理解,关于柚苷酶的结构研究,至今尚无详尽报道。国内外学者对柚苷酶进行研究分析发现其表现为单一的糖蛋白[37-38],这表明柚苷酶结构具有单体的特点,柚苷酶单体结构上具有两个催化位点,一个位点用于α-L-鼠李糖苷酶的催化,另一个位点用于β-D-葡萄糖苷酶的催化[40]。目前已有研究结果表明,酪氨酸作为一种重要的残基在α-L-鼠李糖苷酶及β-D-葡萄糖苷酶的作用过程中参与催化[40],这似乎也证实柚苷酶是一种单体酶。但是,目前在青霉和曲霉的基因组上还没有找到能同时编码α-L-鼠李糖苷酶与β-D-葡萄糖苷酶基因[41-43]。相反,关于编码这两种酶的独立基因却被多次报道[44-45],同时这两种酶也被很多学者单独分离纯化[39,46-48],这些结果暗示了柚苷酶有可能是由两种酶组成的复合酶,而不是具有两个酶活性位点的单链结合蛋白质。
虽然目前尚不知道柚苷酶的整体结构,但是许多学者对柚苷酶的两种组成成分α-L-鼠李糖苷酶和β-D-葡萄糖苷酶的单独结构进行了研究,从CAZy数据库可知,α-L-鼠李糖苷酶可来自GH78家族、GH28家族、GH106家族。随着研究的深入,不同来源的α-L-鼠李糖苷酶的晶体结构已被解析(表2),Cui等[55]对来自芽孢杆菌Bacillussp.GL1菌株的柚苷酶进行结晶,确定了其α-L-鼠李糖苷酶有5个结构域,其中4个是β-三明治夹心结构,Cui指定为结构域N、D1、D2和C;另一个是(α/α)6-桶状结构,Cui指定为结构域A,其三维结构如图2所示,还发现α-L-鼠李糖苷酶中的(α/α)6-桶状结构提供了一个可容纳鼠李糖基的裂缝,带负电的氨基酸残基如Asp567、Glu572、Asp579、Glu841等在这个裂缝里可直接与鼠李糖接触发生作用,表明这些残基是酶催化的活性位点。Fujimoto等[56]对StreptomycesavermitilisRha(SaRha78A)及Rha与L-鼠李糖结合后的晶体结构进行了研究,发现其有6个结构域:N、D、E、F、A和C,同时发现Glu636、Glu895在酶催化过程中具有关键作用,这一结论也与Cui等[55]的研究结果类似。从表2也可以看出,不同来源的α-L-鼠李糖苷酶的晶体结构有所差异,但其结构中都含有催化结构域及β-夹层结构域。

图2 α-L-鼠李糖苷酶的三维结构图[55]

表2 不同来源的α-L-鼠李糖苷酶的结构
有学者对β-D-葡萄糖苷酶的结构进行了研究[59-60],不同来源的β-D-葡萄糖苷酶的结构有所差异(表3),Pozzo等[61]对GH3家族的β-D-葡萄糖苷酶的结晶构造(GenBank登录号:2X40-A)进行了报道,它由(α/β)8-结构域和三明治结构域[6条(α/β)链]及C端纤连蛋白Ⅲ型结构域组成。孙月龙[57]对棘孢曲霉产生的β-D-葡萄糖苷酶的三维结构(GenBank登录号:BGL1-ASPAC)进行了模拟,其三维结构模拟图如图3示。该酶由1个(α/β)8-结构域和1个具有5条(α/β)链的三明治结构域组成,其C端没有纤连蛋白Ⅲ型结构域,呈不规则的卷曲状。通过比对发现该酶的活性位点是位于2个结构域表面相距较远的Asp280与Glu509。Mohsin等[62]对β-葡萄糖苷酶的结构进行研究,结果与前面两位学者的类似。对于柚苷酶的结构,虽然目前已有学者对其单组分的结构进行了研究,但柚苷酶的整体结构、柚苷酶两种组成成分的比例构成,目前尚无详尽的报道。

图3 β-D-葡萄糖苷酶的三维结构图[60]

表3 不同来源的β-D-葡萄糖苷酶的结构
3 柚苷酶在柑橘酒酿造中的应用
3.1 柑橘酒的脱苦
3.1.1 柑橘酒中的苦味物质 了解柑橘中的苦味物质及其降解机理,有针对性地去除其中的苦味成分对提高柑橘产品的品质至关重要。柑橘酒中的苦味主要来源于以下三个方面:(1)柑橘原料中所含的黄酮类及其衍生物质,如芸香柚皮苷、柚皮苷、新橙皮苷等;(2)发酵过程中无苦味物质转变成苦味物质,也就是在榨汁和酿制时产生的“延迟苦味”,如柠檬苦素、诺米林等;(3)柑橘酒发酵过程中,由于残糖、氨基酸和维生素等营养物质的存在,使得乳酸菌、产苦味杂菌等生长产生的苦味[14-15]。表4、表5总结了柑橘果实及柑橘酒中的主要苦味物质,从表中可以看出柑橘酒中柚皮苷的含量远高于柠檬苦素和诺米林,是柑橘酒中主要的苦味物质。柚苷酶的作用底物柚皮苷、芸香柚皮苷等是存在于柑橘类水果原料中的主要苦味物质,品种、采样地点、成熟期及栽培环境不同的柑橘,其苦味成分的组成和含量也会不同。因此在柑橘酒酿造过程中,原料的选择至关重要,柑橘类水果原料中含有大量的苦味代谢物。柑橘果肉中的柚皮苷在幼果期和果实膨胀期含量较多,到成熟阶段含量则逐步下降[63],从表4可以看出柑橘果实中的苦味物质主要集中在囊衣、果皮和种子中[64],因此在进行柑橘酒酿造时,应选择充分成熟的柑橘原料,并在榨汁时彻底去除果皮和种子,降低柑橘酒中苦味物质含量。
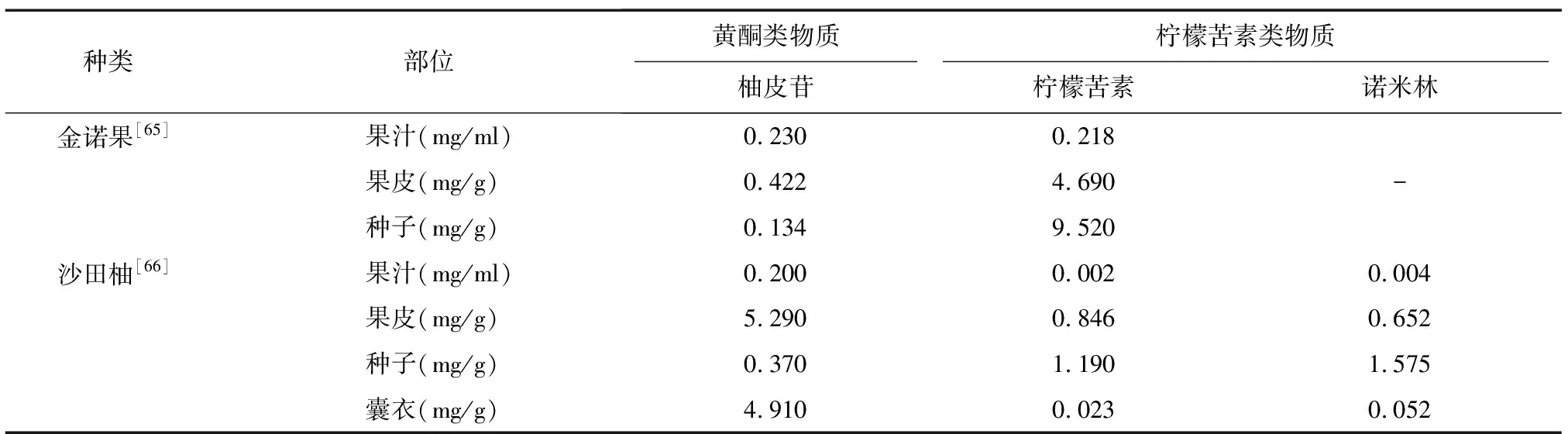
表4 柑橘果实中主要的苦味物质含量

表5 柑橘饮料中主要的苦味物质含量
3.1.2 柚苷酶对柑橘酒的脱苦应用研究 在柑橘汁和柑橘酒的生产中,苦味对果酒的风味及品质有一定的影响,其中以柚皮苷为主要苦味成分[72-73]。研究结果表明,在柑橘汁中,柚皮苷含量大于1.5 mg/ml会对果汁的品质产生一定的影响[74]。采用柚苷酶水解法,不仅可以有效降低柚皮苷含量,而且可以保持柑橘类产品原有的风味和营养,增加消费者的接受程度,是一项非常有前景的技术。柚苷酶水解法具有专一性强、操作简单、不损失风味和营养等优点,是当前最理想的脱苦方式。江飞凤等[70]采用柚苷酶对柚子酒进行脱苦,发现酶添加量2.0 g/L、反应温度50 ℃、反应时间60 min、pH4.0时,柚子酒脱苦率为53.67%。张方艳等[75]采用柚苷酶对柑橘酒进行脱苦,发现对发酵后的柑橘酒进行加酶处理的脱苦效果比发酵前对鲜榨柑橘汁进行加酶处理的脱苦效果更好,且当柑橘酒中柚苷酶添加量为6 g/L、pH 7.0、反应温度50 ℃、反应时间60 min时,脱苦效果最好,柑橘酒脱苦率可达到64.05%。目前国内外已有柚苷酶上市,但其在食品工业中并没有广泛应用,主要原因是缺乏高产柚苷酶的菌株,且柚苷酶的酶活性低,柑橘汁和柑橘酒中的低pH值环境也会抑制柚苷酶的活性。除此之外,目前对柚苷酶在柑橘酒中的脱苦研究还较少,大多集中在对柑橘汁的脱苦研究上,虽已有学者对发酵前脱苦和发酵后脱苦的柑橘酒进行研究[76],但是缺乏与原酒的对比。在用柚苷酶进行脱苦时,柚苷酶分离纯化成本大,目前的试验大多是向柑橘汁和柑橘酒中直接加入发酵粗酶液进行脱苦,这虽然能在一定程度上降低柑橘汁和柑橘酒中的苦味物质,但发酵液中的其他物质及灭酶活时的高温环境对柑橘汁和柑橘酒的品质也存在一定的不良影响,后续可针对这些问题进行研究,提高柑橘酒的品质。
3.2 柑橘酒的增香
果酒酿造过程中的某些单萜类物质对果酒的风味有重大贡献,这些化合物以游离形式如芳樟醇、橙花醇、香叶醇、α-松油醇、香茅醇、氧化芳樟醇或者与糖基结合的香气前体形式存在[77]。这些香气前体物质多为无味,以β-D-吡喃糖苷和二苷的形式存在,如6-O-α-L-呋喃糖苷-β-D-吡喃糖苷、6-O-α-L-鼠李糖基-β-D-吡喃糖苷(芦丁苷)和6-O-β-D-吡喃糖苷-β-D-吡喃糖苷等[71],酸解或酶解时可释放出游离态香气物质,从而影响果酒风味。与酸解法相比,酶解法对果酒中的单萜类成分影响较小,因而更具优势。β-D-葡萄糖苷酶水解糖苷键配体中芳香成分和糖基间的糖苷键后,能有效实现增香。但当糖苷与双糖相连时,则需要先被酶如β-木糖苷酶、α-阿拉伯糖苷酶或α-L-鼠李糖苷酶等水解分子末端的双糖后,β-D-糖苷酶才能水解释放糖苷配体[3,78],其水解释放糖苷配体过程如图4所示。因为香气和苦味物质作为影响柑橘酒品质和风味的两个重要指标,所以β-D-葡萄糖苷酶在提升柑橘酒香气和脱苦方面的应用备受关注[3]。柚苷酶中含有β-D-葡萄糖苷酶,柚苷酶作用于柑橘酒时,不仅能脱苦,同时还能提高柑橘酒的香气。有学者对未经脱苦处理的柚子酒和脱苦后的柚子酒香气成分进行分析发现,脱苦处理后生成了3种新成分,分别是顺-9-十六碳烯酸乙酯、正丙醇和正己酸乙酯,这3种香气成分之间可以互相协同,提升柚子酒风味[70]。β-D-葡萄糖苷酶能有效提高柑橘酒风味,然而目前葡萄糖苷酶主要应用于葡萄酒和蓝莓酒上,在柑橘酒上的研究和应用还比较少,且柑橘酒在加工过程中的很多因素都会影响β-D-葡萄糖苷酶的活性,从而影响产品风味,后续应进一步对β-D-葡萄糖苷酶在柑橘酒中的应用进行深入研究。

代表香气物质。
4 总结及展望
综上所述,柚苷酶是非常重要的工业酶,其在柑橘酒的脱苦及增香方面具有潜在的应用价值。近年来对柚苷酶的研究主要集中在产柚苷酶菌株的筛选,柚苷酶酶学性质及其在柑橘汁、柑橘酒脱苦应用等方面,但其结构、功能及分子生物学方面还没有被深入研究,现有研究对柚苷酶作用的分子机制也知之甚少,其晶体结构尚未确定。除此之外,柚苷酶目前在柑橘酒中的脱苦应用研究较少,柑橘酒的脱苦效果也不理想,其产品风味受到了严重影响。因此,在不影响柑橘酒本身风味物质的前提下,酶解法脱苦对有效去除柑橘酒中的苦味、提高柑橘酒品质具有重要的意义。鉴于目前柚苷酶及其应用存在的问题,未来可以考虑从以下几方面进行研究:
(1) 产柚苷酶菌一般为诱导性菌株,需要向培养基中加入诱导物诱导其产酶,诱导物价格昂贵,生产成本较高,这也是柚苷酶不能工业化生产的重要原因,后续可考虑筛选组成型的产柚苷酶菌株。
(2) 目前对柚苷酶的研究主要集中于菌种的筛选、发酵工艺优化及简单酶学性质研究,柚苷酶是由两种酶构成,其整体结构是单一蛋白还是组合蛋白及两种酶的比例构成尚不清楚,如果其是单体酶,则应对其整体结构进行研究,如果是由两种酶组成,则应对其单组分结构和组成比例进行研究。
(3) 柚苷酶分离纯化成本高,且其在柑橘酒中的应用研究还较少,柑橘酒的pH值偏低,而柚苷酶的最适pH值为4~6,柑橘酒的酸性环境会抑制柚苷酶的活性。除此之外,柑橘酒中的其他成分也会抑制柚苷酶的活性,后续可考虑筛选耐酸性的高产柚苷酶的菌株,将其与酵母菌混菌发酵,在发酵的同时去除苦味物质。

