基于凝血功能与肝功能的评估模型在预测乳腺癌术后辅助化疗患者预后的应用
曾 敏,翁 桦,孙健泳,丁小华
(1.潮州市人民医院肿瘤科;2.潮州市人民医院眼科,广东 潮州 521000)
乳腺癌是女性常见的恶性肿瘤,死亡率较高[1]。乳腺癌的治疗方式较多,其中手术为主要治疗方式,但因部分乳腺癌患者常合并淋巴结转移,术后的复发率较高,因此术后采取辅助化疗的方式至关重要。乳腺癌术后辅助化疗能够提高患者的治疗效果及降低复发率,但化疗也存在较多不良反应,且容易出现复发或死亡情况,影响患者的预后。为提高整体治疗效果,采取合理方式预测乳腺癌术后辅助化疗患者预后至关重要[2]。乳腺癌患者体内的肿瘤细胞能激活各类细胞因子,导致血液呈高凝状态,引起相关凝血指标的变化,同时乳腺癌患者长时间进行新辅助化疗也会损伤肝功能,通过测定肝功能指标对评估预后也有一定的价值。本研究探讨凝血功能、肝功能指标水平预测乳腺癌术后辅助化疗患者预后的价值,以期提高乳腺癌患者的生存质量,现报道如下。
1 资料与方法
1.1 一般资料选取2021 年1 月至2022 年5 月潮州市人民医院收治的80 例术后新辅助化疗患者为研究对象进行回顾性分析,均进行1 年的随访,根据预后情况分为预后良好组(56 例)和预后不良组(24 例),预后良好的判定标准:所有可测定目标病灶直径总和缩小≥30%,临床症状、体征基本消失,无新发病灶[3]。预后良好组患者年龄30~64 岁,平均年龄(44.75±6.25)岁;BMI 19~25 kg/m2,平均BMI(22.06±0.58)kg/m2;婚姻状况:未婚11 例,已婚37 例,离异8 例。预后不良组患者年龄32~65 岁,平均年龄(45.02±6.32)岁;BMI 18~25 kg/m2,平均BMI(22.11±0.59)kg/m2;婚姻状况:未婚4 例,已婚15 例,离异5 例。两组患者一般资料比较,差异无统计学意义(P>0.05),组间具有可比性。本研究经潮州市人民医院医学伦理委员会批准。纳入标准:①符合《中国抗癌协会乳腺癌诊治指南与规范(2015 版)》[4]中乳腺癌的诊断标准,经病理组织学检查确诊;②多数患者可触及包块;③年龄18~65 岁;④临床资料完整;⑤具备良好的精神状态及沟通交流能力。排除标准:①合并心、肝、肾等器质性疾病患者;②合并其他恶性肿瘤疾病者;③伴有血液疾病者及自身免疫疾病者。
1.2 研究方法测定患者凝血功能与肝功能指标,于治疗前及随访1 年后采集患者肘静脉血4 mL,将采集的血液标本置于乙二胺四乙酸钠管中,以3 000 r/min 离心10 min(离心半径10 cm)分离血浆。采用全自动凝血分析仪(法国STAGO 公司,型号:Compact)检测凝血酶原时间(PT)、凝血酶时间(TT)、活化部分凝血活酶时间(APTT)及纤维蛋白原(FIB)。同样采集静脉血液,离心分离血清,应用全自动生化分析仪(广州东唐生物科技有限公司,型号:DP180)检测谷丙转氨酶(ALT)、谷草转氨酶(AST)及总胆红素(TBIL)。观察并统计患者治疗期间不良反应发生情况,并且随访1 年记录疾病复发率与生存率。
1.3 观察指标①比较两组患者凝血功能指标。②比较两组患者肝功能指标。③比较两组患者不良反应发生情况、复发率及生存率。不良反应包括恶心呕吐、肝肾损伤、感染等;复发的判断标准:CT 或MRI 检查显示原发病灶可见肿瘤或者出现新发病灶为复发。④分析相关指标预测乳腺癌术后辅助化疗患者预后不良的价值。
1.4 统计学分析采用SPSS 20.0 统计学软件分析数据。计数资料以[例(%)]表示,组间比较采用χ2检验;计量资料以()表示,组间比较采用独立样本t检验,组内比较采用配对样本t检验。预测价值采用受试者操作特征(ROC)曲线分析。以P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者凝血功能指标比较随访1 年后,预后良好组患者PT、TT、APTT 短于治疗前,差异有统计学意义(P<0.05),FIB 水平低于治疗前,差异有统计学意义(P<0.05);预后良好组患者PT、TT、APTT 短于预后不良组,差异有统计学意义(P<0.05),FIB 水平低于预后不良组,差异有统计学意义(P<0.05),见表1。
表1 两组患者凝血功能指标比较()
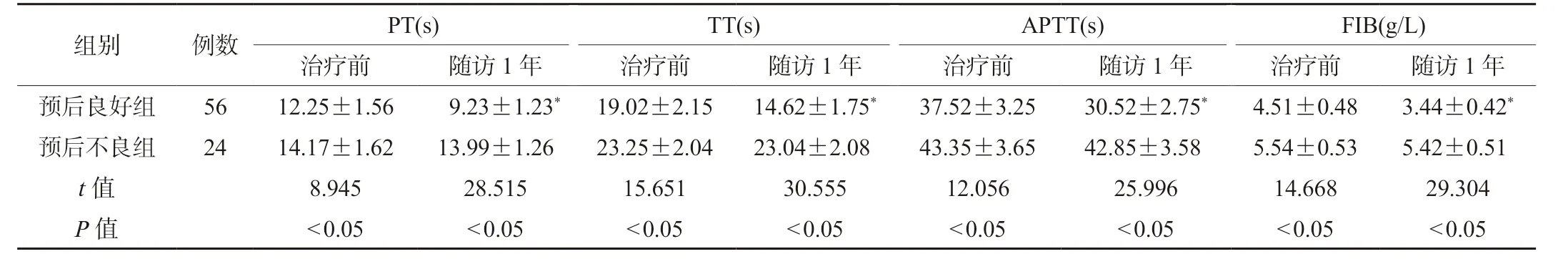
表1 两组患者凝血功能指标比较()
注:与同组治疗前比较,*P<0.05。PT:凝血酶原时间;TT:凝血酶时间;APTT:活化部分凝血活酶时间;FIB:纤维蛋白原。
组别 例数 PT(s) TT(s) APTT(s) FIB(g/L)治疗前 随访1 年 治疗前 随访1 年 治疗前 随访1 年 治疗前 随访1 年预后良好组 56 12.25±1.56 9.23±1.23* 19.02±2.15 14.62±1.75* 37.52±3.25 30.52±2.75* 4.51±0.48 3.44±0.42*预后不良组 24 14.17±1.62 13.99±1.26 23.25±2.04 23.04±2.08 43.35±3.65 42.85±3.58 5.54±0.53 5.42±0.51 t 值 8.945 28.515 15.651 30.555 12.056 25.996 14.668 29.304 P 值 <0.05 <0.05 <0.05 <0.05 <0.05 <0.05 <0.05 <0.05
2.2 两组患者肝功能指标比较随访1 年后,两组患者ALT、AST 及TBIL 水平低于治疗前,且预后良好组患者治疗前和随访1 年后的ALT、AST 及TBIL 水平低于预后不良组,差异有统计学意义(P<0.05),见表2。
表2 两组患者肝功能指标比较()
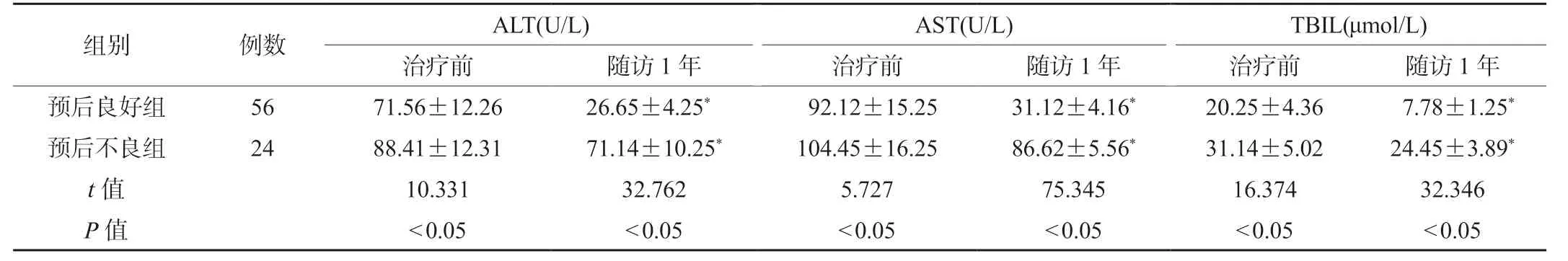
表2 两组患者肝功能指标比较()
注:与同组治疗前比较,*P<0.05。ALT:谷丙转氨酶;AST:谷草转氨酶;TBIL:总胆红素。
组别 例数 ALT(U/L) AST(U/L) TBIL(μmol/L)治疗前 随访1 年 治疗前 随访1 年 治疗前 随访1 年预后良好组 56 71.56±12.26 26.65±4.25* 92.12±15.25 31.12±4.16* 20.25±4.36 7.78±1.25*预后不良组 24 88.41±12.31 71.14±10.25* 104.45±16.25 86.62±5.56* 31.14±5.02 24.45±3.89*t 值 10.331 32.762 5.727 75.345 16.374 32.346 P 值 <0.05 <0.05 <0.05 <0.05 <0.05 <0.05
2.3 两组患者不良反应发生情况、复发率及生存率比较预后良好组患者不良反应发生率与复发率均低于预后不良组,生存率高于预后不良组,差异有统计学意义(P<0.05),见表3。
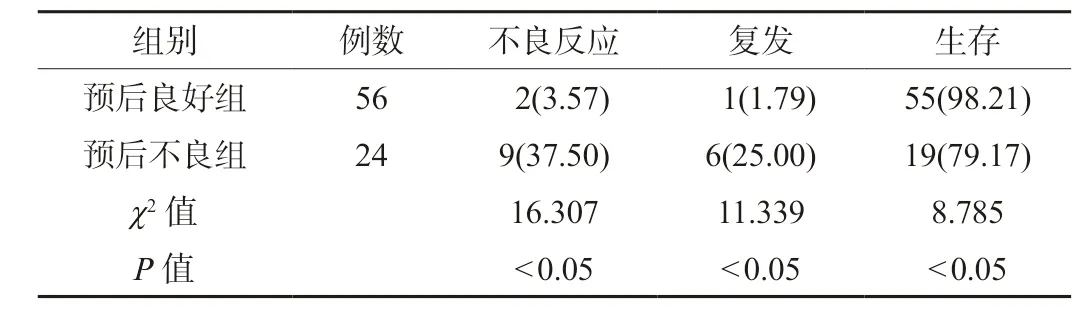
表3 两组患者不良反应发生情况、复发率及生存率比较[例(%)]
2.4 相关指标预测乳腺癌术后辅助化疗患者预后不良的价值分析ROC 曲线分析显示,病灶直径、APTT、ALT 水平预测患者预后不良的曲线下面积(AUC)分别为0.813、0.881 及0.952,见图1、表4。
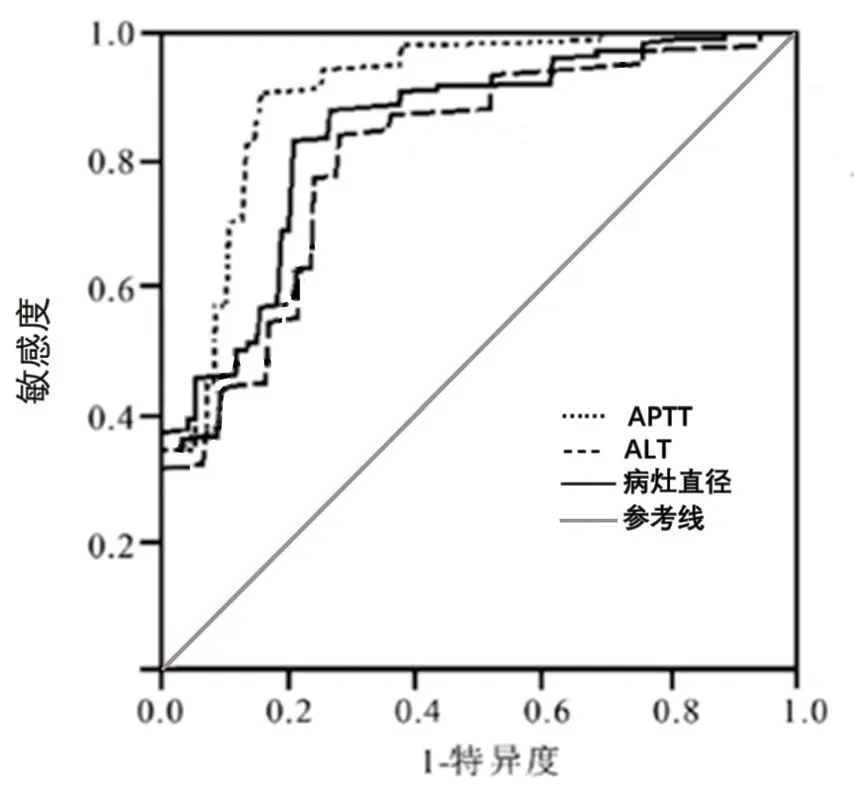
图1 相关指标预测乳腺癌术后辅助化疗患者预后不良的ROC 曲线
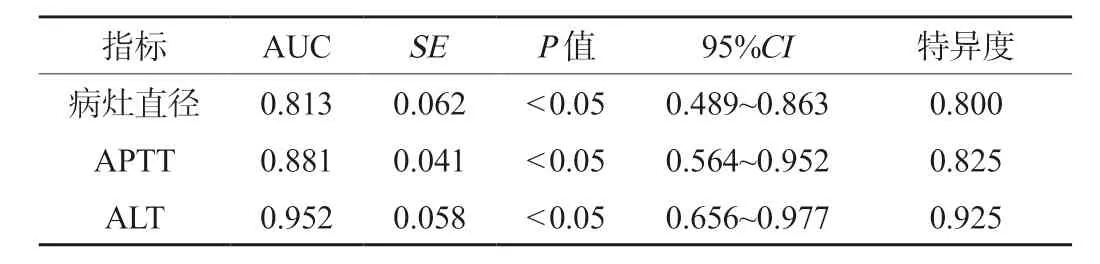
表4 相关指标预测乳腺癌术后辅助化疗患者预后不良的价值分析
3 讨论
相关研究结果表明,针对乳腺癌患者采取手术结合术后辅助治疗方式可取得良好效果,延长患者生存时间[5],但是许多化疗药物会经肝脏代谢甚至在肝脏中活化,引起肝功能损害,化疗对癌细胞杀灭与药物引起的肝功能损伤可产生抵消作用,而辅助化疗对肝功能的作用大于药物引起的肝功能损害是提高治疗效果及改善预后的关键[6]。
针对乳腺癌术后辅助化疗的患者,采取合理的方式评估患者预后有良好的效果,主要是通过准确判定预后,指导治疗方案的调节,以期取得满意的效果[7]。既往针对乳腺癌患者治疗预后的判定,往往是通过影像学技术辅助进行,而实际上通过影像学的方式辅助诊断存在较多的误诊漏诊情况,不利于干预方案的调节。乳腺癌患者在发病后,肿瘤部位的血运丰富,而局部血运可能出现一定的障碍,随着病变的持续进展在相关凝血指标发生改变,异常凝血情况是病变发生及发展的关键[8]。本研究结果显示,治疗前及随访1 年后预后良好组患者凝血指标和肝功能指标均优于预后不良组。主要是乳腺癌术后采取辅助化疗方式,化疗药物的应用易引起凝血功能亢进及增强纤溶系统活性,可在不影响血小板体积的情况下杀伤血小板,经术后辅助化疗获得良好预后效果患者可经化疗药物的作用调节相关凝血指标,增强凝血功能,而预后不良的患者凝血功能则未见改变甚至障碍进一步加重[9]。肝功能损伤属于化疗药物常见的不良反应,其病机复杂,通常是多机制联合作用的结果,化疗药物对肝脏产生损伤刺激作用的同时还可引起肝细胞损伤坏死,若新生肝脏细胞的生成速度比肝脏损伤细胞速度快,则可以有效改善患者的肝功能,对于预后良好的患者,肝细胞的代谢速度加快,肝功能指标更优[10-11]。此外,本研究结果显示,预后良好组患者不良反应及复发率低于预后不良组,生存率高于预后不良组。同时,ROC 曲线分析发现病灶直径、APTT 及ALT水平可用于预测预后不良,ALT 是肝功能损伤后最早出现、最灵敏的生化指标,其水平的变化可以间接反映术后新辅助化疗方式的效果,药物性肝损伤也会影响生活质量甚至延长化疗周期,进而增加不良反应,影响患者复发率及生存率,导致预后不良,因此对于乳腺癌术后辅助化疗者需注意化疗药物引起的肝功能损伤情况,采取合理干预方式。
综上所述,对于乳腺癌患者,通过测定凝血指标及肝功能指标对于预测患者术后辅助化疗预后效果良好,可根据预测情况指导早期合理干预,改善患者预后及提高生存质量。

