体外消化对苦荞酚类物质含量及抗氧化活性的影响
李诺,张东杰,张桂芳,张爱武
(1.黑龙江八一农垦大学食品学院,大庆 163319;2.黑龙江八一农垦大学国家杂粮工程技术中心;3.黑龙江省农产品加工与质量安全重点实验室)
苦荞(Tartary buckwheat)是我国主要的小宗粮豆作物之一,被称为“五谷之王”,它与人们所熟悉的“何首乌、大黄”等同属蓼科,是我国药食同源的典型代表。苦荞多酚、黄酮类化合物是重要的生物活性物质,包括芦丁、槲皮素、绿原酸等多种单体酚成分,赋予了苦荞良好的抗氧化、抗炎、防癌等功能特性,在改善人体胃肠道功能、防止心脑血管疾病方面具有积极作用[1]。
目前,关于苦荞抗氧化活性的探究多集中于多酚、黄酮类提取物的体外抗氧化活性评价,这无法直接预测苦荞食品对人体健康发挥的生物性价值。食品中的营养组分发挥其功能活性必然要经过消化这一关键步骤,且只有营养组分在消化过程中被释放,才能发挥其生物学意义[2]。由此可见,消化对于食品营养组分生物活性的影响具有重要意义。体外消化是利用仿生原理,最大程度地模拟食物在体内消化、吸收的过程,有可操作性强、普适性广等特点,被广泛应用于食品营养成分功能活性研究方面,是评估食物在消化过程中营养成分变化情况的重要技术手段[3]。因此,试验以苦荞为研究对象,借助体外消化模型探究其在口腔、胃、肠消化阶段中总多酚、总黄酮释放量及抗氧化活性变化,探讨消化对苦荞酚类物质抗氧化功能特性的影响,并分析总多酚、总黄酮释放量与抗氧化活性的关系,以期为更好的评价苦荞消化过程中的酚类物质的功能特性提供研究基础。
1 材料与方法
1.1 主要材料与试剂
苦荞(购于大庆市北京华联超市);胃蛋白酶(250 U·mL-1)、胰酶(8 USP)、α-淀粉酶(5 U·mL-1)、胆汁均购于Sigma 公司;1,1-二苯基-2-苦基肼(DPPH,纯度≥98%)、2,2'-联氮-双-3(乙基苯并噻唑啉-6-磺酸)、二铵盐(ABTS,纯度≥98%)均购于上海源叶生物科技有限公司;福林酚、没食子酸(纯度≥98%)、芦丁(纯度≥98%)均购于北京索莱宝科技有限公司;亚硝酸钠、碳酸氢钠、硝酸铝等分析纯均来自于天津市大茂化学试剂厂。
1.2 主要仪器与设备
AdventurerTM电子分析天平(上海奥豪斯仪器有限公司);FW100 型高速万能粉碎机(天津市泰斯特仪器有限公司);DK-S24 型恒温水浴锅(上海森信实验仪器有限公司);T6 系列紫外可见分光光度计(北京普析通用仪器有限责任公司);HZQ-Q 全温震荡器(哈尔滨市东联电子技术开发有限公司);H1850R 台式高速冷冻离心机(湖南湘仪实验室仪器开发有限公司)。
1.3 试验方法
1.3.1 原料预处理
挑选颗粒饱满,色泽均匀的苦荞籽粒,清洗后低温烘干,用万能粉碎机粉碎,过60 目筛[4],得到苦荞粉样品,在4 ℃下密封保存。
1.3.2 体外消化方法
体外消化方法参考姚轶俊等[5]方法略作修改。口腔消化:称取2 g 苦荞粉加入10 mL 蒸馏水溶解,加热沸腾熟化,随后冷却至室温用蒸馏水定容至10 mL,加入口腔消化液,即含有10 mg α-淀粉酶的10mLCaCl(21mmol·L-1,pH7.0)溶液,放置在37 ℃恒温水浴摇床中,以70 r·min-1的速度消化10min。在消化0 min 时记为初始消化,在消化0、5、10 min取样待测。胃消化:用6 mol·L-1的HCl 溶液将完成口腔消化的消化液pH 调节至2.0,然后加入胃消化液,即10 mL 含有0.5 g 胃蛋白酶的0.1 mol·L-1的HCl溶液,在37 ℃恒温水浴摇床中,以100 r·min-1的振荡速度消化120 min,在消化60、120 min 取样待测。肠消化:向胃消化结束的溶液中逐滴加入1 mol·L-1的NaHCO3,使溶液的pH 值为7.0,随后加入肠消化液,即10 mL 含有0.25 g 胰酶、0.7 g 胆汁的0.5mol·L-1NaHCO3溶液,在37℃恒温水浴摇床中,以100r·min-1的振荡速度消化120min,在消化60、120 min 取样待测。
以上所有消化阶段均设置不含有消化酶的对照组,各消化阶段所取的样品待测液在4 ℃条件下,以10 000 r·min-1的转速,离心10 min,收集上清液,于-80 ℃冰箱中保存。
1.3.3 总多酚含量测定方法
根据福林-酚法进行测定[6],分别取1 mL 的样品待测液和没食子酸标准品溶液,依次加入1 mL 福林-酚试剂,2 mL 浓度为150 g·L-1的NaCO3溶液,用蒸馏水定容至10 mL,在760 nm 处测定吸光值,以没食子酸的不同浓度为横坐标,对应吸光值为纵坐标绘制标准曲线,按照公式(1)计算,结果以每g 样品中没食子酸当量表示。
式中:X 为样品中总多酚含量(mg·g-1);C 为总多酚浓度(mg·mL-1);V 为提取液体积(mL);n 为稀释倍数;m 为样品质量(g)。
1.3.4 总黄酮含量测定方法
参考硝酸铝显色法[7]略作调整,分别取1 mL 不同浓度的芦丁标准品溶液和样品待测液,依次加入浓度为50 g·L-1的亚硝酸钠溶液和100 g·L-1的硝酸铝溶液各1 mL,再加入2 mL 浓度为40 g·L-1的氢氧化钠溶液和3 mL 蒸馏水,在510 nm 处记录其吸光度值,绘制芦丁浓度为0.2~1.0 mg·mL-1的标准曲线,参照公式(2)进行计算,结果以每克样品中芦丁当量表示。
式中:X 为样品中总黄酮含量(mg·g-1);C1为总黄酮浓度(mg·mL-1);V1为提取液体积(mL);n 为稀释倍数;m1为样品质量(g)。
1.3.5 ABTS 自由基清除率测定方法
参照Park 等[8]的方法略作调整,将适量的样品待测液与ABTS 工作液充分混合,于25 ℃避光放置30 min,在734 nm 处测定吸光度,通过公式(3)计算样品ABTS 自由基的清除率。
式中:Am为样品与ABTS 工作液吸光值;An为样品与蒸馏水吸光值;Ak为蒸馏水与ABTS 工作液吸光值。
1.3.6 羟自由基清除率测定方法
参考包怡红等[9]方法略作调整,吸取1 mL 样品待测液于试管中,加入1 mL 6 mmol·L-1的硫酸亚铁溶液和水杨酸-乙醇溶液,再加入2 mL 6 mmol·L-1双氧水溶液混匀,反应30 min 后,在510 nm 处测定吸光度。结果按照公式(4)计算。
式中:A1为样品组吸光值;A2为不含有双氧水的对照组吸光值;A0为不含样品的空白对照组吸光值。
1.3.7 DPPH 自由基清除率测定方法
参考Chen 等[10]的方法略作调整,取一定量的样品待测液与3.5 mL 浓度为0.1 mmol·L-1的DPPH-乙醇溶液混合,25 ℃避光反应30 min,在517 nm 处测定吸光值。按照公式(5)计算DPPH 自由基清除率。
式中:Ai为样品与DPPH-乙醇溶液吸光值;Aj为样品与乙醇吸光值;A0为DPPH-乙醇溶液吸光值。
1.3.8 数据处理与分析
试验数据均采用平均值±标准差表示。采用SPSS 20.0 软件对数据进行方差分析和选择邓-肯多重比较进行差异显著性分析,使用Excel 进行绘图。
2 结果与分析
2.1 总多酚释放量
苦荞在体外消化过程中总多酚释放量变化如图1 所示。消化组总多酚释放量显著大于对照组(P<0.05)。与初始消化阶段相比,口腔、胃、肠消化阶段后多酚释放增加量略有不同,口腔消化后,苦荞总多酚释放量略有上升,最终释放量是初始消化的1.11 倍。胃消化阶段的苦荞总多酚在消化60 min 内释放量显著增加,而后下降,最终释放量是初始消化的1.27 倍。在肠消化阶段,苦荞总多酚释放量持续增加,且消化释放增加量最大,是初始消化的1.92 倍。林栋等[11]研究表明,薏米体外胃消化60 min 后与肠消化240 min 后多酚释放量呈下降趋势,与试验结果一致,推测原因是随着时间延长,导致其消化过度。总之,在体外消化条件的酸、碱以及生物酶的作用下,促进了苦荞多酚的释放,释放量整体变化规律为肠消化>胃消化>口腔消化>初始消化,这与文献报道的糙米体外消化后总多酚释放量增加研究结果具有一致性[12]。

图1 苦荞消化过程中的总多酚释放量Fig.1 Total polyphenol release from tartary buckwheat during digestion
2.2 总黄酮释放量
苦荞在体外消化过程中总黄酮释放量变化与总多酚释放量变化规律相似,如图2 所示。苦荞在体外消化过程中,消化组的总黄酮释放量显著大于对照组(P<0.05)。在各消化阶段,苦荞黄酮被不同程度的释放。在口腔消化过程中,苦荞总黄酮释放量少量增加,是初始消化的1.22 倍,在胃消化阶段,苦荞总黄酮释放量呈现先上升后下降的变化趋势,具体表现在消化60 min 内显著升高,在消化60 min 后释放量虽所下降,但显著大于初始消化阶段,最终释放量是初始消化的1.33 倍,在肠消化阶段,苦荞总黄酮释放增加量最大,是初始消化的3.30 倍。由此表明,整体来看体外消化使得苦荞黄酮的总释放量显著增加,各消化阶段释放量由大到小为肠消化>胃消化>口腔消化>初始消化。对于在胃消化过程中出现释放量下降的变化趋势,这与苦荞米饭在胃消化90 min后,其黄酮释放量降低变化趋势相符,这可能是随着消化时间的延长,苦荞黄酮被消化过度,也可能是由于消化酶及酸、碱极端环境的影响下,黄酮类物质由结合态被水解为不稳定的游离态,这极大地增加了与淀粉、蛋白、多糖等成分的结合几率,减少了暴露在消化液环境中的官能团,导致其含量呈下降趋势[13]。
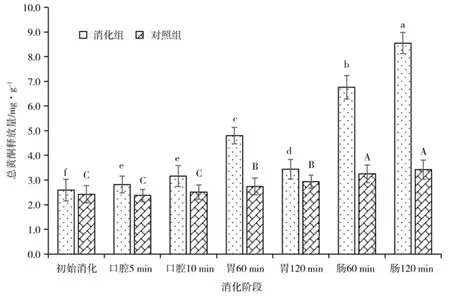
图2 苦荞消化过程中的总黄酮释放量Fig.2 Total flavonoids release from tartary buckwheat during digestion
2.3 体外抗氧化活性分析
2.3.1 ABTS 自由基清除率
图3 呈现了在体外消化过程中,苦荞ABTS 自由基清除率的变化规律。与对照组相比,消化组具有更强的ABTS 自由基清除能力(P<0.05)。与初始消化相比,口腔消化10 min 内,苦荞ABTS 自由基清除率略有升高,是初始消化的1.33 倍,在胃消化阶段的前60 min 内ABTS 自由基清除率上升,而后虽有下降,但也显著高于初始消化和口腔消化,分别是初始消化和口腔消化的1.79 倍和1.34 倍。在肠消化后ABTS 自由基清除率数值最大,相比于初始消化增强了1.71 倍。因此,体外消化增强了苦荞对ABTS 自由基的清除能力,使其拥有更强的体外抗氧化活性,抗氧化活性由强到弱具体表现为肠消化>胃消化>口腔消化>初始消化,这也说明苦荞消化后更有利于人体抗氧化损伤。
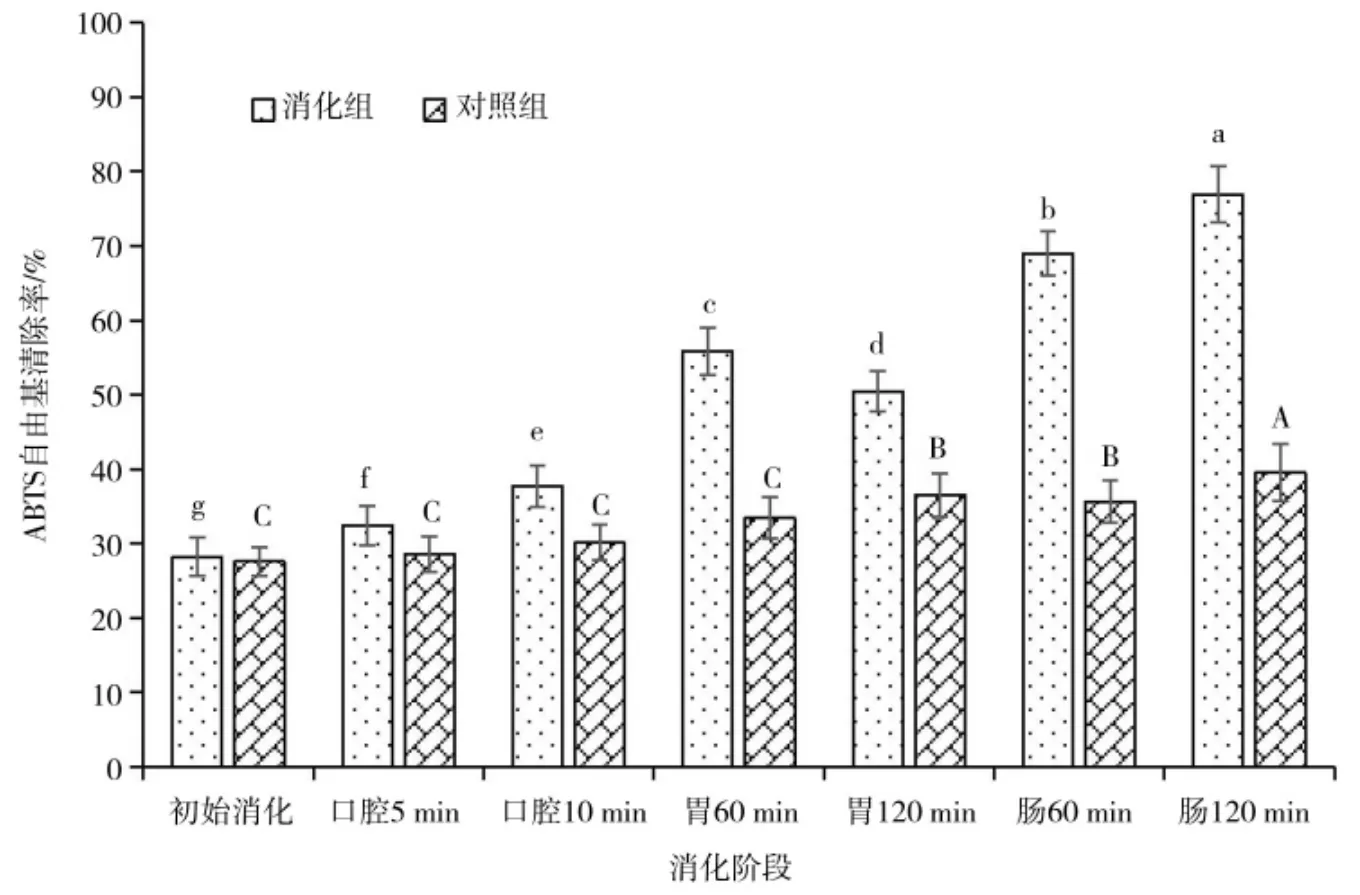
图3 苦荞消化过程中的ABTS 自由基清除率Fig.3 ABTS radical scavenging rate during buckwheat digestion
2.3.2 羟自由基清除率
苦荞在体外消化过程中的羟自由基清除率变化如图4 所示,苦荞消化组的羟自由基清除率明显大于对照组(P<0.05)。比较不同消化阶段的羟自由基清除率发现,肠消化后的苦荞清除羟自由基能力最强,清除率为是初始消化阶段的3.92 倍;其次是胃消化后的苦荞清除羟自由基能力,是初始消化阶段的1.88 倍;然后是口腔消化后苦荞清除羟自由基能力,是初始消化阶段的1.60 倍。由此体现出苦荞在各消化阶段的羟自由基的清除能力呈逐渐增强变化趋势,这与前文苦荞消化后对ABTS 自由基清除的变化规律一致。苦荞通过体外消化提高了其羟自由基清除能力,体现出更强的体外抗氧化活性,这为苦荞抗氧化功能性食品的开发奠定理论基础。
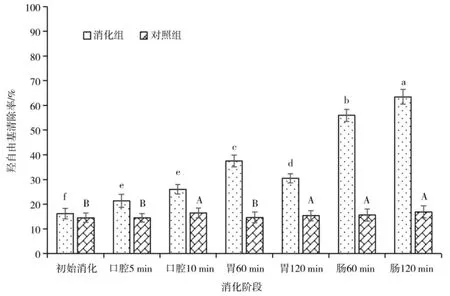
图4 苦荞消化过程中的羟自由基清除率Fig.4 Hydroxyl radical scavenging rate during buckwheat digestion
2.3.3 DPPH 自由基清除率
苦荞体外消化过程中DPPH 自由基清除率的变化如图5 所示,苦荞消化组的DPPH 自由基清除率明显高于对照组(P<0.05)。分析不同消化时段的自由基清除率发现,口腔消化阶段苦荞DPPH 自由基清除率显著上升,在胃消化阶段清除率呈现先上升后下降的变化趋势;在肠消化阶段,随着消化过程的进行,DPPH 自由基清除率持续上升。整体来看,体外消化增强了苦荞DPPH 自由基清除能力,对DPPH 自由基清除能力由强到弱的顺序为肠消化>胃消化>口腔消化>初始消化,结果与前两种抗氧化评价模型试验结果相符。与之略有不同的是体外消化后苦荞DPPH 自由基清除率由44.10%增加至64.37%,清除 率增加量的变化幅度略小于其它两种评价模型。
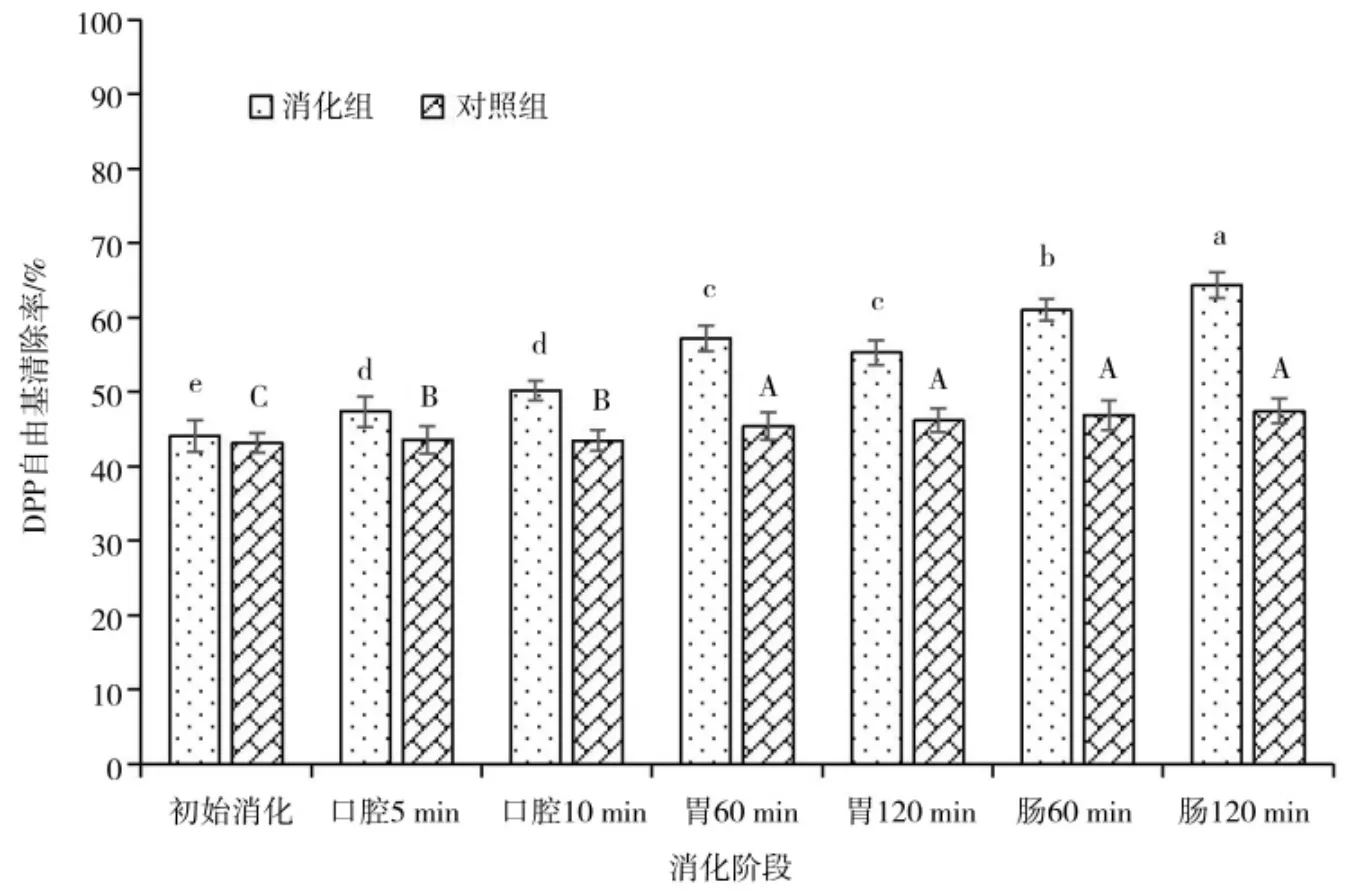
图5 苦荞消化过程中的DPPH 自由基清除率Fig.5 DPPH radical scavenging rate during buckwheat digestion
2.4 总多酚、总黄酮释放量与体外抗氧化活性的相关性分析
羟自由基清除率、ABTS 自由基清除率、DPPH 自由基清除率,是考察植物多酚体外抗氧化活性的常用指标。在试验中,苦荞经体外消化后,羟自由基、ABTS 自由基、DPPH 自由基清除率显著增加,且苦荞消化后总多酚、总黄酮释放量也呈显著增加趋势。推测苦荞消化后抗氧化活性的增强,可能与其总多酚、总黄酮释放量的增加有关。
分析苦荞体外消化过程抗氧化活性的变化与总多酚、总黄酮释放量的相关性,结果如表1 所示。在口腔消化阶段,总多酚、总黄酮释放量与羟自由基、ABTS 自由基、DPPH 自由基清除之间的相关性系数为R2=0.852-0.997;在胃消化阶段,总多酚、总黄酮释放量与羟自由基、DPPH 自由基和ABTS 自由基清除率之间的相关性系数为R2=0.792-0.904;在肠消化阶段,总多酚、总黄酮释放量与羟自由基、DPPH 自由基和ABTS 自由基清除率之间相关性系数为R2=0.971-0.989,表明在口腔、胃、肠消化阶段苦荞的抗氧化活性与总多酚、总黄酮释放量具有较强相关性。由此可见,苦荞在消化过程中总多酚、总黄酮的释放对抗氧化活性具有重要作用。这与马艺超等[14]研究表明的苦荞面包在体外消化中黄酮释放量增加与抗氧化活性增强呈显著相关具有一致性。
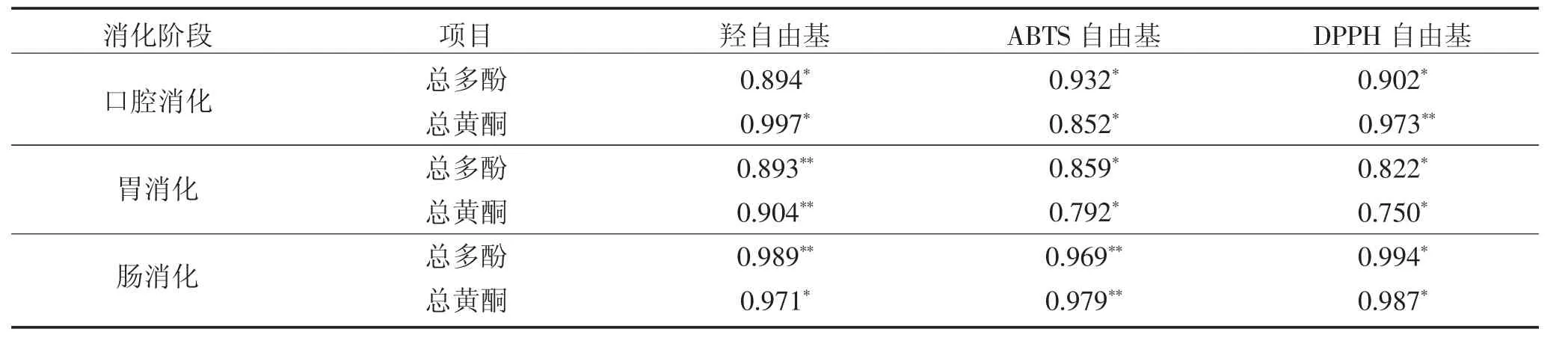
表1 苦荞消化过程中总多酚、总黄酮释放量与体外抗氧化活性的相关性分析Table 1 Correlation analysis among the release of total polyphenols,total flavonoids and antioxidant activity in vitro during tartary buckwheat digestion
3 讨论
体外消化是考察植物多酚生物活性的有效技术手段,在消化酶的作用下,酚类物质发生着一系列的变化[15]。例如,α-淀粉酶通过作用于糖苷键使其断裂,从而将原本与样品中多酚、黄酮类物质发生复合,不易被释放的多糖分离和淀粉酶解,胃蛋白酶和胰蛋白酶会促使羧基断裂,胰脂肪酶能水解酯键,进而使得结合态多酚失去束缚被释放,增加其释放量[16-18]。在试验中,消化组总多酚、总黄酮释放量显著大于对照组,可能是由于消化组添加α-淀粉酶、胃蛋白酶、胰酶后,消化酶水解结合态多酚中与淀粉、多糖相连的糖苷键,破坏与纤维素、木质素相连的酯键,从而使结合态多酚变成游离态多酚而被检测到,表现为消化组总多酚、总黄酮释放量显著增加的变化趋势,这与藜麦体外消化后结合型多酚被显著释放的研究结果相符[19]。
自由基清除率的测定是用于评价体外抗氧化特性的常用方法。试验结果表明,DPPH 自由基、ABTS自由基和羟自由基清除率3 种评价指标均显示,体外消化能够提高苦荞的抗氧化活性。多酚、黄酮类物质作为发挥抗氧化活性的主要功能成分[20],体外消化过程中苦荞多酚、黄酮类物质的释放,使体外抗氧化活性明显增强,这与Masisi 等[21]总结的小麦、大米等多种常见谷物体外消化及抗氧化特性,发现胃、肠消化后,抗氧化能力的提高与总多酚含量显著相关的实验结果相符。盛雪飞[22]研究表明,当黄酮单体芦丁与黄酮单体槲皮素组合时,具有一定的协同抗氧化作用。另外,在消化酶的作用下,苦荞中的蛋白质和多糖可被酶解成具有抗氧化活性的多肽和低分子寡糖等抗氧化物,多酚—多糖[23]、多酚—蛋白[24-25]的相互作用可增加多酚的生物利用率,使多酚表现出更强的生物活性。综上所述,苦荞消化后抗氧化活性的增强与抗氧化物的释放及其相互作用有关。
多篇文献报道表明,多酚、黄酮类物质与抗氧化活性存在相关性[26-29]。在试验中,将苦荞消化总多酚、总黄酮释放量与DPPH 自由基、ABTS 自由基、羟自由基的清除率进行分析,相关性系数在0.792~0.997之间,说明总多酚、总黄酮释放量与抗氧化具有较强相关性。陆俊等[30]研究体外胃、肠消化对6 种黑色食品多酚、黄酮释放量及抗氧化活性的影响,结果显示体外消化增加了多酚、黄酮释放量,增强了其体外抗氧化活性,相关性系数为0.716~0.999,存在强相关性。林栋等[11]研究证实,薏米在胃、肠消化能够增强其体外抗氧化活性与多酚、黄酮释放量的增加具有强相关性。试验结果与上述研究结果一致,证明苦荞消化后抗氧化活性的增强与总多酚、总黄酮释放量的增加存在较强相关性。
4 结论
体外模拟口腔、胃、肠消化与初始消化相比较,显著增加了苦荞多酚、黄酮类物质的释放(P<0.05),总多酚、总黄酮释放量在不同消化阶段的变化规律为肠消化>胃消化>口腔消化>初始消化。此外,体外消化各阶段与初始消化相比,苦荞ABTS 自由基、羟自由基、DPPH 自由基清除率显著增强(P<0.05),经相关性分析表明,苦荞的抗氧化活性与消化液总多酚、总黄酮释放量具有强相关性,证明体外消化可以提高苦荞的抗氧化特性。体外模拟消化是探究摄入物在消化作用影响下是否能够发挥功能活性的重要技术手段,是连接体内试验与体外营养评价的重要桥梁,试验意义在于借助体外消化考察苦荞多酚、黄酮类物质的抗氧化活性,以期为更深入全面的探究苦荞生物利用价值及其功能性食品开发提供理论基础。

