花粉-食物过敏综合征
姜楠楠,向莉
作者单位:100045 北京,国家儿童医学中心 首都医科大学附属北京儿童医院过敏反应科,儿科重大疾病研究教育部重点实验室
花粉-食物过敏综合征(pollen-food allergy syndrome,PFAS)是由IgE介导的一种特殊的食物过敏类型,一般发生在花粉过敏患者,由与花粉具有交叉过敏植物源性食物诱发,部分患者可发生严重过敏反应。PFAS症状通常出现在口唇、口腔黏膜和咽喉部,也曾被称为口腔过敏综合征(oral allergy syndrome,OAS),除口腔外,多项研究显示PFAS也可累及口腔外系统,如消化系统、呼吸系统,甚至可发生严重过敏反应[1-3]。OAS这个概念容易与仅表现为口咽部症状的非花粉相关食物过敏相混淆,且不能体现花粉食物交叉反应的机制,故现在PFAS逐渐替代了OAS。目前在不同研究中OAS、PFAS均有使用。本综述统一使用PFAS这一概念。PFAS在婴幼儿少见,常见于年长儿、青少年及成人。但由于花粉症在儿童发病率逐年升高,PFAS在儿童的发病情况亦值得关注[4-5]。笔者近期研究显示PFAS可发生在0~3岁婴幼儿[5]。本综述总结PFAS现有的流行病学、临床特征、诱因、发病机制、诊断和治疗。
1 流行病学
PFAS在普通人群患病率尚不明确,因通常发生在花粉致敏个体,患病率一般在花粉过敏群体中统计,因不同地域花粉分布特点,患病率存在明显地域差异。如欧洲的数据显示PFAS在花粉过敏成人患病率为47%~70%[6]。我国一项成人回顾性研究示27.3%~30%花粉症患者合并PFAS[7-8]。近几年儿童花粉过敏患病率呈现逐年升高趋势[9],儿童PFAS患病率研究有限,根据地域、研究对象、研究方法不同,PFAS在儿童的流行病学数据存在较大差异。意大利的一项研究示在花粉过敏导致的过敏性鼻炎儿童中,PFAS的患病率为24%[10]。韩国的一项研究纳入了特应性皮炎和桦树花粉症的2~18岁儿童,PFAS的患病率可高达43.5%[11]。我国流行病学研究提示内蒙古地区花粉过敏相关过敏性鼻炎的患病率分别为6.6%(0~6岁)、16%(7~12岁)、27.7%(13~17岁)[12],但遗憾的是,此项研究未见PFAS患病率数据。PFAS 患病率与花粉致敏种类有关,桦树过敏与多重花粉致敏个体更容易合并PFAS。瑞典的一项研究显示70%的桦树过敏患者和19%的其他花粉过敏患者存在PFAS[13]。韩国最近的一项多中心的研究显示,花粉过敏患者PFAS患病率为41.7%,仅对夏季或秋季花粉致敏个体PFAS患病率约为20%~30%,对春季和秋季花粉同时致敏个体PFAS患病率高于50%[14]。
2 临床表现
多数PFAS症状局限于直接接触食物的口唇和口腔黏膜,但在部分病人中也可表现为累及全身多系统的严重过敏反应,如全身荨麻疹、血管神经性水肿、气道痉挛、咳嗽、呕吐和腹痛等。一项研究显示PFAS胃肠道外的其他系统症状的发生率为8.7%,严重过敏反应的发生率为1.7%[15]。近期韩国多中心的研究报道显示20.2%的PFAS可出现呼吸系统症状,如咳嗽、呼吸困难,胃肠道表现如呕吐、腹痛的发生率约为10.7%,严重过敏反应的发生率为8.9%[4]。一项我国儿童回顾性研究显示22% PFAS可表现为严重过敏反应,年长儿更易发生严重过敏反应[5]。国外研究显示PFAS患者发生严重过敏反应的危险因素包括:对烹饪过的食物过敏、商品化的食物过敏原皮肤点刺试验阳性、既往严重过敏反应病史及桃过敏等[15]。
从发病机制来说,PFAS初始致敏物为花粉,因此PFAS患者花粉致敏通常先于食物过敏原致敏,但花粉过敏相关症状并不一定先于食物过敏症状。文昭明等在国内首次总结了蒿属花粉症合并食物过敏的临床特征,纳入的多为成人患者,研究提示约50%患者花粉症症状先于食物过敏症状,29%患者食物过敏在先[16]。笔者前期的一项研究显示26%儿童花粉症起病先于食物过敏,18%食物过敏发病在先[5]。以上研究结论提示花粉症患者应注意疾病进展过程中对植物源性食物如水果、蔬菜类食物过敏,对花粉相关食物过敏的患者也要关注出现花粉过敏相关症状如季节性打喷嚏、流涕、眼痒等,必要时定期监测花粉和食物过敏原,监测病程进展。
3 常见与花粉具有交叉过敏反应的食物
PFAS是由于花粉和食物过敏原的交叉反应所致,交叉反应过敏原存在共同的表位是交叉免疫的基础[2,17-20]。表1显示了与花粉存在交叉过敏反应的食物。目前多数报道与花粉有交叉过敏反应的食物多基于病史或病史联合皮肤点刺试验(skin prick test,SPT)诊断,仅有少数食物通过口服激发试验(oralfoodchallenge,OFC)证实(表1)。即使病史及SPT均提示阳性,食物激发试验也有可能是阴性,Figueroa等[21]的研究纳入24例芥末过敏患者,双盲安慰剂对照食物激发试验(double-blind placebo-controlled food challenge,DBPCFC)阳性的仅有14例(58.3%)。提示花粉相关食物诱发临床症状与个体致敏状态、花粉季节以及症状发生时是否存在过敏加重因素(如运动、感染等)可能相关。
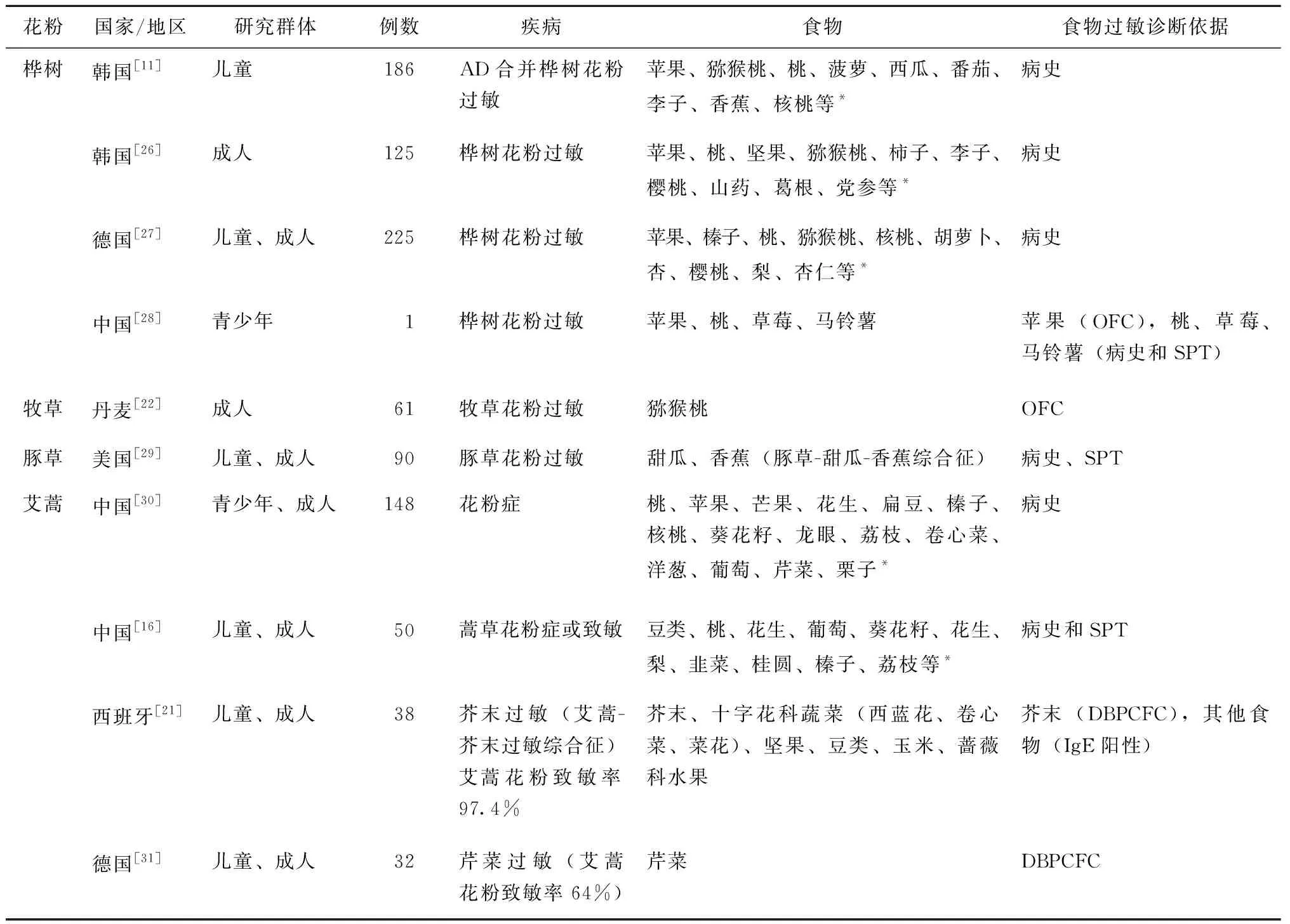
表1 与花粉具有交叉过敏反应的食物Table 1 Foods reported to have cross-reactivity with pollen
PFAS发生与地域花粉地图关系密切,如北欧国家研究显示PFAS主要与桦树花粉致敏相关[22],相比较而言,南欧国家的桦树花粉致敏比例低于北欧,PFAS常与多重花粉致敏相关[23-24],我国研究显示秋季花粉致敏与PFAS更为相关[7]。最近发表的一项日本研究显示,桤木花粉致敏是PFAS发生的高危因素[25]。
由于花粉地域分布以及饮食习惯不同,PFAS诱因亦有不同(表1)。树木花粉中桦树花粉是PFAS的代表性花粉之一,也是北欧与中欧国家与PFAS最为相关的花粉。桦树花粉与很多食物过敏存在广泛的交叉过敏反应,尤其是与蔷薇科水果,如苹果、梨、樱桃、桃、李、杏,苹果是最常见的桦树过敏相关食物过敏原,如苹果-桦树综合征,此外桦树与芹菜、胡萝卜、土豆、猕猴桃、榛子和芒果也存在交叉过敏反应。我国桦树相关PFAS报道不多,多为病例报道和小样本的基础研究。邵洁等报道了1例桦树花粉合并苹果过敏的病例,该病例同时存在桃、草莓、马铃薯等过敏。另有一项来自河北唐山的研究纳入34例桦树花粉的个体,研究发现桦树Bet v 1致敏与大豆Gly m 4和苹果Mal d 1致敏存在明显相关性,提示桦树与苹果、大豆之间的交叉致敏性,但该研究并未提供苹果、大豆食物过敏相关的临床病史,是否存在临床相关性需要进一步验证[32]。除桦树外,日本的研究显示桤木花粉过敏的个体,苹果是PFAS最常见的食物诱因[33],而在柳杉分布地区,西红柿是最常见的诱因[34]。
牧草花粉相关食物过敏仍然存在有争议,研究多来自于欧洲国家,目前国内牧草花粉相关的PFAS研究未见。虽然牧草花粉与多种食物如小麦、玉米、坚果、水果、蔬菜存在广泛交叉致敏,但由于交叉致敏组分主要是交叉反应性糖类决定簇(carbohydrate cross-reactive determinants,CCD)和抑制蛋白(profilin),只有少数食物可以导致临床症状。如丹麦的一项研究显示单一牧草过敏患者中,水果蔬菜SPT阳性率为39%,经OFC证实的临床相关的食物过敏仅有4%[22]。同样来自英国一项出生队列研究显示,在牧草花粉过敏的个体中,78%小麦SPT阳性和40.5%小麦sIgE阳性,而其中只有0.48%经过口服激发试验证实存在真正的小麦过敏[35]。
杂草花粉如蒿属花粉相关PFAS在我国研究较多,文昭明等在国内首次总结了50例蒿属花粉症合并食物过敏的临床特征,提示蒿花粉相关食物过敏最常见的是豆类、桃、花生[16]。邓珊、尹佳等总结了148例蒿花粉相关的食物过敏,最常见为桃、苹果、芒果[30]。国外报道的蒿花粉相关PFAS主要与芹菜、香料、芥末等存在交叉反应,如芹菜-艾蒿-调料综合征、艾蒿-芥末综合征等。国内的研究显示蒿草花粉致敏是蒿草相关食物发生严重过敏反应的高危因素。邓珊、尹佳等的研究显示47%蒿花粉相关食物过敏可表现为严重过敏反应[30],李俊达等的研究30% PFAS表现为严重过敏反应,94%严重过敏反应存在蒿花粉过敏[7]。豚草花粉属于外来入侵花粉,在我国多呈现零散分布,单一豚草花粉过敏较为少见,多与蒿草花粉共同过敏,我国豚草相关PFAS研究未见,国外研究显示豚草与哈密瓜、香蕉、黄瓜、西葫芦、西瓜、甜瓜存在交叉过敏反应,如豚草-甜瓜-香蕉综合征[36-40]。
需要注意的是,花粉相关食物过敏原检测(IgE或SPT)阳性并不一定与临床相关,因此在解读过敏原报告时需要结合临床病史合理解读,必要时通过OFC进行验证[41]。
4 与PFAS相关的过敏原致敏组分
食物过敏原根据致敏途径的不同可分为2类。第Ⅰ类的食物过敏原,通过胃肠道致敏,大多数食物过敏原均属于此类,主要是指鸡蛋、牛奶、花生、坚果、鱼、大豆、小麦和甲壳类,是婴幼儿及儿童常见的主要致敏食物,通常导致系统性反应或严重过敏反应。Ⅱ类食物过敏原通常与植物源性蛋白同源,如花粉过敏原,Ⅱ类食物过敏原通常在青少年期诱发症状且通常诱发过敏反应,多为轻度症状如口腔局部症状,亦可诱发系统性或严重过敏反应[40]。导致PFAS的过敏原致敏组分常见于以下三大蛋白家族,分别为病原相关蛋白10(pathogenesis related protein,PR-10)、抑制蛋白(profilin)、脂质转移蛋白(lipid transfer protein,LTP)[40]。表2显示了导致PFAS的相关过敏原组分。
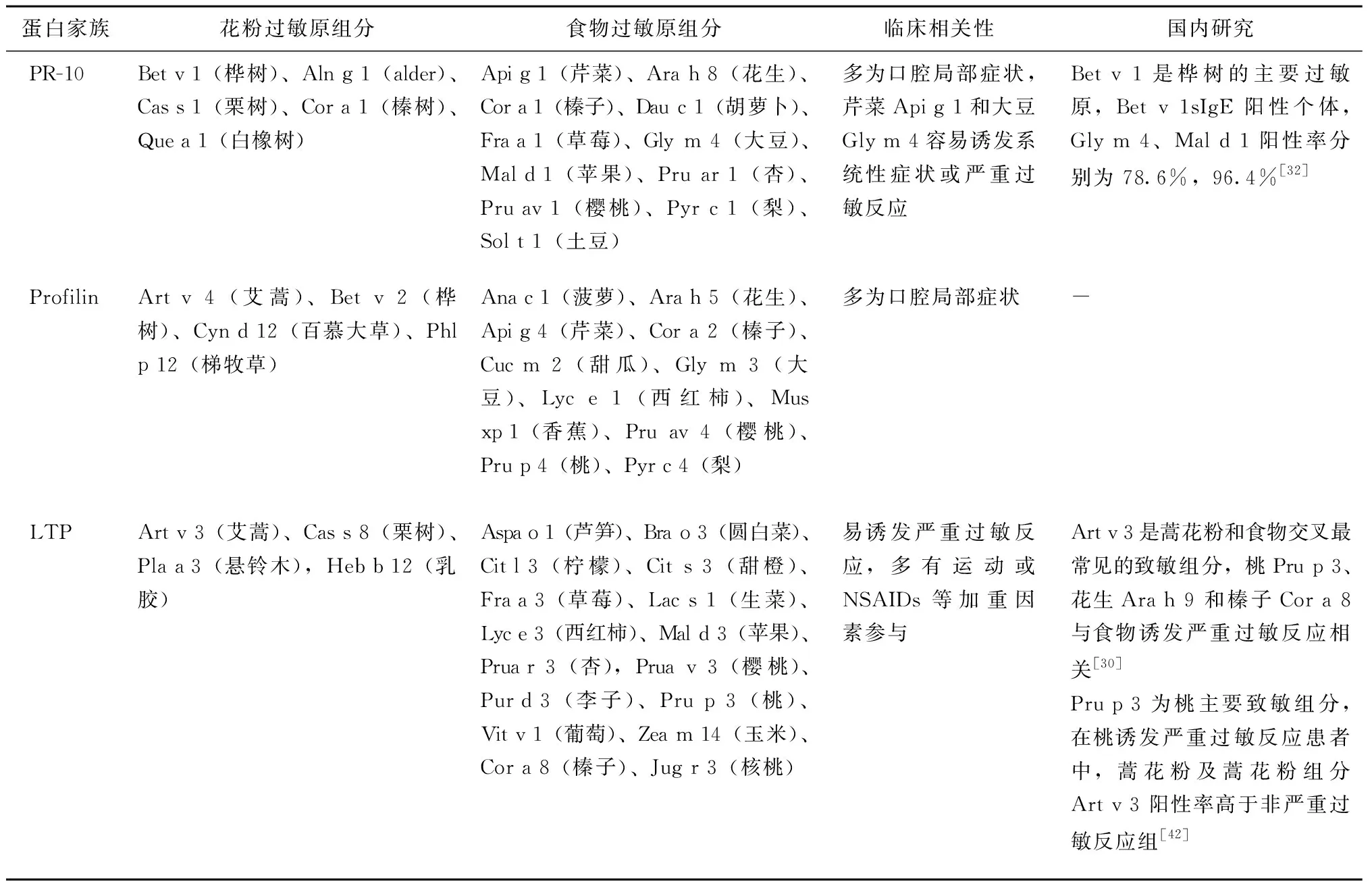
表2 导致PFAS的常见交叉过敏原组分Table 2 Commoncross-reactive allergens causing PFAS
4.1 病原相关蛋白10
病原相关蛋白10(pathogenesis related protein,PR-10)是最具代表性的PFAS的交叉致敏反应的组分。PR-10存在于绝大多数的食物中,桦树最主要的致敏组分Bet v 1属于此家族。苹果Mal d 1,杏 Pru ar 1,樱桃 Pru av 1均属于此家族,是桦树与蔷薇科水果交叉反应的基础[3,36,40]。Bet v 1热不稳定,且容易被消化酶处理后丧失变应原性,因此通常导致口腔局部的症状。但是PR-10家族中芹菜的主要致敏组分Api g 1是强耐热的过敏原组分,Gly m 4是大豆主要致敏组分,强耐热但不耐受发酵[31,43-45]。因此对芹菜Api g 1和大豆Gly m 4过敏的个体易发生系统性症状。芹菜和大豆过敏一半以上的患者表现为系统性的表现,包括严重过敏反应。
4.2 抑制蛋白
抑制蛋白(profilin)是肌动蛋白结合蛋白,也在植物中广泛存在。桦树Bet v 2,艾蒿 Art v 4和芹菜Api g 4均属于该家族[3,36,40]。芹菜-桦树/艾蒿-调料,牧草-芹菜-胡萝卜,树花粉-榛子之间的交叉反应由抑制蛋白引起[31,46]。同Bet v 1类似,抑制蛋白不耐热,不耐消化酶[3],进食生的食物通常导致口腔局部症状。
4.3 脂质转移蛋白
脂质转移蛋白(lipid transfer protein,LTP)是属于PR-14家族。包括艾蒿Art v 3、桃Pru p 3,杏Pru ar 3,樱桃Pru av 3和苹果Mal d 3[3,40]。不同于其他导致PFAS相关过敏原致敏组分,LTP是耐热和耐消化酶的组分[15,47]。由于耐消化酶,LTP可到达胃肠道诱发局部免疫反应,进而致敏机体并诱发系统性症状。因此,LTP易诱发重症全身多系统性反应,如全身荨麻疹、呼吸困难,甚至严重过敏反应[48-49]。国内研究显示Art v 3是蒿花粉和食物交叉最常见的致敏组分,桃Pru p 3、花生Ara h 9和榛子Cor a 8与食物诱发严重过敏反应相关[30]。LTP诱发的严重过敏反应通常有运动以及非甾体类抗炎药(non-steroidal anti-inflammatory drugs,NSAIDs)等加重因素的参与[50]。欧洲一项研究显示食物依赖NSAID诱发的超敏反应(food dependent NSAID-induced hypersensitivity reactions,FDNIH)最常见的致敏食物过敏原组分为桃的LTP组分Pru p 3[51]。
5 PFAS的类型
基于以上三种交叉致敏组分检测可将PFAS分为5种类型[52]:(1)抑制蛋白相关的PFAS(profilin PFAS endotype),主要由抑制蛋白致敏所致,葫芦科植物过敏多见;(2)LTP相关PFAS(LTP PFAS endotype),主要由于LTP致敏所致,欧洲的研究显示榛子和花生过敏多见,我国的研究显示桃过敏多见[30];(3)PR-10相关PFAS,主要由于PR-10致敏所致,蔷薇科植物过敏多见;(4)多重泛变应原致敏相关PFAS(multi-panallergen PFAS endotype),由2种以上泛变应原致敏所致,表现为多种食物过敏;(5)无泛变应原致敏的PFAS,未检测到泛变应原致敏,主要由猕猴桃诱发。以上五种类型临床表现不一,并具有特定的致敏模式,基于此可实现PFAS的精准诊断。但是需要注意的是,约25%的患者并未表现出对3种泛变应原的致敏,因此需要进一步的研究来探索更多的参与PFAS的交叉致敏组分。
6 诊断
病史是PFAS诊断的基石。目前尚无明确的诊断标准,一般需要满足以下条件:(1)进食水果、坚果、蔬菜后5~10 min内出现PFAS的相关症状(如口腔黏膜症状、呼吸道及胃肠道症状、甚至严重过敏反应);(2)同时有食物和花粉机体致敏的证据(可通过sIgE或皮肤点刺试验(skin-prick test,SPT)证实);(3)食物诱因与致敏花粉存在交叉反应。商品化的食物SPT因制备工艺可能产生蛋白降解,可能存在低敏感性和低特异性。因此,相对于使用商品化试剂进行SPT,点对点皮肤点刺(prick-to-prick)具有更高的敏感性及特异性[53-54]。因花粉和食物存在的交叉反应,sIgE检测灵敏性较强而特异性较差,如在一项纳入69例蒿花粉过敏患者的研究中,有38例患者对桃过敏,另有21例患者对桃致敏而非过敏(即sIgE阳性,但食用桃后无过敏症状)[30]。因此,若sIgE检测提示蒿花粉、桃sIgE同时阳性,但患者进食桃后并无不适,需考虑桃sIgE阳性是由于蒿花粉导致的交叉致敏,并不是真正的桃过敏[30]。sIgE检测结果需要专科医师结合临床病史进行正确解读[41]。过敏原组分解析诊断(component resolved diagnosis,CRD)也可应用于临床诊断,某些过敏原组分尤其是LTP可预测严重过敏反应风险,如Pru p 3、Cor a 8[30,45]。若临床病史与过敏原相关检测不一致,必要时可采取食物口服激发试验证实。
7 治疗和长程管理
最主要的治疗是致敏食物的避免,尤其是对于诱发严重过敏反应的食物需要严格规避[55]。实际上对于PFAS相关食物过敏反应是否需要规避食物仍存在争议。一项对美国专科医师的调查研究显示53%变态反应专科医师建议避免过敏食物,9%专科医师不建议避食,38%专科医师建议需要根据患者情况提出个体化建议[15]。由于PFAS相关的过敏原致敏组分通常不耐热,因此进食前加热致敏食物可降低过敏几率[2,56-57]。但是对于耐热的LTP家族以及PR-10家族芹菜Api g 1和大豆Gly m 4所致系统性症状或严重过敏反应症状,进食仍需谨慎。需要注意的是,花生的某些过敏原致敏组分,如Ara h 1和Ara h 2,加热后变应原性会增加[2]。
症状发作急性期治疗,PFAS相关的食物过敏症状通常轻微且多可自行缓解,出现轻度症状可口服抗组胺药物治疗。对于PFAS表现为严重过敏反应患者,是否处方肾上腺素自动注射装置(EAI)仍意见不一。如美国70%变态反应专科医生会为PFAS患者处方EAI,而英国的一项调查显示18%的变态反应专科医生从未为PFAS患者处方EAI。考虑处方EAI的情况包括:哮喘病史、症状累及下呼吸道、合并咽喉部症状、颜面部水肿及全身荨麻疹[15,58]。
关于长程管理,特异性免疫治疗(specific immunotherapy,SIT)在PFAS的治疗中仍存在争议。有研究显示在花粉SIT后食物过敏的症状会有所改善,如经桦树花粉SIT后,84%苹果过敏症状会减轻或消失,但在SIT结束后30个月,大部分患者出现了症状反复[57,59]。而在另外一些SIT研究中并未显示SIT治疗对PFAS症状改善[60-63]。近期的一例病例报道提示奥马珠单抗联合特异性免疫治疗可减轻PFAS的症状[64]。基于病史和CRD可对PFAS进行诊断和管理。图1示PFAS诊断和治疗流程。
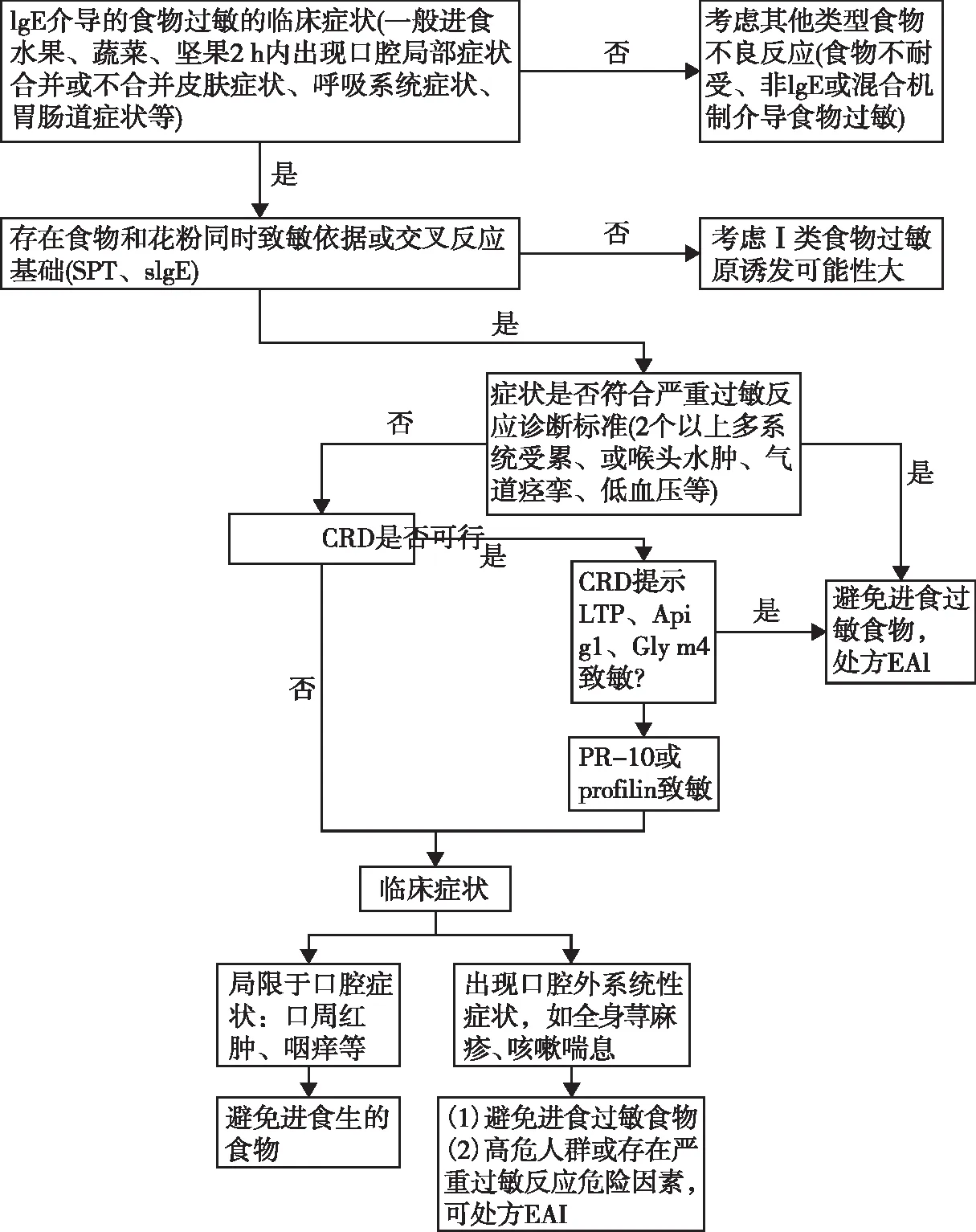
图1 PFAS诊断和治疗流程Fig 1 Flowchart of treatment and diagnosis of PFASSPT:皮肤点刺试验;sIgE:特异性IgE;CRD:过敏原组分解析诊断;LTP:脂质转移蛋白;PR-10:病原相关蛋白10;EAI:肾上腺素自动注射装置
综上所述,PFAS是花粉过敏的常见的合并症,也是青少年及成人最常见食物过敏类型,近年来有低龄化趋势。过敏原组分解析诊断(component resolved diagnosis,CRD)和新鲜食物皮肤点刺试验是常用的诊断方法,LTP致敏个体通常表现为多系统症状,PFAS临床表现为严重过敏反应的患者建议处方肾上腺素自动注射装置(epinephrine auto-injector,EAI)。目前国内PFAS未被充分认识,CRD在国内也未广泛应用于临床,因此PFAS可能存在诊断不足,EAI在国内尚不可及。花粉特异性免疫治疗在PFAS仍存在争议,生物治疗联合特异性免疫治疗对PFAS是否有效尚需更大样本的临床研究证实。

