不同制备条件对蒙古栎人工林地表可燃物生物炭理化性质的影响1)
张瑞杰 杨光 叶东明 李裕铃 李锦营 王立轩 朱漓江 于宏洲
(东北林业大学,哈尔滨,150040)
当极端高温天气和干旱共同驱动时,全球森林火灾的发生频率、燃烧面积将会持续上涨,对全球生态安全产生日益严重的威胁[1]。北方森林受林火影响尤为显著,在当前火灾发生频率和严重程度愈演愈烈的环境下,探索森林地表可燃物的科学管理与综合利用,对降低森林火灾发生频率、致灾风险及提升森林碳汇效益有着重要的意义。
森林地表可燃物作为林火发生的活跃物质基础,是易于人为控制以及客观评价森林防火有效性的重要燃烧要素[2]。我国东北地区拥有丰富的森林可燃物资源,探索该地区森林地表可燃物的管理与综合利用,对降低森林火险、致灾风险尤为重要。目前,调控森林地表可燃物主要采用有机械清除[3]、计划烧除[3-4]、生物降解[5]等方法。均难以有效利用可燃物资源,同时存在实施成本高、安全风险大等不足[6]。以森林地表可燃物制备生物炭是其转化再利用以及调控其载量的新途径。
生物炭是生物质在限氧条件时,经高温热解后所得的固态物质[7],其为一种含碳量高、吸附能力强、多孔性的碳材料,在固碳、改善土壤肥力以及作为一种修复剂等方面被广泛关注[8]。生物炭理化性质取决于其制备条件,同一炭化时间,不同热解温度的生物炭理化性质不同[9]。其最佳热解温度范围为300~700 ℃。当温度低于300 ℃时,生物炭热解不完全;当温度高于700 ℃时,生物炭微晶结构破坏[10]。生物炭各理化性质均与热解温度、炭化时间的变化高度相关[11]。热解温度升高时,原材料分解,生物炭产率随之降低[12],由于原材料无机盐离子等物质随热解沉积,故生物炭灰分质量分数升高。生物炭元素质量分数随热解温度的变化呈明显变化趋势,随生物炭炭化程度升高,碳元素质量分数显著增加,而H、O、N等元素的质量分数随之降低[13]。生物炭pH、EC(电导率)、CEC(阳离子交换量)等化学性质随温度的升高发生明显变化,其中热解原料为酸性,热解过程中纤维素、半纤维素、木质素等分解,生物炭pH随之变为碱性[14];生物炭速效养分、官能团变化随热解温度变化显著。
目前国内对以森林地表可燃物制备生物炭的研究仍处于起步阶段,国外研究也同样较少。目前大多数生物炭的制备材料为木屑、秸秆等农林业废弃物以及城市固体垃圾、粪便[15-16]。同样,大部分对生物炭理化性质的研究仅限于化学性质、元素质量分数、产率等方面,而对其速效养分、电导率、官能团等变化及原理的研究相对较少[17]。
本研究以蒙古栎新鲜地表可燃物为原材料制备生物炭。从生物炭的产率、灰分质量分数、元素组成、官能团以及速效养分质量分数等方面,阐释不同制备温度以及不同炭化时间时,生物炭理化性质的变化趋势。本研究结果可为森林地表可燃物再利用、降低森林火险提供科学依据。
1 材料与方法
样品采集与处理:蒙古栎的新鲜地表可燃物样品来自帽儿山实验林场(45°2′20″~45°18′16″N,127°18′~127°41′6″E)。样品自然风干,在105 ℃时烘干至恒质量,经研磨机粉碎、过60目筛后备用。
生物炭的制备:将待用样品填入坩埚内,装满压实,加盖后紧裹3层锡箔纸,使加热环境趋近无氧。将其置于马弗炉内,在3个时间梯度(1、2、3 h)、5个温度梯度(300、400、500、600、700 ℃)时分别热解,待炉内冷却至室温后取出,得到生物炭产品。
生物炭产率的测定:生物炭产率(α0,%)如式(1)。
α0=(m1/m0)×100%。
(1)
式中:m1为生物炭质量(g);m0为蒙古栎地表可燃物原料干质量(g)。
生物炭灰分质量分数采用干灰化法测定:称取5 g生物炭样品置于灼烧至恒质量的坩埚中,升温至800 ℃,使完全灰化并至恒质量,减去坩埚质量即为灰分质量,每个样品均做3次重复取平均值。灰分质量分数用Ash(%)表示。
Ash=[(m4-m2)/(m3-m1)]×100%。
(2)
式中:m2为坩埚质量(g);m3为坩埚和生物炭的质量(g);m4为坩埚和蒙古栎地表可燃物样品的总质量(g)。
生物炭去除灰分(净)产率的测定(α%)如式(3)。
α1=[(m1×(1-A))/m0]×100%。
(3)
式中:A为灰分质量分数(%)。
生物炭C、H、O、N元素的质量分数使用德国元素埃德蒙塔元素分析仪测定。
生物炭不可溶有机碳质量分数测定:将生物炭样品浸入足量的1 mol·L-1盐酸中,待不产生气泡后,于105 ℃烘干至恒质量,测定其碳的质量分数,与原生物炭质量的比值即为生物炭总不可溶有机碳质量分数。
生物炭中稳定性碳的质量分数采用重铬酸钾氧化法测定:将1 g生物炭样品加入到0.1 mol·L-1的K2Cr2O7与2 mol·L-1的H2SO4混合溶液(10 mL)中摇匀,60 ℃水浴加热6 h。氧化结束后,离心(5 000 r·min-1,30 min)去除上清液。残余固体物质加入50 mL去离子水,离心,弃去上清液,重复3次以洗去残余的重铬酸钾溶液。60 ℃烘干24 h。待样品恒质量后,称其质量并测定余下生物炭碳样品的质量,与生物炭原质量的比值即为生物炭稳定性碳质量分数。
生物炭pH测定参照GB/T 12496.7-1999《木质活性炭实验方法pH值的测定》:分别称取2.5 g生物炭(过20目筛后的样品)置于100 mL的锥形瓶中,在1 g生物炭、20 mL溶液中加入50 mL不含二氧化碳的水,加热至沸腾5 min。在此期间补添蒸发的水,过滤,弃去初滤液5 mL,余液冷却至室温后,使用pH计测定其pH。
生物炭电导率(EC)测定使用电导率仪测定pH余液电导率。
生物炭阳离子交换量的(CEC)测定参照HJ 889-2017《三氯化六氨合钴浸提-分光光度计法》:称取0.5 g干燥的碳材料样品,置于50 mL离心管中,加入1.66 mol·L-1的Co(NH3)6Cl3标准溶液(20 mL)。拧紧瓶盖后置于摇床内,在20 ℃的温度时振荡60 min,调节摇床的振荡频率,使混合物在振荡过程中保持悬浮状态。结束振荡后,以4 000 r·min-1离心10 min,收集其上清液于比色管内,在24 h内完成比色分析。
计算公式如下:
CEC=(A0-A×3×V)/(b×m)。
(4)
式中:CEC为生物炭阳离子交换量(mol·kg-1);A0为空白样吸光度;A为待测试样吸光度;V为浸取液体积(mL);b为吸光度标准曲线的斜率;m为生物炭质量(g)。
生物炭铵氮、硝氮质量分数:称取5 g冷冻新鲜样品于锥形瓶中,按照样品质量溶液体积比为1∶10加入浓度为2 mol·L-1的KCl浸提液50 mL。在摇床上摇1 h后,过滤得无机氮浸出液,采用Smartchem 200全自动间断化学分析仪测定生物炭中铵氮、硝氮的质量分数。
生物炭速效磷的测定参照LY/T 1232-2015《森林土壤磷的测定》:取生物炭1 g,加入浓度为0.5 mol·L-1的碳酸氢钠溶液(pH为8.5)20 mL。于室温内,以160 r·min-1震荡30 min后过滤,滤液采用钼锑抗比色法测量速效磷浓度。并将所得数值换算为干质量的磷质量分数。
生物炭官能团分析方法:采用傅里叶变换红外光谱法对生物质炭官能团进行表征,采用KBr固体压片法,在扫描波数4 000~400 cm-1、分辨率4 cm-1条件时进行扫描。
所有数据均为3次重复的平均值,使用SPSS 27.0软件进行单因素方差分析并进行差异显著性比较(LSD)。
2 结果与分析
2.1 不同制备条件时生物炭产率与灰分变化
表1为不同制备条件的生物炭产率、净产率。由表1可知,蒙古栎生物炭的产率、净产率整体随温度增长呈下降趋势;加热炭化时间对生物炭产率无显著影响。除了炭化时间为1、2 h,温度为300 ℃时的生物炭产率差异不显著外,其余组间均存在显著差异(p<0.05);净产率在不同温度、不同炭化时间时存在显著差异(p<0.05)。炭化时间为2 h、温度为300 ℃时,生物炭产率最高(56.7%);炭化时间为3 h、温度为700 ℃时,生物炭产率最低(33.0%)。炭化时间为2 h、温度为300 ℃时,净产率最高(48.9%);炭化时间为3 h、温度为700 ℃时,净产率最低(24.7%),两者相差24.2%。温度从300 ℃升高到400 ℃时,生物炭产率、净产率均大幅降低;当温度达到400 ℃后,下降幅度趋于平稳。本研究中,蒙古栎生物炭热解产率随温度升高而降低,热解温度300~500 ℃降低显著,500~700 ℃降低缓慢。其主要原因为热解温度300~500 ℃,蒙古栎叶片中纤维素、半纤维素、木质素炭化分解,500 ℃后,纤维素、半纤维素、木质素分解完全[18],随温度升高,部分高沸点物质逐步分解并生成稳定的芳香性物质[19]。炭化时间对生物炭产率无显著影响[20]。
表2为不同制备条件的生物炭灰分质量分数。其中蒙古栎地表凋落物所产生灰分为7.657%。由表2可知,蒙古栎生物炭灰分组间均存在显著差异(p<0.05),且随温度升高呈上升趋势。除了300、700 ℃温度的生物炭灰分质量分数随炭化时间增长而增长外,其余温度的生物炭灰分质量分数随炭化时间增长无明显变化。炭化时间为2 h、温度为600 ℃时,生物炭灰分质量分数最大(27.422%);炭化时间为1 h、温度为300 ℃时,生物炭灰分质量分数最小(13.722%)。蒙古栎生物炭灰分质量分数随热解温度升高而升高[21],400~600 ℃时生物炭灰分质量分数增势较快[22]。其原因为蒙古栎叶片存在无机矿质元素,如钾、钙、钠、镁、硅、碳酸盐等难挥发组分[23]。
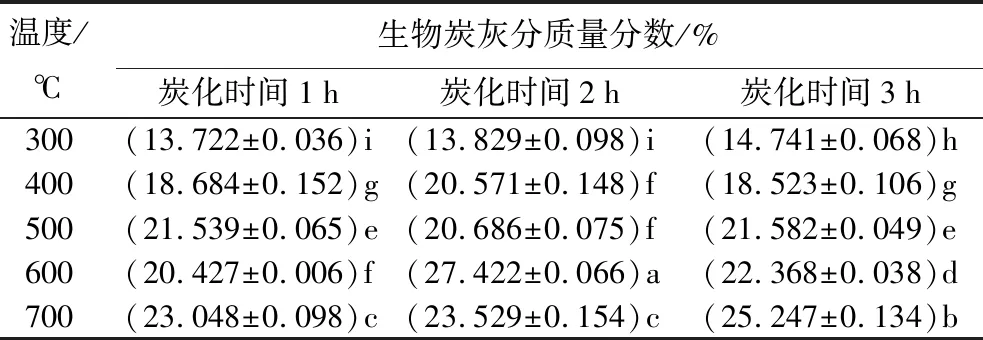
表2 不同制备条件的生物炭灰分质量分数
2.2 不同制备条件时生物炭元素质量分数的变化
表3为不同制备条件时,生物炭的碳质量分数。其中生物质原料的碳质量分数为45.3%。炭化时间为1 h时,蒙古栎生物炭的碳质量分数随温度升高呈先上升再下降趋势;炭化时间为2 h时,其随温度升高呈先上升后下降再上升趋势;炭化时间为3 h时,生物炭的碳质量分数随温度升高无显著变化趋势。温度为300 ℃时,生物炭的碳质量分数随炭化时间增长而增加;温度为400 ℃时,生物炭的碳质量分数随炭化时间增长而减少,其余温度随炭化时间的增长无显著变化。制备条件为炭化时间3 h、温度600 ℃时,碳质量分数达到最高(68.618%)。炭化时间3 h、温度400 ℃时,碳质量分数达到最低(59.417%)。本研究中,炭化时间1 h时,生物炭碳质量分数均存在先升高后降低趋势;600~700 ℃存在下降趋势[24],总体约在60%以上[25],其随温度升高蒙古栎叶片炭化程度加强。

表3 不同制备条件时生物炭的碳质量分数
表4为不同制备条件时,生物炭的氮质量分数。其中生物质原料的氮质量分数为0.98%。除了炭化时间为1 h,温度为300、500 ℃以及温度为700 ℃,炭化时间为1、2、3 h外,蒙古栎生物炭的氮质量分数组间均存在显著差异(p<0.05)。炭化时间一定时,生物炭的氮质量分数随温度升高呈先上升后下降趋势。温度为700 ℃时,生物炭的氮质量分数随炭化时间增长而减小;温度为600 ℃时,生物炭的氮质量分数随炭化时间增长无显著变化;其余温度随炭化时间增长而增加。炭化时间为3 h、温度为400 ℃时,氮的质量分数最高(2.186%);炭化时间为3 h、温度为700 ℃时,氮的质量分数最低(1.114%)。生物炭氮质量分数随温度升高呈先升高后降低趋势。500 ℃后保持不变,同时炭化时间对生物炭氮质量分数无显著影响。研究表明,500 ℃后其氮质量分数保持不变的原因是氮进入了耐低温且不易挥发的复杂结构中[26],以杂环形式存在[27]。
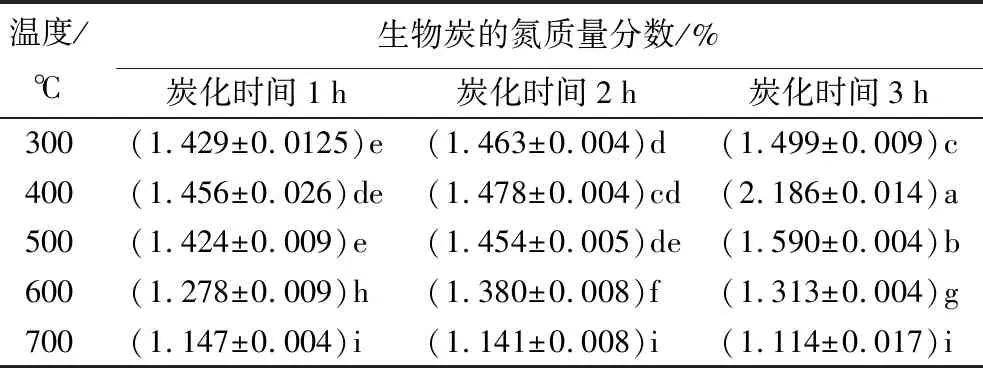
表4 不同制备条件时生物炭的氮质量分数
表5为不同制备条件时,生物炭的氧、氢质量分数。其中生物质原料的氧氢元素质量分数分别为40.896%、5.170%。由表5可知,蒙古栎生物炭的氧质量分数随热解温度升高整体呈降低趋势;温度为300、500、700 ℃的生物炭氧质量分数随温度升高而显著降低。炭化时间为1 h、温度为300 ℃时,氧的质量分数最高(20.964%);炭化时间为3 h、温度为700 ℃时,氧的质量分数最低(5.583%)。蒙古栎生物炭的氢质量分数组间均存在显著差异(p<0.05)。生物炭的氢质量分数随温度升高呈显著降低趋势。温度为300、600、700 ℃时,生物炭的氢质量分数随炭化时间增长而下降;炭化时间为1 h、温度为300 ℃时,生物炭的氢质量分数达到最大值(4.204%);炭化时间为3 h、温度为700 ℃时,生物炭的氢质量分数达到最小值(1.021%)。氧、氢质量分数随热解温度升高呈下降趋势。其主要原因是蒙古栎干叶中纤维素、半纤维素、木质素等物质脱羟反应,其中的羟基、酯基、酚羟基等酸性基团逐渐减少,随温度升高反应完全[24]。
2.3 不同制备条件时生物炭碳组分质量分数的变化
表6为不同制备条件时,生物炭的不溶性总有机碳质量分数。除温度为700 ℃,炭化时间为1、2、3 h外,蒙古栎生物炭的不溶性总有机碳质量分数组间存在显著差异(p<0.05)。炭化时间为1 h时,蒙古栎生物炭的不溶性总有机碳质量分数随温度升高呈先下降再上升后下降趋势;炭化时间为3 h时,生物炭的不溶性总有机碳质量分数随温度升高呈先升高后降低趋势;炭化时间为2 h时,其随温度升高无显著变化。炭化时间为2 h、温度为300 ℃时,生物炭的不溶性总有机碳质量分数为最大值(52.930%);炭化时间为3 h、温度为300 ℃时,生物炭的不溶性总有机碳质量分数为最小值(36.844%)。蒙古栎生物炭不溶性总有机碳受热解温度影响更大,且温度在600 ℃后呈下降趋势,炭化时间对生物炭理化性质变化无显著影响[28]。
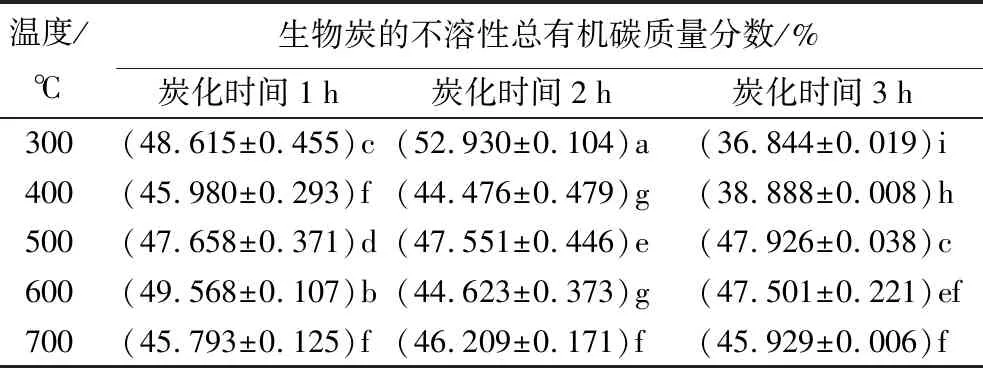
表6 不同制备条件时生物炭的不溶性总有机碳质量分数
表7为不同制备条件时,生物炭的稳定性碳质量分数。其中生物质原料中稳定性碳质量分数为11.06%。除了温度为700 ℃,温度为600 ℃、炭化时间为2 h以及温度为500 ℃,炭化时间为1、3 h外,生物炭的稳定性碳质量分数组间存在显著差异(p<0.05)。随热解温度开始到400 ℃时,生物炭稳定性碳质量分数随炭化时间、热解温度增长而升高,温度达到500 ℃后增长趋于稳定;温度为300 ℃时,生物炭的稳定性碳质量分数随炭化时间增长而显著增加。温度为300 ℃、炭化时间为1 h时,生物炭的稳定性碳质量分数最低(23.255%)。温度为600 ℃、炭化时间为3 h时,生物炭的稳定性碳质量分数最高(45.177%)。本研究中,稳定性碳随热解温度升高呈先升高后降低趋势,其主要原因是高温制备生物炭稳定性高[29]。600~700 ℃稳定性碳组分下降,其原因是生物炭有机组分与难熔晶体矿物相结合形成有机-无机复合体[30];或在较高温度时,部分稳定性碳组分发生轻微氧化,造成部分稳定性碳组分的损失,导致其比例下降[29,31]。
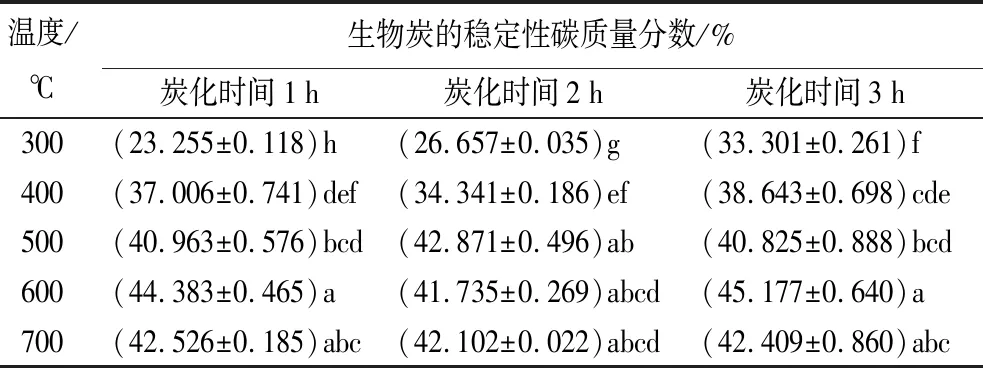
表7 不同制备条件时生物炭的稳定性碳质量分数
2.4 不同制备条件时生物炭化学性质的变化
表8为不同制备条件时,生物炭的pH。蒙古栎生物炭的pH随热解温度增长显著升高(p<0.05),当温度达到500 ℃后增长趋于平稳;在温度为400 ℃时,生物炭的pH随炭化时间增长显著降低;在温度为700 ℃时,生物炭的pH随炭化时间增长呈升高趋势;其余温度时,无显著差异。对照组的pH为5.574,显酸性,而生物炭的pH均为碱性。当炭化时间为3 h,温度700 ℃时,生物炭的pH达到最高值(11.142),温度300 ℃时,生物炭的pH达到最低值(7.502)。同时生物炭的pH随灰分质量分数的升高而增大,灰分与pH间拟合直线存在良好线性关系(R2=0.908,图1)。本研究中蒙古栎生物炭pH随热解温度升高而升高并均为碱性[32],明显高于原料,热解时间对生物炭pH无显著影响[24]。其主要原因是随热解温度升高蒙古栎叶片中酸性挥发物分解和生物炭碳酸盐、结晶碳酸盐质量分数增加所致[7]。同时,生物炭碱性在300~500 ℃变化显著,500~700 ℃变化不显著。其原因是生物炭中K、Na、Ca、Mg等物质的碳酸盐在500~700 ℃生成减少且该温度下生物炭产率变化幅度减小导致[33-34]。
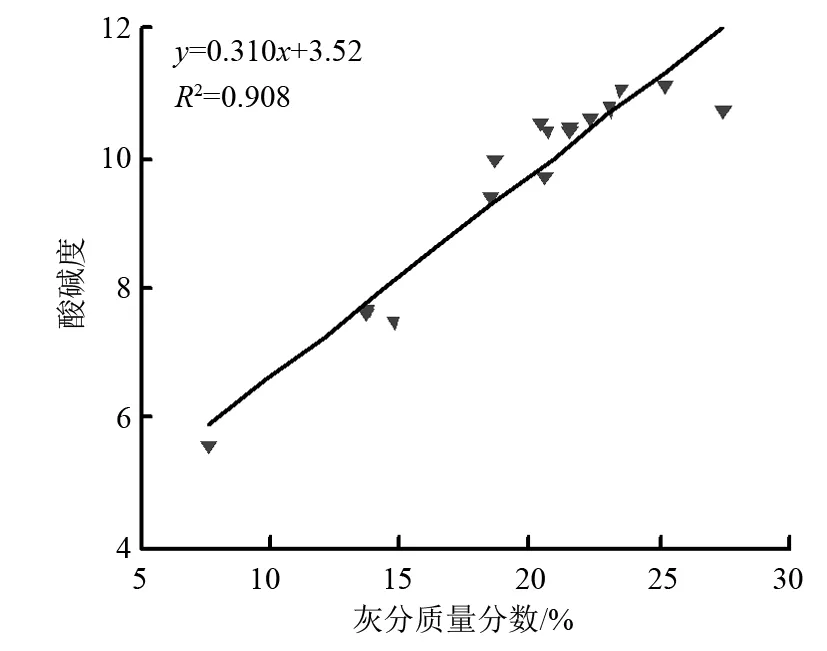
图1 不同制备条件时生物炭灰分与pH的拟合结果

表8 不同制备条件时生物炭的pH
表9为不同制备条件时,生物炭的电导率。生物质原料电导率为5 674.43 us·cm-1。生物炭电导率组间差异显著(p<0.05)。与对照组相比,热解后生物炭电导率降低显著,但随温度升高呈缓慢上升趋势。除了炭化时间1 h、温度600 ℃外,生物炭电导率组间无显著差异。加热时间对生物炭电导率无显著影响。生物炭电导率主要反应生物炭水溶性盐浓度的化学量。制备温度、时间对蒙古栎生物炭存在显著差异,同时热解后生物炭电导率(EC)随温度升高呈上升趋势,反映出生物炭水溶性总盐质量分数随热解温度升高显著上升。
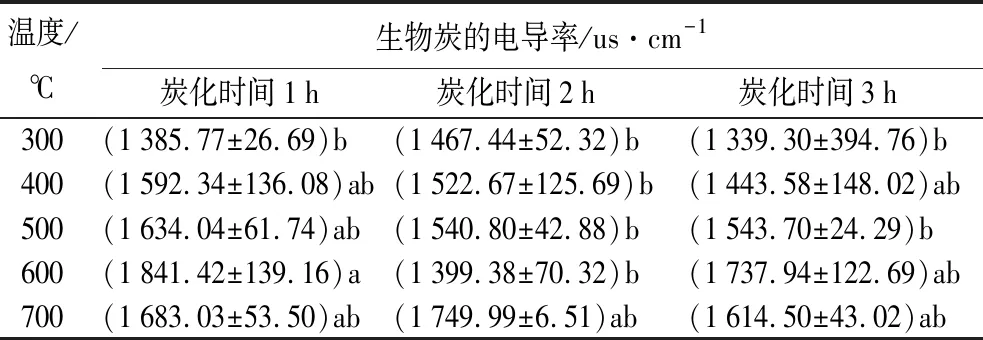
表9 不同制备条件时生物炭的电导率
表10为不同制备条件时,生物炭的阳离子交换量。温度为300~400 ℃时,生物炭的阳离子交换量随温度升高而显著升高;温度为400~500 ℃时,生物炭的阳离子交换量随温度升高而显著降低;当温度达到500 ℃后,其随温度升高而小幅度下降。温度为400 ℃、炭化时间为3 h时,生物炭的阳离子交换量出现最大值(0.143 1 mol·kg-1)。温度为300 ℃、炭化时间为3 h时,生物炭的阳离子交换量出现最小值(0.027 5 mol·kg-1)。本研究中蒙古栎生物炭阳离子交换量(CEC)在300 ℃显著升高,400~500 ℃随温度升高显著降低,500 ℃后随温度升高而平缓下降。生物炭阳离子交换量升高主要与表面含氧官能团和灰分质量分数变化有关[35];500 ℃后生物炭阳离子交换量降低,其主要与生物炭芳香性结构产生有关[36]。

表10 不同制备条件时生物炭的阳离子交换量
2.5 不同制备条件时生物炭速效养分的变化

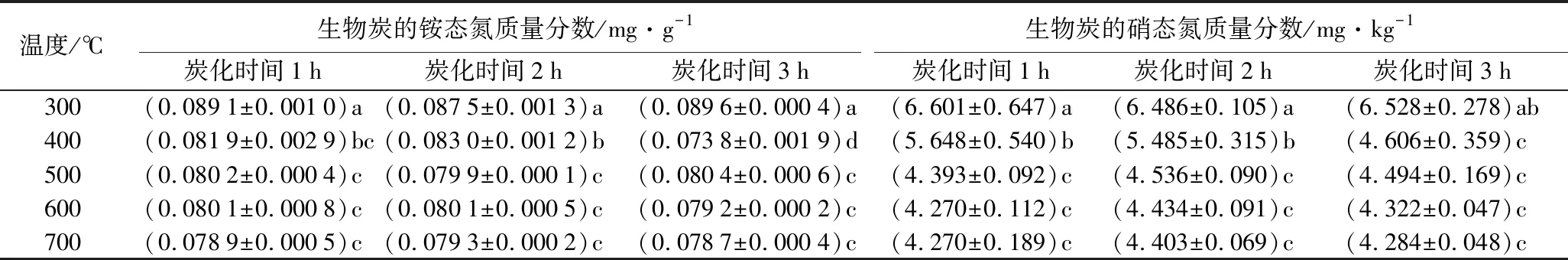
表11 不同制备条件时生物炭的铵态氮、硝态氮质量分数
表12为不同制备条件时,生物炭的速效磷质量分数。生物质中速效磷质量分数为0.186 5 mg·g-1。蒙古栎生物炭的速效磷质量分数随温度升高呈先升高后下降趋势(p<0.05)。热解开始速效磷质量分数随热解温度升高而降低,300~500 ℃反之;温度为500~700 ℃时,生物炭的速效磷质量分数随热解温度升高而降低。温度为500、700 ℃时,速效磷质量分数随炭化时间增加显著降低。温度为500 ℃、炭化时间为1 h时,速效磷的质量分数最高(0.266 7 mg·g-1);温度为700 ℃、炭化时间为3 h时,速效磷的质量分数最低(0.128 5 mg·g-1)。生物炭速效磷质量分数随热解温度升高呈先升高后降低趋势,于500 ℃最高,其质量分数与炭化时间无关。
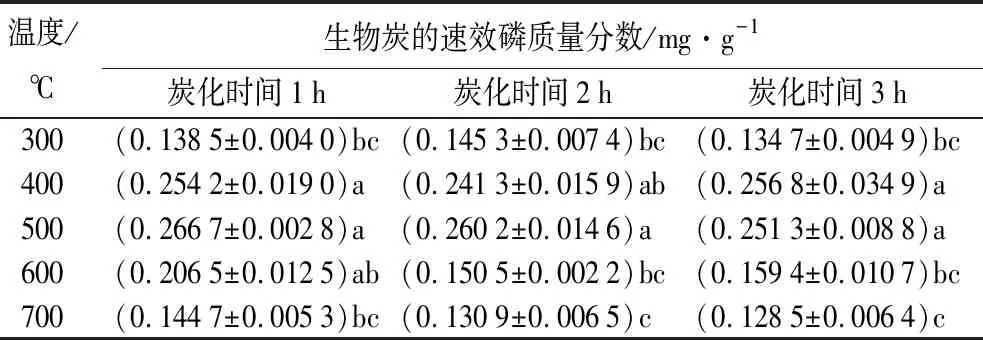
表12 不同制备条件时生物炭的速效磷质量分数
2.6 不同制备条件时生物炭的化学官能团构成的变化
由图2可知,蒙古栎生物炭的O—H(3 390~3 429 cm-1)为醇、酚—OH伸缩震动,在炭化时间一定时,均随温度升高而降低;生物炭—CH2—的C—H吸收峰范围为2 916~2 927 cm-1,300 ℃后均随热解温度升高逐渐消失。生物炭C—O—C吸收峰范围为1 056~1 100 cm-1,其峰值在炭化时间为1h时,随热解温度升高呈先升高后降低趋势(图2a);在炭化时间为2、3 h时,随热解温度升高呈升高趋势(图2b、c)。生物炭CC吸收峰范围为1 603~1 624 cm-1,在炭化时间为1、2 h时,峰值随热解温度升高先升高后降低,于600 ℃后趋于平稳(图2a、b);在炭化时间为3 h时,其峰值随热解温度升高而降低(图2c)。生物炭—COOH(1 650~1 740 cm-1)开始热解后消失,随炭化时间无明显变化;Si—O—Si(790~800 cm-1)在热解温度为300~400 ℃时,有明显伸缩振动,其余温度均无伸缩振动现象。综上所述,随炭化时间增加,各吸收峰峰值和各基团伸缩振动频率减小。
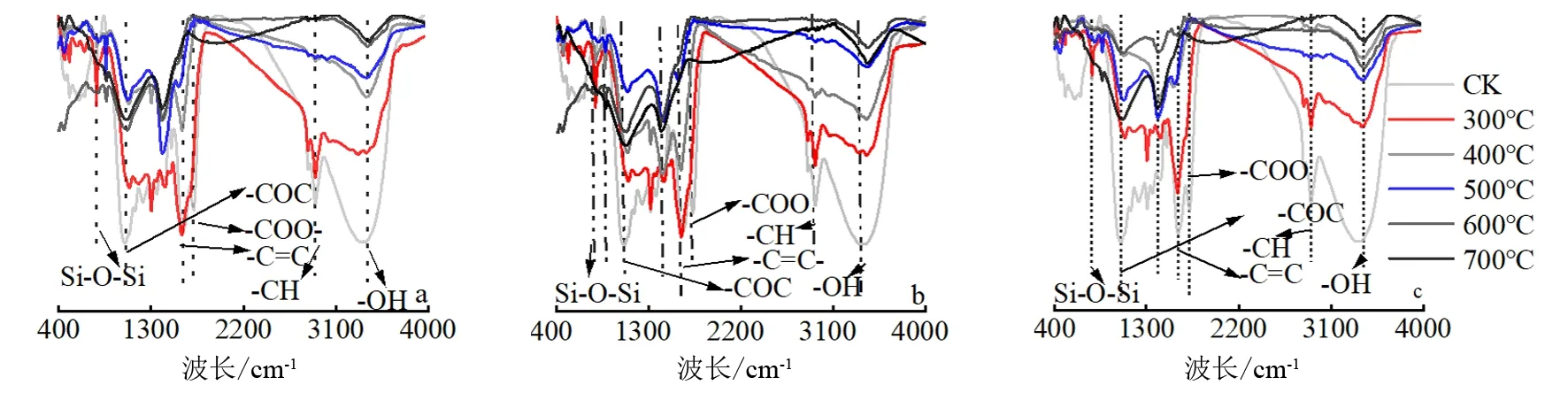
(a)炭化时间1 h;(b)炭化时间2 h;(c)炭化时间3 h。
热解温度对生物炭理化性质产生显著影响[37]。蒙古栎生物炭中羟基随温度升高而逐渐消失,其原因是蒙古栎叶片中纤维素、半纤维素、木质素等有机质随温度升高而分解并释放其—OH[26]。同时,随热解温度升高,C—H键伸缩振动减小并在400 ℃后消失,主要原因是随温度升高,生物炭—CH2—中的C—H键断裂,400 ℃后生成稳定的芳香型化合物,木质素发生去甲基化和脱水[38]。C—O—C、CC伸缩振动也随温度升高先增加后减小。原因是蒙古栎叶片中纤维素、半纤维素、木质素分解过程存在中间产物[39]。同时,生物炭—COO键随温度升高而消失,其原因与—OH消失机理相同[37]。Si—O—Si在300~400 ℃有明显吸收峰,其余温度均无伸缩振动变化[40],因为其是蒙古栎叶片化学结构的主要成分。有研究表明此部分为吡啶环伸缩振动[41],这与本研究结果相异。其原因与原料来源有关,本研究选用的材料为蒙古栎地表可燃物,其富含木质素;而Canteel[42]研究所选用的材料为玉米秸秆,以纤维素、半纤维素居多。
3 结论
对不同制备条件时,蒙古栎新鲜地表可燃物生物炭理化性质的研究可得到以下结论:
生物炭产率、净产率整体随温度增长呈下降趋势,灰分质量分数随温度增长呈上升趋势。
随温度升高,生物炭的碳质量分数上升;氧、氢质量分数下降;氮质量分数先上升后下降。
生物炭的不溶性有机碳质量分数随炭化时间增长发生不同的变化;稳定性碳质量分数随热解温度升高呈先升高后降低趋势。
生物炭的pH随热解温度以及灰分质量分数的升高显著增加。其电导率随热解温度升高而升高。阳离子交换量随温度升高先上升后下降。
炭化时间为1 h、温度为300 ℃时,其铵氮、硝氮质量分数最高,温度为500 ℃时其速效磷质量分数最高。在此条件下生产的生物炭适合开发生物质肥料。
生物炭的含氧官能团随炭化时间增长而减小,随温度升高而逐渐消失,其芳香性随温度升高而升高。

