基于网络药理学和分子对接技术分析连理汤治疗溃疡性结肠炎的分子机制▲
邓亚胜 黄 慧 梁天薇 林 江
(广西中医药大学基础医学院,广西南宁市 530000)
溃疡性结肠炎(ulcerative colitis,UC)是一种反复发作的结直肠慢性非特异性炎症疾病[1],主要临床症状为腹痛、腹泻及黏液脓血便等,通过结肠镜和组织病理学检查可明确诊断[2]。目前,UC的发病机制尚未明确,大多数学者认为与遗传易感性、上皮屏障缺陷、免疫反应失调、环境等因素有关[3-5]。UC病变范围广,病变部位常累及直肠、降结肠,甚至可以延伸至整个结肠,病情反复,迁延难愈,可发生于任何年龄段,被WHO列为现代难治病之一[6]。
西医治疗UC的主要药物有氨基水杨酸类、糖皮质激素类、免疫抑制剂、抗生素及生物制剂等[7-9],用药后症状得以缓解,但长期服用可能会出现胃肠道反应、过敏反应、激素副作用、感染等副作用。部分患者可选择手术治疗,但手术指征多为增生或病变、病情迁延难愈、药物控制不佳或不耐受等[8]。因此,亟须寻找可以治疗UC的新方法以改善患者的症状,提高疗效。中医药治疗UC历史悠久,且获得较好的疗效[10-11]。其中,连理汤是治疗UC的常用方剂,全方由干姜、甘草(炙)、黄连、茯苓、白术、人参组成。祁正平[12]采用连理汤治疗UC,其临床总有效率高达95.24%,高于采用美沙拉嗪治疗的对照组;赵静等[13]发现,与柳氮磺胺吡啶治疗相比,连理汤治疗UC的疗效更显著。因连理汤具有多成分、多靶点协同作用的特点,其治疗UC的作用机制尚不明确。网络药理学是一种以疾病、靶点、基因和药物相互作用网络为基础,集计算机生物学、蛋白组学和系统生物学于一体的分析方法。本研究运用网络药理学结合分子对接技术探讨连理汤治疗UC的作用机制,以期为连理汤治疗UC作用机制的探索提供理论依据。
1 资料与方法
1.1 连理汤性味-归经的检索 通过查阅《中华人民共和国药典(2020年版)》及《中药学(新世纪第五版)》,获取连理汤所含药物的性味、归经,并使用Cytoscape 3.8.2软件构建“性味-归经”网络图。
1.2 连理汤活性化学成分及其作用靶点的筛选 在中药系统药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP;https://tcmsp-e.com/)检索连理汤的活性化学成分,并设置药物相似性(drug-likeness,DL)≥0.18、口服生物利用度(oral bioavailability,OB)≥30%为活性化学成分的筛选标准。然后在该平台上检索活性化学成分对应的作用靶点,剔除尚无明确作用靶点的活性化学成分。在UniProt数据库(https://www.uniprot.org/)中,将物种设置为人类,将作用靶点名称转换为标准基因名,汇总后去重。
1.3 UC相关靶点的筛选 以“Ulcerative Colitis”为关键词,在TTD数据库(http://db.idrblab.net/ttd/)、DrugBank数据库(https://go.drugbank.com/)、OMIM®数据库(https://omim.org/)、PharmGKB数据库(https://www.pharmgkb.org/)、CTD数据库(http://ctdbase.org/)、DisGeNET数据库(https://www.disgenet.org/)、GeneCards®数据库(https://www.genecards.org/)、DISEASES数据库(https://diseases.jensenlab.org/)检索UC相关靶点,检索时间为建库至2021年10月23日。考虑到CTD数据库、DisGeNET数据库、GeneCards®数据库、DISEASES数据库中的靶点过多,分别以推理分数>15、Scoregda≥0.05、关联分数>5、Z值≥4为筛选标准,对检索到的靶点进行进一步筛选。汇总上述8个数据库检索得到的靶点,进行格式调整、标准基因名转换等处理后删除重复的靶点,获得UC的相关靶点。
1.4 “中药-活性成分-靶点”网络构建 将1.2和1.3得到的靶点导入Draw Venn Diagram在线工具(http://bioinformatics.psb.ugent.be/webtools/Venn/)绘制韦恩图,获得交集靶点,即为连理汤治疗UC的相关靶点。把连理汤活性化学成分及其作用靶点导入Cytoscape 3.8.2软件中,利用Network Analyzer插件的Merge功能绘制“中药-活性成分-靶点”网络,并根据网络拓扑学参数筛选出主要活性化学成分。
1.5 蛋白-蛋白相互作用网络的构建及核心靶点的提取 将交集靶点导入STRING数据库(https://string-db.org/)中,将置信度设为>0.4,获取蛋白-蛋白相互作用(protein-protein interaction,PPI)网络,并保存为TSV格式文件。将该TSV文件导入Cytoscape 3.8.2软件,利用Network Analyzer插件进行网络拓扑学参数分析,并进行可视化展示,选取度值排名前10的靶点作为核心靶点。
1.6 功能富集分析与通路富集分析 为进一步了解连理汤治疗UC所涉及的生物过程、分子功能、细胞组分及信号通路,将交集靶点上传至DAVID数据库(https://david.ncifcrf.gov/),限定物种为人类,进行基因本体论(Gene Ontology,GO)功能富集分析及京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析。根据Benjamini-Hochberg矫正法,按-lgP值由大到小对富集分析结果进行排序,设定P<0.05为筛选条件,筛选出排名前20的信号通路及排名前10的生物过程、分子功能、细胞组分。
1.7 分子对接 将“中药-活性成分-靶点”网络筛选得到的主要活性化学成分作为配体蛋白,将PPI网络筛选得到的核心靶点作为受体蛋白。首先在RCSB-PDB数据库(https://www.rcsb.org/)中获取上述蛋白的“PDB”格式,并在TCMSP平台下载活性化学成分的“MOL2”格式,利用AutoDock 1.5.6软件对受体蛋白和配体蛋白进行去水、加氢、计算电荷及寻找可旋转化学键等处理,再根据受体蛋白和配体蛋白大小设置合适的对接盒子,并利用Lamarckian遗传算法进行分子对接,最后在Pymol软件中进行可视化分析。对接结合能越小,说明受体与配体对接的稳定程度越高。
2 结 果
2.1 连理汤“性味-归经”网络图的构建 通过查阅《中华人民共和国药典(2020年版)》及《中药学(新世纪第五版)》,获取干姜、甘草(炙)、黄连、茯苓、白术、人参的性味和归经,构建连理汤“性味-归经”网络,见图1。由图可知,本方性味辛、温、热升散,苦、寒降泄,甘、淡渗利;归经则上中下三焦兼顾。全方寒热共用,苦辛并进,辅以补益。
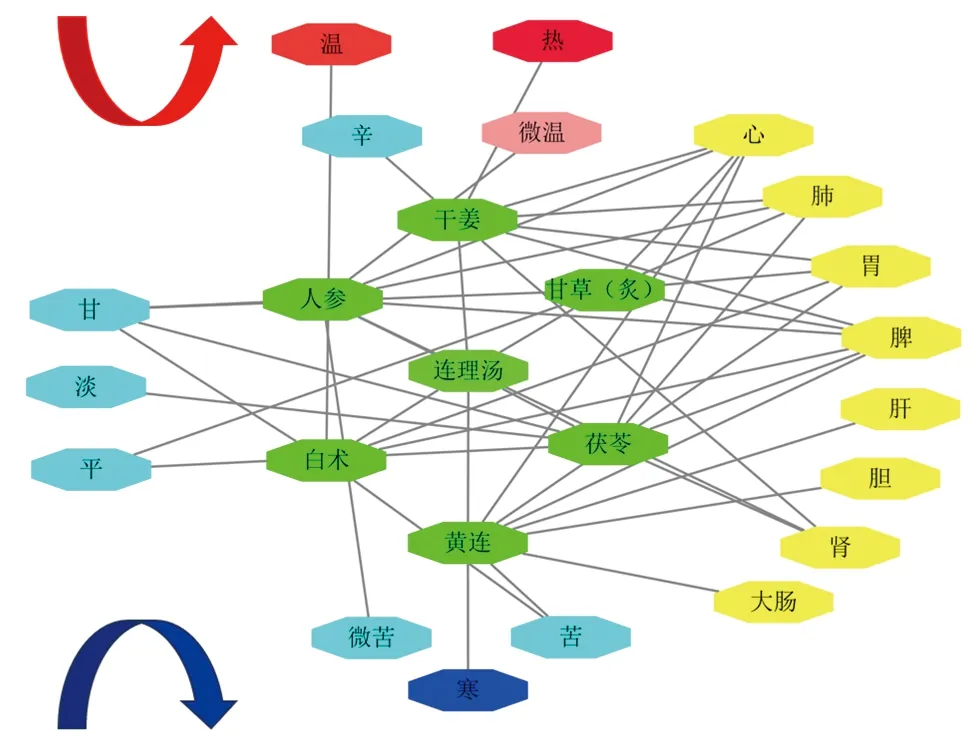
图1 连理汤“性味-归经”网络图
2.2 连理汤活性化学成分及其作用靶点的筛选结果 通过TCMSP初步获取干姜、甘草(炙)、黄连、茯苓、白术、人参6味中药的化学成分分别为148个、280个、48个、34个、55个、190个,以OB≥30%、DL≥0.18为条件筛选得到连理汤的活性化学成分155个,其中干姜5个、甘草(炙)92个、黄连14个、茯苓15个、白术7个、人参22个,剔除未找到相应作用靶点的活性化学成分后,上述各组分的活性化学成分分别为5个、86个、11个、6个、4个、1个,其中干姜、人参存在共有活性化学成分β-谷甾醇(MOL000358),干姜、甘草(炙)存在共有活性化学成分谷甾醇(MOL000359),黄连、甘草(炙)存在共有活性化学成分槲皮素(MOL000098),排除重复活性化学成分后,连理汤的活性化学成分共为110个。利用Uniprot数据库将110个活性化学成分对应的2 146个靶点名称转换为标准基因名,汇总后去重,最终得到229个作用靶点。
2.3 UC相关靶点的筛选结果 在TTD数据库、DrugBank数据库、OMIM®数据库、PharmGKB数据库中获得UC相关靶点分别为39个、69个、7个、14个。在CTD数据库中获得UC相关靶点15 500个,以推理分数>15为条件筛选得到UC相关靶点987个;在DisGeNET数据库中获得UC相关靶点1 458个,以Scoregda≥0.05为条件筛选得到UC相关靶点349个;在GeneCards®数据库中获得UC相关靶点4 800个,以关联分数>5为条件筛选得到UC相关靶点549个;在DISEASES数据库中获得UC相关靶点8 577个,以Z值≥4为条件筛选得到UC相关靶点131个。将上述数据库获得的相关靶点去重合并,共获得UC相关靶点1 538个。将1 538个UC相关靶点与229个连理汤活性化学成分的作用靶点取交集,共获得134个交集靶点,即连理汤治疗UC的相关靶点。见图2。

图2 连理汤活性化学成分作用靶点与UC相关靶点的韦恩图
2.4 “中药-活性成分-靶点”网络 采用Cytoscape 3.8.2软件构建“中药-活性成分-靶点”网络图,此网络图包含455个节点,2 167条边,见图3。使用Network Analyzer插件进行网络拓扑学参数分析,依次提取大于2倍中位数及1倍中位数的度值,最终度值中位数为30,筛选出度值>30的主要活性化学成分有11个,包括槲皮素、山柰酚、β-谷甾醇、异鼠李素等,见表1。

表1 11个主要活性化学成分信息表

图3 “中药-活性成分-靶点”网络图
2.5 连理汤治疗UC相关靶点的PPI网络及核心靶点的筛选结果 将交集靶点导入STRING数据库中,获取连理汤治疗UC相关靶点的PPI网络(见图4A),该网络图由134个节点、2 804条边组成,平均节点度为41.9,平均局部聚类系数为0.688。使用Network Analyzer插件对该PPI网络进行网络拓扑学参数分析,计算出拓扑网络度值,以度值≥84为条件筛选出10个核心靶点,分别为丝氨酸/苏氨酸蛋白激酶1(serine/threonine protein kinase 1,AKT1)、肿瘤坏死因子(tumor necrosis factor,TNF)、白细胞介素(interleukin,IL)-6、肿瘤抑癌蛋白p53(tumor suppressor protein p53,TP53)、IL-1B、原癌基因C-Jun(proto-oncogene C-Jun,JUN)、Caspase-3、前列腺素内环氧化物合成酶2(prostaglandin endoperoxide synthase 2,PTGS2)、信号传导与转录激活因子3(signal transducer and activator of transcription 3,STAT3)、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)3,见图4B。
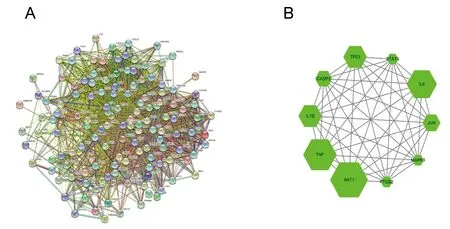
图4 连理汤治疗UC相关靶点PPI网络图及核心靶点
2.6 KEGG通路富集分析结果 将交集靶点上传至DAVID数据库进行KEGG通路富集分析,共得到116条信号通路(P<0.05),根据-lgP值由大到小进行排序,排名前20的信号通路包括乙型肝炎、癌症相关通路、TNF信号通路、弓形体病、缺氧诱导因子1(hypoxia-inducible factor 1,HIF-1)信号通路、磷脂酰肌醇3-激酶/蛋白激酶B(phosphatidylinositol 3-kinase/protein kinase B,PI3K-AKT)信号通路、小细胞肺癌、Toll样受体(Toll-like receptor,TLR)信号通路、p53信号通路、核因子κB(nuclear factor kappa B,NF-κB)信号通路、T细胞受体信号通路等,见表2和图5。

图5 连理汤治疗UC的KEGG通路富集分析气泡图
2.7 GO功能富集分析 将交集靶点上传至DAVID数据库进行GO功能富集分析,共获得526条生物过程条目、46条细胞组分条目、84条分子功能条目(P<0.05)。根据-lgP值由大到小进行排序,其中生物过程条目以药物反应、凋亡过程的负调控、凋亡过程、炎症反应、信号转导等为主;细胞组分条目以细胞核、胞质溶胶、蛋白质复合物、膜筏、核质等为主;分子功能条目以酶结合、转录因子结合、蛋白质结合、细胞因子活性、类固醇激素受体活性、蛋白激酶结合等为主,见图6。

图6 连理汤治疗UC的GO功能富集分析气泡图
2.8 分子对接 将“中药-活性成分-靶点”网络中的主要活性化学成分与PPI网络中的核心靶点进行分子对接,同时记录对接结合能,见表3和图7。结果显示,MAPK3与主要活性化学成分均没有完成对接,而异鼠李素与PTGS2对接结合能为-10.4 kcal/mol,对接稳定性最好,其次为山柰酚与STAT3的对接结合能,为-10.1 kcal/mol,部分分子对接的可视化模型见图8。分子对接结合能<-5.0 kcal/mol提示结合活性强,本研究中大部分主要活性化学成分与核心靶点对接的结合能均<-5 kcal/mol,说明连理汤中各中药的主要活性化学成分与核心靶点对接较稳定。
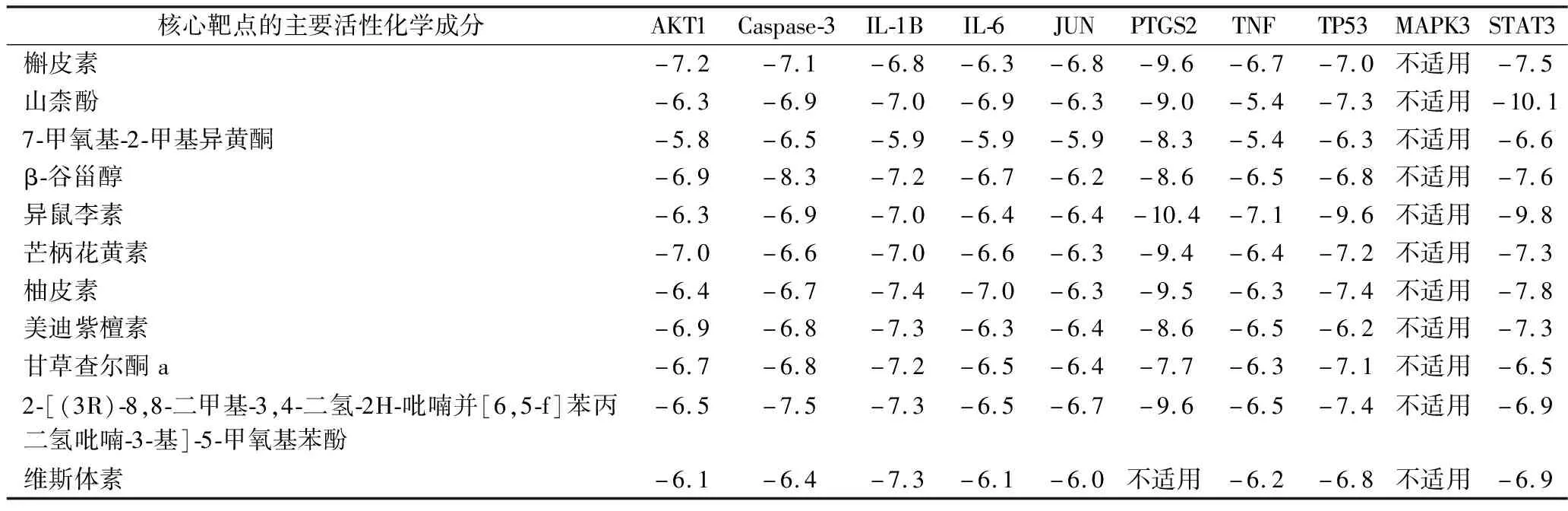
表3 分子对接结合能(kcal/mol)
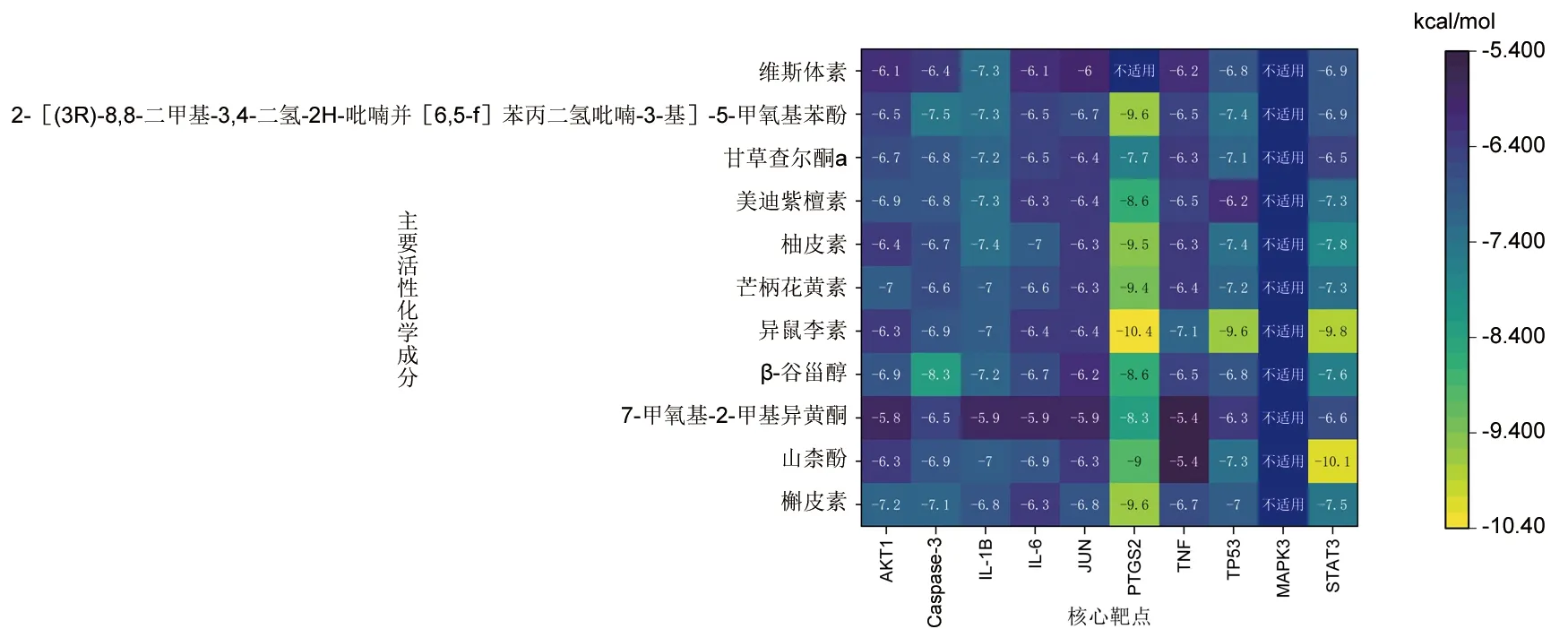
图7 分子对接结合能热图

图8 部分分子对接的模型图
3 讨 论
在中医学上UC被称为“痢疾”“肠游”“滞下”“泄泻”“肠风”“肠癖”等,病位在大肠,涉及肝、脾、肺、肾等脏器,病程漫长。中医认为UC以素体脾气虚弱为发病基础,以饮食不洁、情志失调、感受外邪等为主要发病诱因[14]。患者脾气虚弱,运化传导失司,酿生湿热之邪,导致气血搏结,肠道络脉受损,脂膜腐败溃烂,腐败之物化为脓血,故而引起本病。连理汤首载于《秘传证治要诀及类方》,方由干姜、甘草(炙)、黄连、茯苓、白术、人参组成。方中干姜辛热,温中散寒,回阳通脉,为君药。黄连苦寒,清热燥湿,入胃、大肠经,清肠胃湿热之邪,为臣药;君臣相合,平调寒热,辛开苦降,且干姜能防黄连苦寒伤阴之弊,黄连又可制干姜辛温助热之失。人参甘而微温,补气健脾;白术苦温,健脾燥湿,助人参健脾而复升降;茯苓甘淡,利水渗湿,健脾,三药共为佐药。甘草(炙)甘温,补中益气,缓急止痛,兼和诸药,为使药。诸药寒热并用,升降共调,共奏清热燥湿、补气健脾之效。临床研究显示,连理汤可以改善UC患者临床症状,提高患者生活质量[15-16]。但连理汤治疗UC的机制尚未明确,故本研究基于网络药理学探究连理汤治疗UC的活性化学成分、作用靶点及相关信号通路,为连理汤的临床应用提供理论依据。
本研究结果显示,连理汤的主要活性化学成分为槲皮素、山柰酚、异鼠李素、柚皮素、芒柄花黄素、β-谷甾醇等。其中,山柰酚、槲皮素、异鼠李素、柚皮素均属于黄酮类化合物,β-谷甾醇属于甾醇类化合物,芒柄花黄素是一种异黄酮类植物雌激素。研究表明,槲皮素具有抗肿瘤、抗炎、抗微生物、抗氧化等作用,但其作用机制尚未明确。有学者认为,槲皮素通过抑制环氧化酶2、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、NF-κB、激活蛋白1(activator protein 1,AP-1)和MAPK的表达而发挥抗炎作用[17-18]。同时,槲皮素还能抑制TNF-α的产生,而TNF-α是一种多功能细胞因子,可调节活化白细胞的生长、增殖、分化和活力,同时还会诱发其他细胞因子、趋化因子等炎症介质的表达[19-20]。此外,槲皮素还通过干扰细胞周期[21]、抑制存活信号蛋白(蛋白激酶C-α)和激活死亡信号蛋白(蛋白激酶C-δ)[22]等发挥抗肿瘤作用。山柰酚主要通过抑制TLR4/NF-κB通路的激活来改善肠道屏障的完整性,并抑制肠道炎症[23-24]。异鼠李素、柚皮素通过抑制NF-κB的激活,同时抑制巨噬细胞iNOS的表达和一氧化氮的产生,发挥抗炎作用[25-27]。研究显示,β-谷甾醇可通过浓度依赖的方式降低结肠炎小鼠模型肠道组织中TNF-α、IL-6和IL-1β的表达水平,从而促进肠上皮细胞抗菌肽的表达,同时抑制肠道致病菌的存活,避免肠道受到炎症的影响[28]。此外,β-谷甾醇还可以通过抑制NF-κB通路中脂多糖与TLR4的结合来减轻高脂饮食诱导的小鼠肠道炎症[29]。芒柄花黄素可作用于多条致癌信号通路,包括PI3K/AKT信号通路、MAPK信号通路、酪氨酸蛋白激酶和信号传导与转录激活因子信号通路和胰岛素生长因子1/胰岛素生长因子1受体信号通路,从而影响肿瘤细胞的增殖、凋亡和迁移过程[30-33]。上述研究表明连理汤的多个药物活性成分通过抗肿瘤、抗炎等机制,发挥治疗UC的作用。
本研究通过构建PPI网络,得出AKT1、TNF、IL-6、TP53、IL-1B、JUN、Caspase-3、PTGS2、STAT3、MAPK3是连理汤治疗UC的核心靶点。其中,TNF有抗感染、调节免疫、促进细胞增殖分化等功能,对机体具有一定保护作用,而高水平TNF可引起局部炎症反应[34]。IL-6参与机体细胞免疫、体液免疫的调节,在自身免疫、炎症反应等方面起重要作用[35]。PTGS2又称为诱导型环氧合酶2,在调节炎症反应中起关键作用[36],是前列腺素生物合成中的关键酶,在细菌脂多糖、真菌病原体和炎症细胞因子等刺激下,可促进前列腺素的表达[37]。AKT1是AKT家族成员之一,可增强细胞自噬,从而降低炎症因子的表达[38]。TP53是防止突变细胞扩增的重要“守护者”,宽型TP53是一种肿瘤抑制基因,当机体发生DNA损伤时可以延缓细胞周期的进程[39]。IL-1B是编码促炎因子IL-1β的基因,异常的免疫应答可引起IL-1β的异常激活,导致肠黏膜损伤,其在UC的发展中起到关键作用[40]。作为原癌基因的JUN目前尚未有研究证实其与UC相关,但其细胞同源物AP-1转录因子与癌症和肿瘤转化有关,AP-1参与多种细胞活动,包括分化、增殖、存活和凋亡等[41]。AP-1转录因子已被证明可以激活或抑制iNOS表达[42],UC患者结肠黏膜中iNOS表达明显增高,表明其与UC的发病关联密切[43]。Caspase-3属于Caspase蛋白家族成员之一,在细胞凋亡和致癌过程中起到关键作用[44],肠道黏膜上的Caspase-3异常表达会激发T淋巴细胞对细胞凋亡的抵抗力,引起T淋巴细胞积累和慢性肠道炎症的产生[45]。MAPK3是丝裂原活化蛋白信号转导途径的重要组成部分,参与调节细胞的增殖、分化、分裂和凋亡[46],在UC的发病中起到重要作用,其激活被认为是导致UC细胞因子和炎症介质释放的主要原因之一,抑制MAPK信号通路是治疗UC的重要手段[47]。STAT3是免疫反应的重要调节因子,可以被以IL-6为代表的促炎因子激活,可通过免疫应答、介导炎症信号传导、调节黏膜屏障及促进肠道纤维化等多方面参与UC的发展[48-49]。
本研究中GO功能富集分析结果显示,连理汤治疗UC的相关靶点主要涉及蛋白质复合物、核质、细胞外间隙、胞质溶胶等细胞组分,以及酶结合、转录因子结合、蛋白质结合、细胞因子活性等分子功能,这些靶点可通过凋亡过程、信号转导、炎症反应等生物过程来发挥治疗UC的作用。KEGG通路富集分析结果显示,连理汤治疗UC涉及的信号通路包括TNF信号通路、TLR信号通路、PI3K-AKT信号通路、NF-κB信号通路、p53信号通路、癌症相关通路、HIF-1信号通路等。研究显示,UC的发生是由于完整的肠黏膜免疫屏障遭到破坏所引起[50-51],而肠黏膜免疫屏障遭到破坏后,肠道免疫反应被异常激活,TLR信号通路和NF-κB信号通路是参与肠道免疫反应的核心通路[52]。TLR具有免疫防御和识别外来微生物的作用[53],当TLR被激活后,可识别及结合病原体,促使髓样分化因子88-IL1受体关联激酶-TNF受体关联因子6-转化生长因子β活化激酶1信号复合体形成,从而激活NF-κB信号通路[54]。NF-κB是炎症反应的关键调节因子,与UC的发生和发展关系密切,NF-κB信号通路的激活不仅会加重炎症反应,而且会促进肿瘤细胞的产生与增殖,是加速UC病情进展的重要因素[55-58]。AKT是一种原癌基因,具有调节不同细胞活动的功能,包括细胞增殖、生长、存活、凋亡、代谢、转录和蛋白质合成,PI3K/AKT信号通路中的AKT活化后可激活NF-κB信号通路,从而参与UC的发生和发展过程[59]。此外,TNF信号通路[60-61]、p53信号通路[62]、HIF-1信号通路[63-64]等均与UC的发生密切相关。
综上所述,连理汤主要通过异鼠李素、槲皮素、山柰酚等主要活性化学成分作用于AKT1、TNF、IL-6、TP53、IL-1B、JUN等靶点,通过调节TNF信号通路、TLR信号通路、PI3K/AKT信号通路、NF-κB信号通路、p53信号通路、HIF-1信号通路等发挥抗炎、免疫调节、维持肠黏膜免疫屏障、调节肠道菌群等作用,从而达到治疗UC的目的。

