桂枝茯苓丸对慢性阻塞性肺疾病小鼠气道重塑的影响
张 真,杨亿然,刘 雨,谭宇军,吴 哲,谭光波,胡学军,邓秀娟*
(1.湖南中医药大学,湖南 长沙 410208; 2.湖南省中医药研究院附属医院,湖南 长沙 410006)
慢性阻塞性肺疾病 (chronic obstructive pulmonary disease,COPD) 是一种以不可逆的气流受限为特征的常见肺系疾病,气道重塑是COPD 发生发展过程中重要的病理特征,源自于气道组织的反复损伤-修复过程,是导致患者气流受限和激素抵抗的主要原因[1-3]。上皮间质转化 (epithelialmesenchymal transition,EMT) 是指上皮细胞失去极性并转化为可移动的间充质细胞,其形态学改变包括上皮细胞连接和极性复合物的破坏,以及细胞骨架结构的重组[4]。目前,EMT 已被认为是许多呼吸系统疾病的基础,与气道纤维化、气道重塑和随后的气流阻塞有关[5]。大量研究表明,核因子活化B 细胞的κ 轻链增强子(nuclear factor kappalight-chain-enhancer of activated B cells,NF-κB) 所介导的蜗牛同源蛋白(Snail) 是EMT、细胞粘附和增殖的关键调节因子,NF-κB/Snail 通路在EMT中具有重要作用[6-8],与COPD 气道重塑密切相关。中医学认为,COPD 气道重塑是在外来六淫之毒的持续作用下,肺络受损,内生痰瘀之毒,痹阻肺络而成,“毒损肺络” 是其关键病机[9-12]。桂枝茯苓丸出自《金匮要略》,是治疗癥瘕积聚的经典名方,具有活血化痰、消癥通络的功效。因此,本研究以“毒损肺络” 为理论基础,探讨桂枝茯苓丸对NF-κB/Snail 介导的EMT 的影响,进而揭示其改善COPD 气道重塑的内在机制。
1 材料
1.1 动物 SPF 级雄性C57BL/6 小鼠40 只,体质量18~22 g,由湖南中医药大学动物实验中心提供[实验动物生产许可证号SCXK (湘) 2019-0004,动物质量合格证号43072721100875058],饲养于湖南中医药大学动物实验中心[实验动物使用许可证号SYXK (湘) 2019-0009],温度22 ~24 ℃,相对湿度50% ~60%,昼夜12 h/12 h 交替照明,自由进食和饮水。本实验经湖南中医药大学动物实验伦理委员会批准 (伦理号 LLBH-202203140006)。
1.2 药物与试剂 金圣牌香烟,由江西中烟工业有限责任公司生产,焦油含量8 mg,烟气烟碱含量0.8 mg,CO 含量9 mg。桂枝茯苓丸(国药准字Z20027562) 购自成都九芝堂金鼎药业有限公司,按每100 丸(15 g) 加450 mL 蒸馏水的比例溶解(即每30 mL 药液含1 g 药物),现用现配。NF-κB抑制剂EVP4593 (货号A4217,美国APExBIO 公司); 4%多聚甲醛固定液(货号BL539A,北京兰捷柯科技有限公司); 白细胞介素-8 (interleukin-8,IL-8) ELISA 试剂盒(货号MU30010,武汉贝茵莱生物科技有限公司); 白细胞介素-6(interleukin-6,IL-6) ELISA 试剂盒、肿瘤坏死因子-α (tumor necrosis factor-α,TNF-α) ELISA 试剂盒、兔单抗E-钙粘蛋白、兔单抗Snail、兔单抗IκBα、小鼠单抗NF-κB、小鼠单抗β-actin (货号KE10007、KE10002、E-cadherin、20874-1-AP、13099-1-AP、10268-1-AP、66535-1-Ig、66009-1-Ig,武汉三鹰生物技术有限公司); 兔单抗α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、兔单抗p-IκBα、兔单抗p-NF-κB [货号ab124964、ab133462、ab76302,艾博抗(上海) 贸易有限公司]; 苏木素伊红染液、HRP 标记羊抗小鼠二抗、HPR 标记羊抗兔二抗 ( 货号 AWI0020b、AWS0001、AWS0002,长沙艾碧维生物科技有限公司)。
1.3 仪器 自制亚克力透明烟熏箱1.6 m×0.5 m×0.25 m (包含顶部和侧面2 个直径8 cm 的进出气孔),由上海易雕实业有限公司定制; LH-75 型管道风机(深圳市世化电器照明有限公司); PFTMR 型小动物肺功能检测仪(上海塔望智能科技有限公司); TS-1 型摇床、GL-88B 型旋涡混合器(海门市其林贝尔仪器制造有限公司); H1650R 型台式冷冻离心机(湖南湘仪科教仪器有限公司);JB-13 型磁力搅拌器、PHS-3C 型精密PH 计(上海精密科学仪器有限公司); PW-812 型全自动酶标洗板机、MB-530 型多功能酶标分析仪(深圳市汇松科技发展有限公司); DYY-60 型电泳仪、DYCZ-24DN 型电泳槽、DYCZ-40D 型转膜仪(北京六一生物科技有限公司); BioPrep-24 型生物样品均质仪(杭州奥盛仪器有限公司); ChemiScope6100 型化学发光成像系统 (上海勤翔科学仪器有限公司)。
2 方法
2.1 分组与造模 小鼠按随机数字表法分为空白组、模型组、桂枝茯苓丸组、EVP4593 组、桂枝茯苓丸+EVP4593 组,每组8 只,模型组和给药组采用被动吸烟的方式造模,每天熏烟2 次,每次使用20 支香烟,持续60 min,中途间隔4 h,每熏烟6 d,休息1 d,总计60 d。
2.2 给药 小鼠给药剂量参考人和动物体表面积折算的等效剂量比率表[13],得到桂枝茯苓丸组灌胃剂量为273 mg/kg,EVP4593 组皮下注射剂量为1 mg/kg[14]。各组在第61 天(即造模结束后第1天) 开始灌胃或(和) 皮下注射给药,每天1 次,连续14 d,其中桂枝茯苓丸+EVP4593 组在皮下注射EVP4593 后立即灌胃桂枝茯苓丸药液,空白组和模型组灌胃给予等量生理盐水。灌胃过程中,模型组死亡2 只,桂枝茯苓丸组死亡1 只,桂枝茯苓丸+EVP4593 组死亡1 只。
2.3 肺功能指标检测 小鼠腹腔注射1% 戊巴比妥钠(40 mg/kg) 麻醉后,分离暴露气管,进行气管插管固定,使用小动物肺功能检测仪测定每分钟通气量(minute ventilation volume,MV)、吸气峰流量(peak inspiratory flow,PIF) 及呼气峰流量(peak expiratory flow,PEF)。肺功能测定过程中,空白组失败2 只,模型组失败1 只,EVP4593 组失败2 只,桂枝茯苓丸+EVP4593 组失败1 只。
2.4 肺组织病理检查 取小鼠左肺组织于4% 多聚甲醛中固定24 h,脱水后石蜡包埋切片。HE 染色观察肺组织病理形态,肺部炎症的严重程度通过炎症评分进行半定量分析[15],定义为0 分,无炎症; 1 分,轻度炎症,偶见炎性细胞灶; 2 分,中度炎症,大部分肺泡、支气管或血管壁有1 ~5 层炎性细胞; 3 分,重度炎症,大部分肺泡、支气管或血管壁有5 层以上炎性细胞。每张切片取5 个视野的炎症评分均值作为最终结果。按照文献[16]报道方法,选取最小内径/最大内径>0.5,且基底膜周径<2 000 μm 的支气管作为检测对象,通过Image J (v1.53) 软件测定气道管壁总面积(wall area of bronchial tube,WAt) 和支气管基底膜周径(perimeter of basement membrane,Pbm),以Pbm为基值标准化,以WAt 与Pbm 比值代表气道管壁厚度,每张切片选取5 个支气管进行测量。
Masson 染色观察气道纤维化改变,其中胶原纤维呈蓝色。通过Image J (v1.53) 软件测定蓝染面积,以Pbm 为基值标准化,测得蓝染区平均厚度(μm2/μm),每张切片选取5 个支气管进行测量。
2.5 ELISA 法检测肺组织IL-6、IL-8 和TNF-α 水平 称取100 mg 肺组织,剪碎后放入组织研磨器(匀浆管) 中,加入1 mL 1× PBS 溶液,制成匀浆,置于-20 ℃过夜,经反复冻融2 次破坏细胞膜,2~8 ℃、5 000×g 离心5 min,取上清液备用。严格按ELISA 试剂盒说明书操作,检测IL-6、IL-8和TNF-α 水平。
2.6 Western blot 法检测肺组织EMT 和NF-κB/Snail 通路相关蛋白表达 称取25 mg 肺组织,加入300 μL RIPA 裂解液,在生物样品均质仪中研磨为组织匀浆,冰上裂解10 min,12 000 r/min 离心15 min,提取上清液,BCA 试剂盒检测蛋白浓度。配制SDS-PAGE 凝胶,经电泳、转膜、封闭,加稀释后的一抗E-cadherin (1 ∶5 000)、α-SMA (1 ∶1 000)、Snail (1 ∶500)、IκBα (1 ∶1 000)、p-IκBα (1 ∶10 000)、NF-κB (1 ∶1 000)、p-NF-κB(1 ∶1 000)、β-actin (1 ∶5 000),4 ℃孵育过夜,次日室温放置30 min,1×PBST 洗膜3 次,每次15 min,加稀释后的二抗(1 ∶5 000) 室温孵育90 min,1×PBST 洗膜3 次,每次10 min,ECL 化学发光显影,凝胶成像系统成像,通过Image J(v1.53) 软件测定各条带光密度值,以β-actin 为内参。
2.7 统计学分析 通过SPSS 26.0 软件进行处理,数据以(±s) 表示,多组间比较采用单因素方差分析,若不符合正态分布或(和) 方差不齐时,采用非参数检验。P<0.05 表示差异具有统计学意义。
3 结果
3.1 桂枝茯苓丸对COPD 小鼠肺功能的影响 与空白组比较,模型组小鼠MV、PIF 和PEF 值降低(P<0.05); 与模型组比较,各给药组小鼠MV、PIF 和PEF 值升高(P<0.05),其中以桂枝茯苓丸+EVP4593 组最为显著(P<0.05),而桂枝茯苓丸组和EVP4593 组间比较无明显差异(P>0.05),见表1。
表1 各组小鼠肺功能比较(±s)Tab.1 Comparison of mouse lung function levels in each group (±s)
注: 与空白组比较,*P<0.05; 与模型组比较,#P<0.05; 与桂枝茯苓丸组比较,△P<0.05; 与EVP4593 组比较,▲P<0.05。
组别动物数/只MV/mLPEF/(mL·s-1)PIF/(mL·s-1)空白组648.62±3.214.95±0.343.77±0.29模型组519.32±5.12*2.09±0.39*2.06±0.24*桂枝茯苓丸组730.62±4.07#3.51±0.42#2.54±0.22#EVP4593 组632.41±2.83#3.54±0.21#2.62±0.27#桂枝茯苓丸+EVP4593 组640.25±3.67#△▲4.09±0.15#△▲3.24±0.17#△▲
3.2 桂枝茯苓丸对COPD 小鼠肺组织病理形态的影响 空白组小鼠肺泡腔完整,黏膜上皮细胞无脱离坏死,黏膜下腺体无增生,气道周围少见炎性细胞,气管腔内无分泌物,基底膜和平滑肌无增生;与空白组比较,模型组小鼠肺泡间隔增厚,支气管的基底膜和平滑肌增生,支气管壁增厚,有大量炎性细胞浸润,气管腔内可见上皮细胞脱离或分泌物,并存在不同程度的狭窄,肺组织炎症评分和气道管壁厚度均增加(P<0.05); 与模型组比较,各给药组小鼠上述病理改变减轻,肺组织炎症评分和气道管壁厚度均降低(P<0.05),其中以桂枝茯苓丸+EVP4593 组最为显著(P<0.05),而桂枝茯苓丸组和EVP4593 组间比较无明显差异(P>0.05),见图1、表2。
表2 各组小鼠肺组织炎症评分和气道管壁厚度比较(±s)Tab.2 Comparison of mouse lung inflammation score and airway wall thickness in each group (±s)
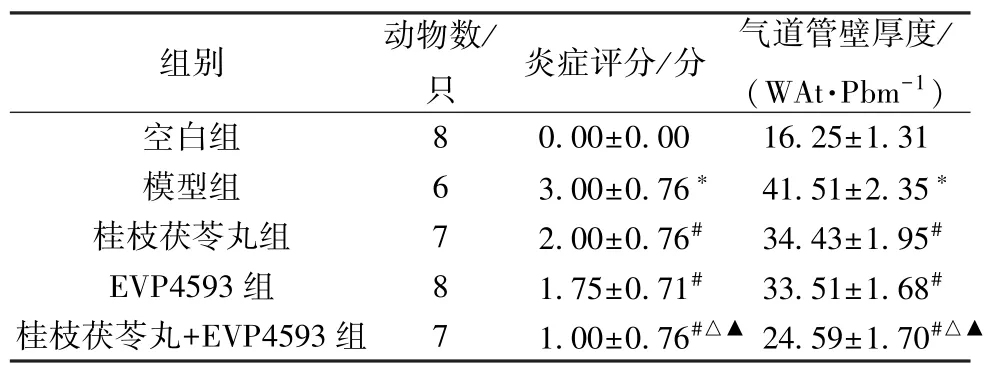
表2 各组小鼠肺组织炎症评分和气道管壁厚度比较(±s)Tab.2 Comparison of mouse lung inflammation score and airway wall thickness in each group (±s)
注: 与空白组比较,*P<0.05; 与模型组比较,#P<0.05; 与桂枝茯苓丸组比较,△P<0.05; 与EVP4593 组比较,▲P<0.05。
组别动物数/只炎症评分/分气道管壁厚度/(WAt·Pbm-1)空白组80.00±0.0016.25±1.31模型组63.00±0.76*41.51±2.35*桂枝茯苓丸组72.00±0.76#34.43±1.95#EVP4593 组81.75±0.71#33.51±1.68#桂枝茯苓丸+EVP4593 组71.00±0.76#△▲24.59±1.70#△
3.3 桂枝茯苓丸对COPD 小鼠肺组织胶原纤维的影响 与空白组比较,模型组小鼠气道蓝染区厚度增加(P<0.05),胶原纤维增多; 与模型组比较,各给药组小鼠气道蓝染区厚度减小(P<0.05),胶原纤维减少,其中以桂枝茯苓丸+EVP4593 组最为显著(P<0.05),而桂枝茯苓丸组和EVP4593 组间比较无明显差异(P>0.05),见图2、表3。

图2 各组小鼠肺组织Masson 染色(×200)Fig.2 Masson staining of mouse lung tissue for each group (×100)
表3 各组小鼠气道蓝染区厚度比较(±s)Tab.3 Comparison of the thickness of mouse airway blue staining area in each group (±s)

表3 各组小鼠气道蓝染区厚度比较(±s)Tab.3 Comparison of the thickness of mouse airway blue staining area in each group (±s)
注: 与空白组比较,*P<0.05; 与模型组比较,#P<0.05; 与桂枝茯苓丸组比较,△P<0.05; 与EVP4593 组比较,▲P<0.05。
组别动物数/只气道蓝染区厚度/(μm2·μm-1)空白组87.25±1.01模型组631.51±2.35*桂枝茯苓丸组718.23±1.95#EVP4593 组817.91±1.68#桂枝茯苓丸+EVP4593 组711.59±1.70#△▲
3.4 桂枝茯苓丸对COPD 小鼠肺组织IL-6、IL-8 和TNF-α 水平的影响 与空白组比较,模型组小鼠肺组的IL-6、IL-8 和TNF-α 水平升高(P<0.05); 与模型组比较,各给药组小鼠肺组织IL-6、IL-8 和TNF-α 水平降低(P<0.05),其中以桂枝茯苓丸+EVP4593 组最为显著(P<0.05),见表4。
表4 各组小鼠肺组织IL-6、IL-8 和TNF-α 水平比较(pg/mL,±s)Tab.4 Comparison of IL-6,IL-8 and TNF-α levels in mouse lung tissue of each group (pg/mL,±s)

表4 各组小鼠肺组织IL-6、IL-8 和TNF-α 水平比较(pg/mL,±s)Tab.4 Comparison of IL-6,IL-8 and TNF-α levels in mouse lung tissue of each group (pg/mL,±s)
注: 与空白组比较,*P<0.05; 与模型组比较,#P<0.05; 与桂枝茯苓丸组比较,△P<0.05; 与EVP4593 组比较,▲P<0.05。
组别动物数/只IL-6IL-8TNF-α空白组828.74±2.9042.26±3.2431.46±4.19模型组686.77±7.31*88.72±5.19*72.44±6.82*桂枝茯苓丸组760.61±6.95#65.64±3.61#46.21±4.07#EVP4593 组872.11±6.13#△77.13±4.59#△62.25±5.38#△桂枝茯苓丸+EVP4593 组750.07±4.74#△▲54.82±5.70#△▲41.72±4.27#△▲
3.5 桂枝茯苓丸对COPD 小鼠肺组织EMT 相关蛋白表达的影响 与空白组比较,模型组小鼠肺组织E-cadherin 蛋白表达降低(P<0.05),α-SMA 蛋白表达升高(P<0.05); 与模型组比较,各给药组小鼠肺组织E-cadherin 蛋白表达升高(P<0.05),α-SMA 蛋白表达降低(P<0.05),其中以桂枝茯苓丸+EVP4593 组最为显著 (P<0.05),见图3、表5。
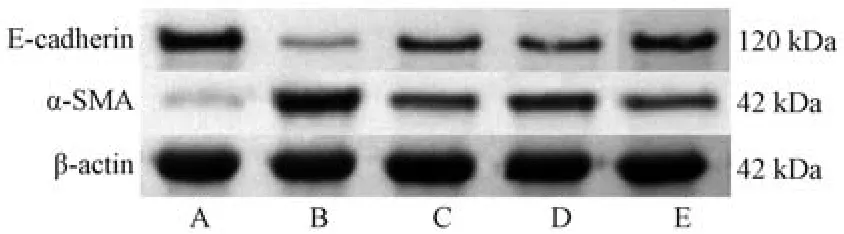
图3 各组小鼠肺组织EMT 相关蛋白条带图Fig.3 Bands of EMT related proteins in mouse lung tissues of each group
表5 各组小鼠肺组织EMT 相关蛋白表达比较(±s)Tab.5 Comparison of EMT-related proteins expressions in mouse lung tissue of each group (±s)

表5 各组小鼠肺组织EMT 相关蛋白表达比较(±s)Tab.5 Comparison of EMT-related proteins expressions in mouse lung tissue of each group (±s)
注: 与空白组比较,*P<0.05; 与模型组比较,#P<0.05; 与桂枝茯苓丸组比较,△P<0.05; 与EVP4593 组比较,▲P<0.05。
组别动物数/只 E-cadherinα-SMA空白组80.53±0.120.07±0.01模型组60.12±0.03*0.63±0.04*桂枝茯苓丸组70.28±0.09#0.30±0.02#EVP4593 组80.27±0.06#0.39±0.02#△桂枝茯苓丸+EVP4593 组70.38±0.04#△▲0.27±0.03#△▲
3.6 桂枝茯苓丸对COPD 小鼠肺组织NF-κB/Snail通路相关蛋白表达的影响 与空白组比较,模型组小鼠肺组织p-IκBα、p-NF-κB 和Snail 蛋白表达升高(P<0.05),p-IκBα/IκBα 和p-NF-κB/NF-κB 比值升高(P<0.05); 与模型组比较,各给药组小鼠肺组织p-IκBα、p-NF-κB 和Snail 蛋白表达降低(P<0.05),p-IκBα/IκBα 和p-NF-κB/NF-κB 比值降低(P<0.05),其中以桂枝茯苓丸+EVP4593 组最为显著(P<0.05),见图4、表6。

图4 各组小鼠肺组织NF-κB/Snail 通路相关蛋白条带图Fig.4 Bands of NF-κB/Snail pathway related proteins in mouse lung tissues of each group
表6 各组小鼠肺组织NF-κB/Snail 通路相关蛋白表达比较(±s)Tab.6 Comparison of NF-κB/Snail pathway related proteins expressions in mouse lung tissue of each group (±s)

表6 各组小鼠肺组织NF-κB/Snail 通路相关蛋白表达比较(±s)Tab.6 Comparison of NF-κB/Snail pathway related proteins expressions in mouse lung tissue of each group (±s)
注: 与空白组比较,*P<0.05; 与模型组比较,#P<0.05; 与桂枝茯苓丸组比较,△P<0.05; 与EVP4593 组比较,▲P<0.05。
组别动物数/只p-IκBαp-IκBα/IκBαp-NF-κBp-NF-κB/NF-κBSnail空白组80.13±0.010.17±0.010.10±0.020.19±0.010.12±0.01模型组60.66±0.06*0.88±0.07*0.57±0.04*0.95±0.07*0.58±0.05*桂枝茯苓丸组70.37±0.04#0.48±0.06#0.28±0.03#0.55±0.06#0.32±0.03#EVP4593 组80.44±0.03#△0.59±0.04#△0.37±0.02#△0.73±0.06#△0.43±0.05#△桂枝茯苓丸+EVP4593 组70.27±0.02#△▲0.39±0.06#△▲0.21±0.02#△▲0.44±0.03#△▲0.26±0.01#△▲
4 讨论
肺不仅多气,还是多血、多津之脏,其性易瘀易滞,在六淫等外来之毒的作用下,肺络受损,反复外感,留痰生瘀,导致络气不畅,日久痰瘀化毒,积伏络脉,痹阻肺络,形成COPD 气道重塑的病理状态[10]。桂枝茯苓丸出自张仲景的《金匮要略》,由桂枝、茯苓、赤芍、牡丹皮及桃仁组成,是活血化痰、消癥通络之名方[17],可使瘀祛痰消、络通毒除,气道通畅,其应用符合“毒损肺络”的中医病机思路。
COPD 气道重塑涉及网状基底膜增厚、胶原沉积、气道纤维化和平滑肌细胞增生等过程[18]。各种炎症因子和生长因子参与了气道的频繁损伤-修复,慢性炎症是气道重塑的重要原因[19]。本实验结果显示,COPD 小鼠肺组织IL-6、IL-8 和TNF-α水平升高,同时伴有大量炎性细胞浸润和细胞外基质(extracellular matrix,ECM) 胶原沉积,符合中医中“毒损肺络、痰瘀痹阻” 的认识; 经桂枝茯苓丸干预后,COPD 小鼠以上指标得到明显改善,提示桂枝茯苓丸可解痰瘀之毒,畅通肺络痹阻。
EMT 是上皮细胞失去其细胞粘附和顶端-基底极性的特征,并获得迁移、侵袭和产生ECM 成分的间充质细胞特性[20]。EMT 的生物标志包括Ecadherin 的丢失,和(或) 间充质标志物的增多,如N-钙粘蛋白、波形蛋白和α-SMA 等[21]。研究表明,EMT 所引发的上皮细胞功能异常在COPD 气道重塑中起重要作用[22]。
NF-κB 是一种具有多向调节作用的核转录因子,正常情况下与IκBα 形成复合体,处于被抑制状态。一些胞外信号 (包括IL-6[23]、IL-8[24]和TNF-α[6]等炎性因子) 在膜受体的介导下,可激活IκB 激酶,进而磷酸化IκBα,使其泛素化降解,最终导致NF-κB 解除抑制而激活,易位到细胞核以促进多种转录因子表达[25]。Snail 蛋白是一种锌指转录因子,已被证实可直接作用于E-cadherin 并抑制其表达,还可上调Vimentin 和Fibronectin 等间充质标志物,从而诱导EMT 的发生[26]。现有研究表明,NF-κB 可通过直接激活、促进转录和阻断泛素化降解等途径增加Snail 的水平[6,8,26-28],NF-κB/Snail 通路在EMT 中的作用已得到广泛共识。本实验结果显示,COPD 小鼠存在气道重塑,同时伴有p-IκBα、p-NF-κB 和Snail 表达增加,p-IκBα/IκBα和p-NF-κB/NF-κB 比值升高,E-cadherin 表达降低和α-SMA 表达增加,并且以上指标均可被EVP4593 (NF-κB 信号阻断剂) 所抑制,提示NFκB/Snail 通路介导了EMT 的发生,并可能是COPD小鼠气道重塑的重要原因。桂枝茯苓丸组与EVP4593 组结果相似,提示桂枝茯苓丸可通过抑制NF-κB/Snail 通路介导的EMT 来改善COPD 气道重塑。两者合用疗效比单用更好,提示桂枝茯苓丸的治疗机制可能涉及多种途径,还有待进一步探索。
综上所述,本研究证实了NF-κB/Snail 信号通路所介导的EMT 参与了COPD 气道重塑,而桂枝茯苓丸可能通过“活血化痰、消癥通络” 改善以上过程。

