吞噬和细胞运动蛋白1在炎性关节病的作用
杨惠丹,程浩,温鸿雁
吞噬和细胞运动蛋白1(engulfment and cell motility 1,ELMO1)是固有免疫的关键蛋白,在免疫细胞的吞噬、迁移和侵袭中起重要作用。已有研究表明其异常表达与肝癌、胶质瘤、卵巢癌、乳腺癌等肿瘤细胞的侵袭和转移有关,可能成为一种早期诊断和判断预后的标志物[1]。炎性关节病(inflammatory joint disease,IJD)是一组累及关节及周围组织的慢性自身免疫性疾病,主要包括类风湿关节炎(rheumatoid arthritis,RA)、脊柱关节病及相关的关节炎,如强直性脊柱炎(ankylosing spondylitis,AS)、银屑病关节炎(psoriaticarthritis,PsA)和炎性肠病性关节炎(inflammatory bowel disease arthritis,IBDA)等,其发病机制非常复杂,确切病因尚未阐明。近年来,越来越多的研究发现ELMO1的异常表达可以调节中性粒细胞、巨噬细胞、T细胞、B细胞的迁移、吞噬和促炎细胞因子的产生,增强破骨细胞活性参与骨破坏过程,与多种IJD的发生发展密切相关。本文就ELMO1在免疫细胞功能及炎性关节病中的作用进行综述,旨在拓宽相关疾病的诊疗思路。
1 ELMO1概述
ELMO主要包括ELMO1、ELMO2、ELMO3三种蛋白质,其均能促进细胞吞噬和运动,但在血管、神经调节及糖代谢方面有各自独特的作用[2]。本文重点关注ELMO1,其首次被发现是哺乳动物细胞中与秀丽隐杆线虫CED-12基因同源的基因,是吞噬凋亡细胞和细胞运动所必需的基因[3],在多种自身免疫病中表达异常。
1.1 ELMO1结构及表达
ELMO1包含多个结构域,N端Ras结合结构域(ras binding domain,RBD)和ELMO抑制结构域(ELMO inhibitory domain,EID)与上游调节因子如:小GTP酶、脑特异性血管生成抑制剂1(brain-specific angiogenesis inhibitor 1,BAI1)和Gβγ等结合[4-6];中间ELMO 结构域,在不同真核生物中高度保守;C端PH 结构域和富含脯氨酸的区域与DOCK的SH3结构域结合。胞质分裂作用因子(dedicator of cytokinesis,DOCK)作为鸟嘌呤核苷酸交换因子(guanine nucleotide exchange factor,GEF)激活Ras相关的C3肉毒杆菌毒素底物(ras-related C3 botulinum toxin substrate,Rac),形成ELMO1-DOCK2/5/180-Rac1复合物发挥生物学功能:(1)通过NF-κB、PI3K / AKT、GSK-3β和β-连环蛋白信号通路影响肌动蛋白细胞骨架的动态重塑,调控细胞趋化、迁移以及吞噬作用[7-10];(2)产生TNF-α、MCP-1等炎症因子,启动炎症反应;(3)激活丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPKs)信号通路参与核因子κB受体活化因子配体(receptor activator of nuclear factor-κB ligand,RANKL)诱导的破骨细胞分化,促进骨破坏(图1)。ELMO1在中性粒细胞、巨噬细胞、淋巴细胞、间充质干细胞以及肠道上皮细胞中均有表达,在炎症组织中表达明显上调。
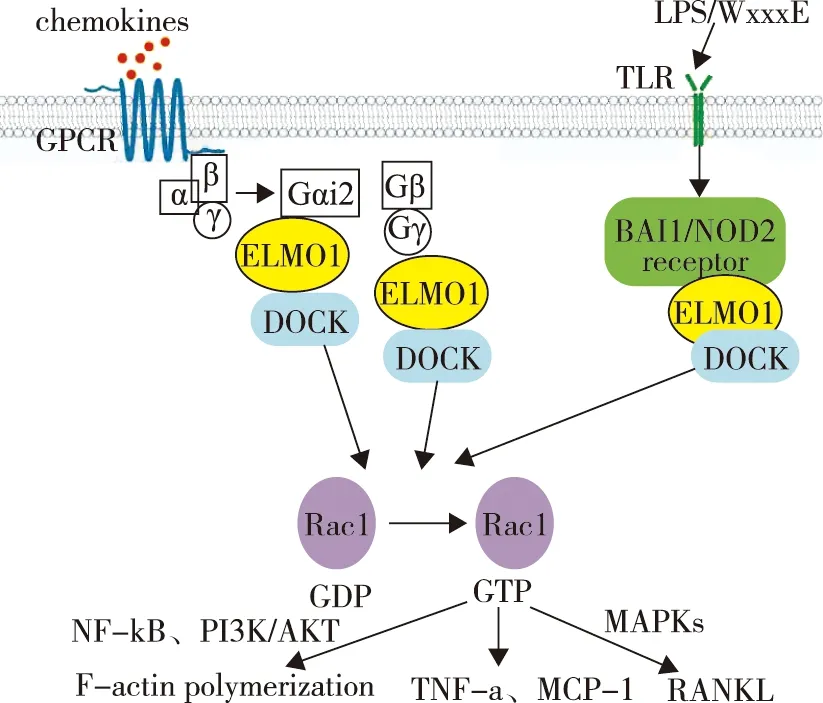
图1 ELMO1信号通路
1.2 ELMO1对免疫细胞的影响
ELMO1促进中性粒细胞和巨噬细胞向炎症部位迁移、巨噬细胞吞噬抗原,进而产生炎性细胞因子启动先天免疫反应。同时,也促进原代T和B淋巴细胞的迁移(图2)。
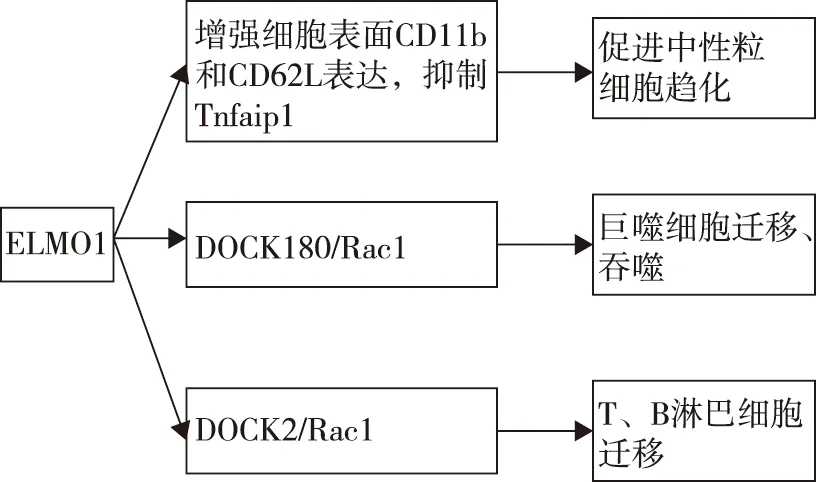
图2 ELMO1对免疫细胞的影响
1.2.1 中性粒细胞:在炎症反应早期,中性粒细胞在白三烯B4(leukotriene B4,LTB4)和趋化因子配体1(CXC-chemokine ligand 1,CXCL1)趋化作用下招募到炎症部位,分泌趋化因子和炎性细胞因子放大炎症反应[11]。Arandjelovic等[12]研究发现ELMO1在早期中性粒细胞诱导的炎症反应中起关键作用,一方面通过调节整合素CD11b、L-选择素CD62L介导的细胞黏附,促进中性粒细胞向LTB4和CXCL1等趋化因子的迁移;另一方面调节炎症相关基因转录,如ELMO1缺陷的中性粒细胞中炎症信号抑制基因Tnfaip1显著上调,从而抑制炎症反应。Xue等[13]在斑马鱼模型体内进一步验证了ELMO1是中性粒细胞趋化所必需的。ELMO1缺陷趋化因子诱导三聚体G蛋白活化并解离为Gα2和Gβγ亚基,两者均可结合ELMO1,激活Rac1,磷酸化PI3K/AKT等促进肌动蛋白聚合;细菌表面LPS或WxxxE基序由胞内模式识别受体BAI1或NOD2识别,结合ELMO1,激活Rac1,一方面促进肌动蛋白聚合,另一方面产生TNF-α、MCP-1等炎症因子,启动炎症反应;此外,ELMO1可以激活MAPKs信号通路参与RANKL诱导的破骨细胞分化,促进骨破坏;ELMO1:吞噬和细胞运动蛋白1;DOCK:胞质分裂作用因子;Rac1:Ras相关的C3肉毒杆菌毒素底物1;GPCR:G蛋白偶联受体;GDP:鸟嘌呤二核苷酸磷酸;GTP:鸟嘌呤三核苷酸磷酸;TLR:Toll样受体;LPS:细菌脂多糖;WxxxE:病原菌效应子;BAI1:脑特异性血管生成抑制剂1;NOD2:核苷酸寡聚结构域2;NF-κB:核因子激活的B细胞的κ-轻链增强;PI3K:磷脂酰肌醇3-激酶;AKT:丝氨酸/ 苏氨酸激酶(蛋白激酶B);TNF-α:肿瘤坏死因子-α;MCP-1:单核细胞趋化蛋白-1;MAPKs:丝裂原活化蛋白激酶;RANKL:NF-κB受体激活因子配体减少中心粒细胞趋化,减轻了局部炎症反应,但总的细胞数量、血清中趋化因子LTB4和CXCL1受体表达没有显著变化,仍然可以攻击入侵的细菌发挥防御作用。
1.2.2 巨噬细胞:巨噬细胞是常见的固有免疫细胞,有吞噬清除病原体及凋亡细胞、提呈抗原、产生促炎细胞因子等作用,参与炎性关节病的发生发展过程。van Ham等[14]发现ELMO1是巨噬细胞吞噬清除凋亡细胞所必需的,ELMO1缺陷的巨噬细胞迁移速度减慢,可以结合凋亡细胞,但不能吞噬清除。ELMO1通过结合上游的BAI1,一种模式识别受体,激活下游DOCK180/Rac通路吞噬凋亡细胞以及病原体[5]。一般来说及时清除细菌或凋亡细胞可减轻炎症及自身免疫。有趣的是,ELMO1并非通过吞噬清除发挥经典抗炎作用,而是促进TNF-α、MCP-1等炎症因子的产生,募集和活化单核细胞启动促炎细胞因子风暴[15]。目前认为可能与吞噬后清除的途径不同有关,ELMO1存在于吞噬小体中,增强组织蛋白酶B的活性和自噬相关蛋白LC3B的积累通过溶酶体介导的自噬清除细菌以诱导先天免疫[16]。此外,在沙门氏菌感染后的骨髓来源单核巨噬细胞中ELMO1上调IL-10和IL-33的表达[17];ELMO1在炎症性肠病固有层巨噬细胞中表达上调,吞噬病原体并产生TNF-α导致肠道炎症[18],而在正常的腹腔巨噬细胞中ELMO1蛋白表达水平降低。
1.2.3 T细胞:T细胞在外来抗原的刺激下迁移到外周血或组织中极化为辅助性T细胞(T helper cells,Th)、调节性T细胞(regulatory cells,Treg)及效应性T细胞,参与免疫应答过程,Th17/Treg、Th1/Th2的平衡与免疫性疾病的发生、发展密切相关。Sanui等[19]用RNA印迹技术检测到ELMO1在T细胞中表达,通过激活DOCK2/Rac1调节肌动蛋白细胞骨架重塑。Stevenson等[20]研究表明ELMO1抑制DOCK2的泛素化降解上调蛋白表达水平,激活Rac促进T细胞迁移,与野生小鼠相比,ELMO1敲除小鼠脾脏和淋巴结中总T细胞(CD3+)数量及细胞表面趋化因子受体CCR7和CXCR4的表达保持不变,向CXCL12的迁移几乎完全丧失。斑马鱼体内实验显示ELMO1缺失的幼虫胸腺中单个T细胞迁移速度显著下降[13]。此外,ELMO1缺失的T细胞可以黏附于细胞间粘附分子1(intercellular cell adhesion molecule-1,ICAM-1)表面,但不能表现出极化表型[20]。ELMO1是否调节T细胞极化导致免疫失衡还需要进一步研究。
1.2.4 B细胞:活化B细胞的募集以及分化为浆细胞产生抗体是自身免疫病发病的关键环节。既往研究中,有关ELMO1与B细胞的研究很少,Sanui等[19]发现ELMO1在B细胞中表达,结合DOCK2/Rac1调节肌动蛋白细胞骨架。ELMO1敲除小鼠脾脏和淋巴结中总B细胞(B220+)数量不变,向CXCL12的迁移明显减少[20]。ELMO1是否影响B细胞的分化及自身抗体的产生还需要进一步去探索。
2 ELMO1在炎性关节病中的作用
2.1 ELMO1与RA
RA是一种复杂的全身性自身免疫病,表现为滑膜炎症和增生、进行性关节软骨和骨破坏,最终导致关节功能丧失、关节畸形以及关节外器官共病,严重影响人类的生活质量[21]。RA早期中性粒细胞聚集到关节局部,产生炎症因子引发慢性炎症。Arandjelovic等[12]发现在胶原诱导的关节炎(collagen induced arthritis,CIA)小鼠和K/BxN血清转移关节炎小鼠爪子提取物,尤其浸润的中性粒细胞中ELMO1、Rac的mRNA及蛋白表达均增加,凋亡细胞吞噬受体BAI1等表达降低;ELMO1敲除小鼠踝关节肿胀程度降低、炎性细胞和促炎因子明显减少、关节炎的严重程度更低,且没有性别差异,表明ELMO1促进早期关节局部中性粒细胞的招募介导炎症反应,而不是通过吞噬途径发挥抗炎作用。此外,ELMO1在RA成纤维样滑膜细胞(fibroblast-like synoviocyte,FLS)中表达,并通过调节Rac1活性促进FLS的迁移和侵袭,导致滑膜增生和软骨破环[22]。ELMO1/DOCK2复合物对激活Rac1信号通路、促进淋巴细胞迁移至关重要,抑制ELMO1/DOCK2复合物形成或相关蛋白可能是治疗RA的潜在靶点[19]。
破骨细胞在RA骨破坏中起重要作用,RANKL与破骨前体细胞表面RANK结合诱导其分化为成熟破骨细胞,骨保护素(osteoclastogenesis inhibitory factor,OPG)可竞争性与RANKL结合,阻止破骨细胞分化,OPG/RANKL/RANK信号系统在维持成骨和破骨的平衡中发挥着重要作用。成熟的破骨细胞附着在骨表面形成肌动蛋白“密封环”促进骨吸收[23]。ELMO1作为一个信号枢纽调节破骨细胞的分化及骨吸收活性,促进骨破坏和骨质疏松的发生。Liang等[24]发现ELMO1通过DOCK5/Rac1通路促进破骨细胞前体细胞的迁移和粘附,并激活AKT和MAPKs信号通路参与RANKL诱导的破骨细胞分化,ELMO1敲除的RA小鼠骨破坏程度降低。也有研究表明在关节炎小鼠模型中ELMO1激活破骨细胞中DOCK2/Rac1,调节细胞骨架重排及骨降解酶定位,增加破骨细胞活性促进骨破坏,降低破骨细胞的骨吸收活性可能比减少破骨细胞数量更有益,一种ELMO1抑制肽靶向其C端α-螺旋抑制信号传导,显着降低了野生型小鼠破骨细胞介导的骨吸收[25]。
ELMO1与RA遗传易感性相关。Whitaker等[22]对RA FLS全基因DNA序列、转录组以及表观基因组综合分析,发现ELMO1是一个重叠的多证据基因,在FLS中表达增加。在一项对RA和乳糜泻共有基因座的荟萃分析中发现了一个人类ELMO1单核苷酸多态性(single nucleotide polymorphism,SNP)位点rs11984075[26];Arandjelovic等证实了ELMO1SNP rs11984075 突变与RA关节炎的发生相关,携带rs11984075的健康供体外周血中性粒细胞ELMO1蛋白表达较正常对照组升高约20%,向LTB的趋化增加[12]。此外,有研究发现ELMO1是非人类白细胞抗原(non-HLA)区域中与幼年特发性关节炎(juvenile idiopathic arthritis,JIA)发病相关性最强的位点之一,而JIA是儿童时期最常见的一种慢性风湿病,临床表现和易感基因位点与RA有高度重叠[27-28]。
2.2 ELMO1与AS
AS是一种病因不明的、以中轴关节慢性炎症及异位骨化为主的自身免疫病,好发于中青年男性。与其他系统性自身免疫病不同之处在于先天免疫系统促进疾病的发生,适应性免疫负责维持炎症过程。Xie等[29]发现TNF-α处理的AS间充质干细胞(AS mesenchymal stem cells,AS-MSC)中甲基转移酶14(methyltransferase-like protein 14,METTL14)介导的ELMO1 N-6甲基腺苷(N6-methyladenosine,m6A)修饰下调,mRNA降解减慢,导致ELMO1表达增加,促进MSC从骨髓定向迁移到炎症部位,分化为成骨细胞并分泌大量的CCL2,诱导单核/巨噬细胞极化为促炎表型,产生TNF-α,加重关节炎症及附着点骨赘形成,更重要的是TNF-α与MSC形成恶性循环。进一步体内实验证实拮抗ELMO1后,AS模型小鼠发病时间延迟、疾病活动度明显降低,局部组织中MSC和巨噬细胞数量减少、TNF-α水平降低。另一项研究发现趋化因子CXCL2通过ELMO1/Rac1信号传导促进骨髓间充质干细胞的迁移以及成脂分化,导致脂肪沉积[30]。破骨细胞是单核/巨噬细胞的一部分,是否ELMO1通过影响巨噬细胞功能参与AS骨侵蚀需要进一步研究。TNF-α拮抗剂如阿达木单抗,是目前常用的生物制剂,但有些患者对其疗效较差甚至无效,可能与ELMO1的表达水平相关。一种DOCK小分子抑制剂,CPYPP可以拮抗ELMO1/DOCK/Rac活性,有很强的抗炎能力[31];mi-RNA也可以靶向ELMO1,减少ELMO1的表达,抑制细胞吞噬[32]。以ELMO1/DOCK/Rac为靶点的抑制剂在AS中可能有很大的应用潜力。
3 总结与展望
综上所述,ELMO1在RA-FLS、AS-MSC以及炎性免疫细胞中表达上调,是趋化因子和炎症因子信号通路的中心环节,介导炎症反应和骨破坏过程,与TNF-α、MCP-1表达、关节炎严重程度和疾病活动度相关,检测这些细胞中ELMO1表达水平可以作为早期炎症的替代诊断指标。此外,ELMO1 SNPs如SNP rs11984075在功能和遗传水平上与人类关节炎相关,筛选这些SNPs可能是评估关节炎易感性的潜在生物标志物。迄今为止,大多数与自身免疫病相关的研究和治疗仍然集中在调节T、B细胞分化和中和TNF-α等细胞因子上,然而有些患者对其疗效较差甚至无效。ELMO1是更上游的调节分子,主要影响先天免疫系统,在自身免疫病早期发挥作用,靶向ELMO1/DOCK/Rac信号复合物可以从源头上抑制炎症反应的发生,提高应答率和持续缓解率。ELMO1可能是潜在的治疗靶点,但既往大多数研究基于关节炎动物模型,暂无靶向ELMO1的药物报道。目前很多机制尚未完全阐明:首先,ELMO1促进炎性免疫细胞向发炎关节的迁移,在启动炎症反应中起关键作用。异常的DNA或RNA甲基化修饰参与RA和AS等炎性关节病的发生发展,ELMO1位点的甲基化水平可能调节其表达水平,进而参与炎性关节病的发生发展。其次,ELMO1可能调节NF-κB、PI3K/AKT、MAPK、RANKL等活性促进关节炎以及骨质疏松的发生。最后,ELMO1在T、B淋巴细胞主导的适应性免疫调节和免疫平衡中的作用需要进一步研究。深入探讨ELMO1在炎性关节病发病机制中的重要作用,可能为相关疾病的诊治提供新思路。

