揭秘彩虹管现象*
——制作彩虹管的实验探究
李曼曼 李德前
(1.睢宁县岚山中学 江苏 徐州 221217;2.徐州市西苑中学 江苏 徐州 221002;3.徐州市李德前化学名师工作室 江苏 徐州 221002)
酸碱中和反应是初中阶段非常重要的反应类型。如果在酸或碱溶液中预先加入指示剂再进行中和反应,那么反应期间由于酸碱混合液上下各部分的酸碱度不同,溶液中就会出现好几层不同的颜色,像彩虹一样,我们形象地称之为“彩虹管”实验[1]。
天然酸碱指示剂含有的色素种类多,能够呈现多种不同的颜色(如黑枸杞酸碱指示剂能呈现的颜色有玫红、红、粉、紫、蓝、绿、黄等10多种),这就为彩虹管实验提供了能呈现多彩现象的变色条件。
一、问题的提出
前不久,我们做了如下实验:在一支试管中加入适量的稀盐酸,滴加了几滴黑枸杞指示剂(溶液呈现玫红色),然后逐滴加入氢氧化钠溶液,随着反应不断进行,溶液逐渐分出了好几层颜色,从底到上分别呈现黄、黄绿、绿、蓝、紫、粉、玫红等颜色,色层之间还有渐变过渡层(见图1,左边是实物图、右边是示意图),宛若彩虹,煞是漂亮,且很稳定(在静置条件下,该现象可以维持5小时以上)。
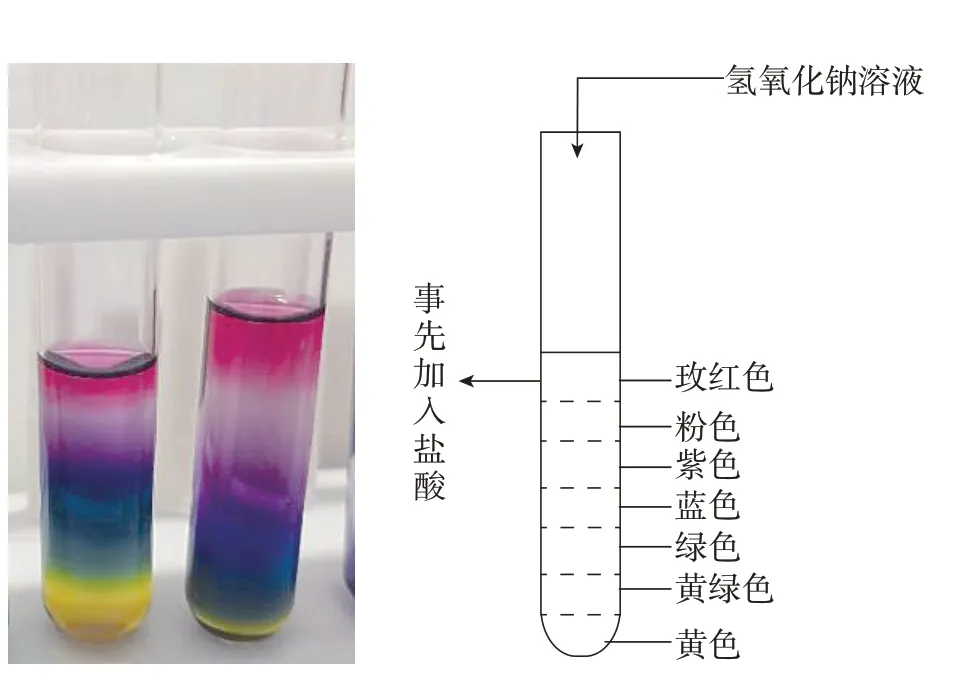
图1 在试管里借助中和反应做彩虹管实验
之后,我们又反向用盐酸加入滴有黑枸杞指示剂的氢氧化钠溶液中,却发现难以出现彩虹管现象。那么呈现彩虹管现象的原因和条件是什么呢?我们进行了如下实验探究。
二、猜想与假设
1.主要猜想
因为是氢氧化钠溶液滴入稀盐酸中出现彩虹管现象,猜想之一可能是氢氧化钠溶液密度大于稀盐酸,所以倾向于向溶液下方运动,形成对流,加之氢氧化钠溶液将重力势能转化为动能,加速对流,使得氢氧化钠溶液未完全被盐酸消耗便沉入底部,溶液从底到上分别呈现碱性、中性、酸性。我们查找了氢氧化钠溶液和盐酸的浓度与密度表(见表1),并做成双曲线图(见图2)。
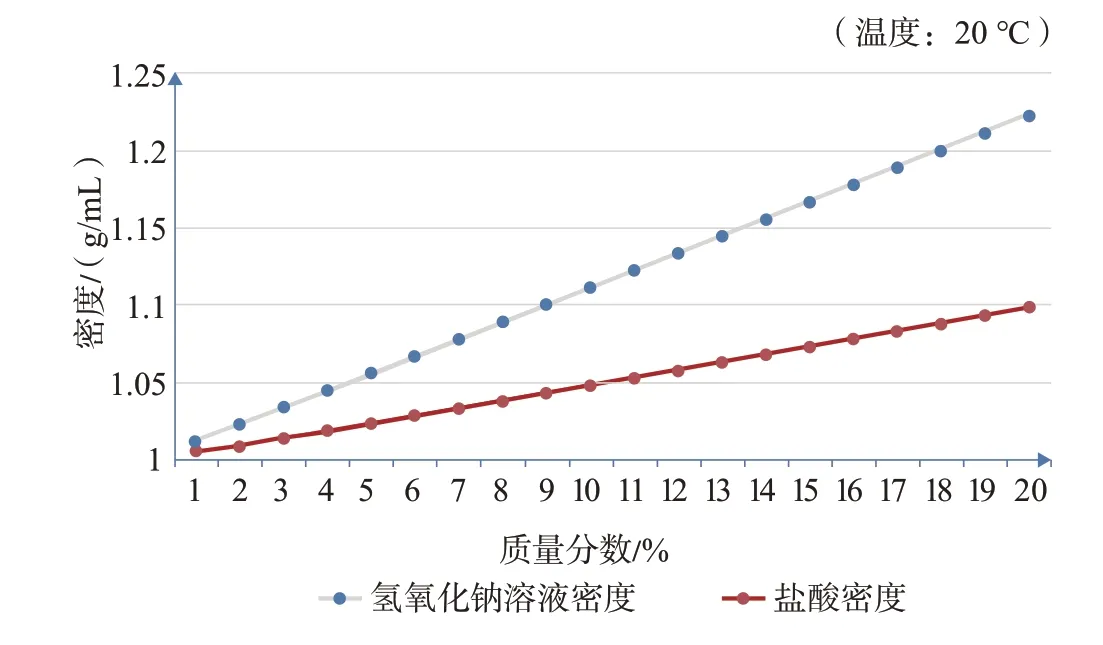
图2 氢氧化钠溶液与盐酸密度比较

图3 用10%氢氧化钠溶液逐滴加入5%稀盐酸中的先后现象
由上图可知,同等浓度的氢氧化钠溶液和盐酸,前者密度均大于后者,且浓度越大,密度相差越大,实验室常用的稀盐酸浓度是8.5%左右(1∶4的盐酸),氢氧化钠溶液浓度在10%左右,所以证实了我们的猜想之一。
2.其他猜想
除了反应物的密度、浓度有影响外,决定彩虹管现象的可能还有试管中盐酸溶液高度和试管口径以及试管形状等。另外,不同酸碱指示剂的种类也决定彩虹管呈现色层现象不同。
三、初探——溶液浓度对彩虹管实验的影响
本组实验统一选用15 mm×150 mm 试管,盐酸取6 mL,在试管内所占高度约为45 mm,均选用了黑枸杞指示剂作为酸碱指示剂。实验时,固定好试管,采用将氢氧化钠溶液逐滴滴入盐酸中的方法。
1.实验一
先在10%的盐酸中滴入3 滴黑枸杞指示剂,再将不同浓度的氢氧化钠溶液分别滴入10%盐酸中(不要将氢氧化钠溶液注入盐酸中,以防过量、搅动色层),实验分析数据见表2。

表2 不同浓度氢氧化钠溶液分别滴入10%盐酸中
2.实验二
先在5%的盐酸中滴入3滴黑枸杞指示剂,再将不同浓度氢氧化钠溶液分别滴入5%盐酸中(不要将氢氧化钠溶液注入盐酸中,以防过量、搅动色层),实验分析数据见表3。
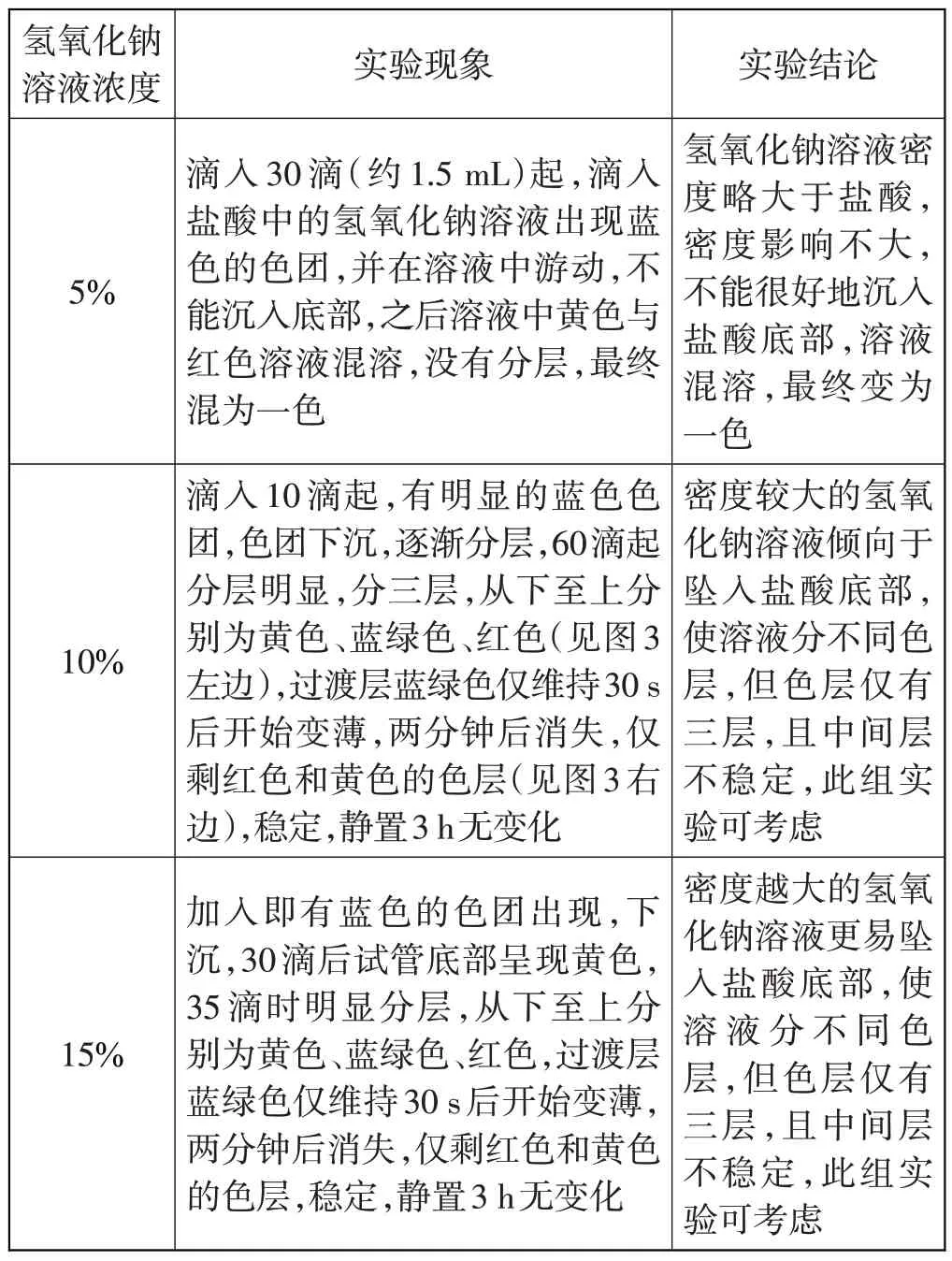
表3 不同浓度氢氧化钠溶液分别滴入5%盐酸中
通过上述两组6个实验初步得出如下结论:
(1)溶液密度确实影响彩虹管实验,在该实验中,氢氧化钠溶液的密度要明显大于盐酸的密度,且接近或者略大都不合适。
(2)可以做彩虹管的组合有15%氢氧化钠溶液与10%盐酸,10%氢氧化钠溶液与5%盐酸,15%氢氧化钠溶液和5%盐酸。其中,10%氢氧化钠溶液加入5%盐酸中现象最佳。
在上述实验中,仅有三层色层现象,且中间层不稳定,那么要形成相对稳定的彩虹管实验还有哪些影响因素呢?
四、再探——揭秘相对稳定的彩虹管实验
到底是什么原因不能形成相对稳定的彩虹管实验呢?我们找到之前做实验的氢氧化钠溶液再试了一次发现可以复原现象,并观察到实验中有细小的气泡产生。原来,之前用的氢氧化钠溶液是轻微变质的,已经有部分碳酸钠生成的氢氧化钠溶液——原来产生稳定彩虹管现象的秘密还有碳酸钠的作用。
那么碳酸钠的参与到底有什么影响呢?通过色层的分析,我们大胆猜想,彩虹管中从底到上决定溶液酸碱性的溶质分别是氢氧化钠、碳酸钠、碳酸氢钠、氯化钠、氯化氢,它们分别显示强碱性、适中碱性、弱碱性、中性、酸性——这样就解释通了。
众所周知,变质的氢氧化钠溶液中存在碳酸钠,那氢氧化钠溶液中含有多少碳酸钠才能形成美丽的彩虹管现象呢?碳酸钠对溶液密度的影响大吗?
通过反复实验发现:100 mL的15%氢氧化钠溶液中加入约1 g 的碳酸钠固体,或者100 mL 的10%氢氧化钠溶液中加入约0.7 g碳酸钠固体最合适,加入偏多有气泡产生,实验观感不好,加入偏少分层效果不理想。因为加入的碳酸钠量比较少,且使氢氧化钠溶液密度略有增加,实际上对氢氧化钠溶液和盐酸溶液的浓度选择上并未有影响,还用上述分组实验中选择的浓度即可。
五、拓展探究
1.试管内盐酸高度对彩虹管实验的影响
试管内盐酸高度也决定着实验结果,溶液高度越高,氢氧化钠溶液滴入后下沉越慢,在此过程中氢氧化钠溶液还没来得及坠入底部可能已经被盐酸消耗完,就不能呈现分层现象了。
我们将15%氢氧化钠溶液分别滴入5%盐酸中,盐酸分6 种高度,即20 mm、30 mm、50 mm、70 mm、90 mm、110 mm;通过实验发现,试管中盐酸的最佳高度在30~70 mm 之间,有效高度在20~110 mm 之间,超出110 mm 时溶液混溶不分层,低于20 mm 时溶液高度不够,不利于观察分层现象。
需要注意的是,如果盐酸高度较高,超出70 mm时,需要浓度较大的氢氧化钠溶液,例如15%以上。
2.试管口径粗细对彩虹管实验的影响
经过几次试验发现,试管的口径大小对彩虹管实验的影响不大。通常口径为15~20 mm之间的试管,既现象明显,又节省试剂。
不建议更换太大口径的试管(例如30 mm以上口径的),这样会造成药品浪费。
3.不用试管能否做成彩虹管实验
事实上,从趣味性考虑,利用弯曲管、U 形管、物理连通器也能做彩虹管实验(见图4,左边是实物图、右边是示意图)。
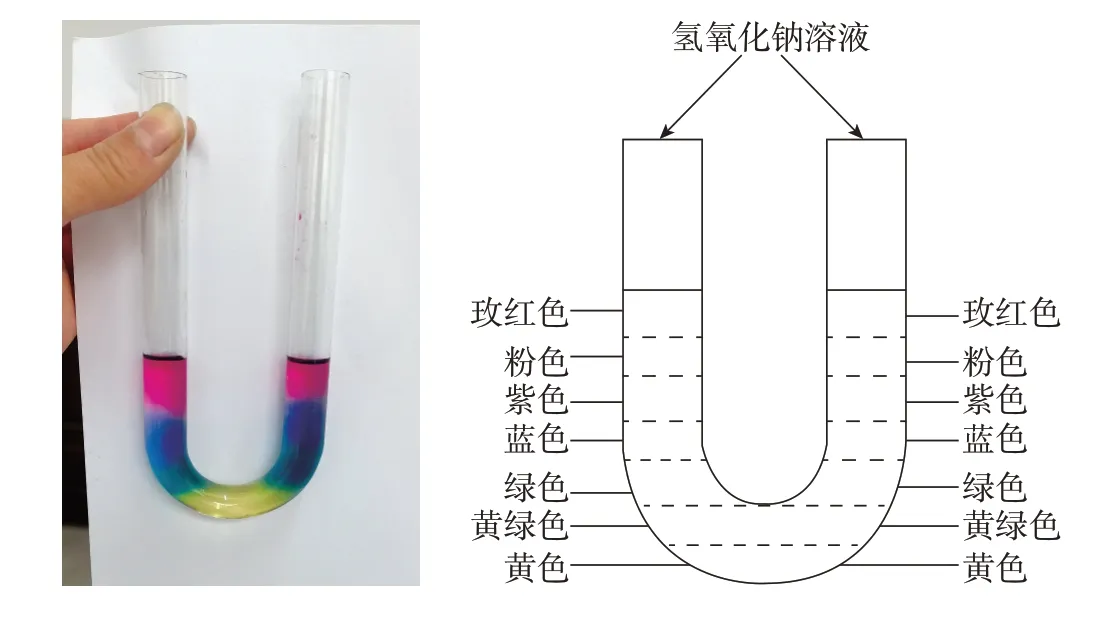
图4 在U形管里借助中和反应做彩虹管实验
如用U形管(150 mm×15 mm)做该实验[2],也是事先在U形管中加入40 mm高度的5%盐酸,先滴入3~5滴黑枸杞指示剂并振荡,溶液变为玫红色;然后分别向两个支管同时逐滴滴入15%的氢氧化钠溶液,然后也会出现分层现象,并与试管中现象一致,因为是双管,实验也更加有趣。
需要说明的是,上述彩虹管实验涉及的都是放热反应,从而引起混合溶液温度略有上升、密度略有减小;由于采用的是密度大的氢氧化钠溶液加入密度小的盐酸中,密度差变大对反应现象是正向的影响,因此可以忽略反应放热对该实验的影响。
六、结语
通过上面的研究可知,形成彩虹管实验的必要条件是在盐酸(溶质质量分数在5%~10%之间)中事先滴入适量黑枸杞指示剂,再将含有少量碳酸钠的氢氧化钠溶液(溶质质量分数在10%~15%之间)逐滴滴入盐酸溶液中。形成彩虹管实验的辅助条件是在试管或U形管中做此实验,需要控制盐酸液面高度在30~70 mm之间,试管或U形管的口径选择15~20 mm之间。
本文仅仅探究黑枸杞指示剂在氢氧化钠溶液和盐酸反应时形成彩虹管的原因及影响因素,实际上其他酸碱溶液、植物酸碱指示剂,也应该在某些条件下可以形成类彩虹管现象,不再赘述。

