西方蜜蜂羽化出房蜂王与工蜂形态及生理生化指标比较
金梦杰,李 震,刘建辉,胡俊彦,杨 晨,曾志将*
(1.江西农业大学 蜜蜂研究所,江西 南昌 330045;2.江西省蜜蜂生物学与饲养重点实验室,江西 南昌 330045)
【研究意义】蜜蜂是具有高度信息交流系统和精细分工的社会性昆虫,它们对植物传粉以及维持生态平衡起到至关重要作用[1-2]。蜂群中通常有一只蜂王,数百至数千只雄蜂和数千至数万只工蜂。雄蜂是蜂群中唯一雄性个体,由未受精卵发育而来。而蜂王和工蜂都是雌性个体,它们由相同受精卵发育而来,但由于早期食物质和量的差异以及发育空间的差异导致在形态、生理、行为和寿命上出现显著差异[3]。蜂王与工蜂在形态指标以及生理生化指标差异尚没有系统报道。【前人研究进展】级型分化一直是蜜蜂生物学研究热点,现有结果表明:幼虫发育空间大小[4],食物质量和数量[5-7],基因表达差异[8-9],DNA甲基化[10-11],组蛋白修饰[12-13],microRNAs[14-15],poly(A)尾[16],表观遗传修饰[17]等因素均影响蜜蜂的级型分化。蜂王与工蜂身体构造方面差异主要表现在:蜂王比工蜂体型更长,体质量是工蜂的2~3 倍,尤其是腹部比工蜂更大。另外蜂王无臭腺,蜡腺、花粉刷和花粉栉均已退化,且蛰针粗短,只有少数倒刺。工蜂有臭腺、蜡腺,上颚腺发达,后足适应采集花粉而特化出花粉筐[18]。蜂王与工蜂的繁殖器官和繁殖能力也有较为明显的差异:蜂王卵巢发育完全,单侧卵巢管数量可达150~180 根,每日产卵量可达1 500~2 000 粒;工蜂生殖功能丧失,是生殖器官发育不全的雌性蜂,单侧卵巢管数量只有3~26 根[19-20],正常蜂群中,工蜂卵巢发育会被蜂王和幼虫信息素抑制[21-22],只有当蜂群中失王时,工蜂卵巢才会得到发育。蜂王和工蜂分工差异表现在:蜂王主要任务就是产卵繁殖后代。待其性成熟时,处女王与数十只雄蜂交配,将精液储存在受精囊中,供其一生产卵,而未交配的处女王只能产未受精卵[10,13-14];而工蜂承担蜂群内所有劳动,其工作内容随日龄变化而变化,承担保温、清理巢房、调制蜂粮、分泌王浆、饲喂幼虫和蜂王、泌蜡造脾、夯实花粉、酿造蜂蜜、守卫巢门、采蜜采粉等工作[23-24]。另外蜂王和工蜂寿命也存在巨大差异:蜂王寿命可达3~5 年,而工蜂在生产季节,寿命只有4~6 周[25]。【本研究切入点】尽管蜜蜂级型分化机理研究较为深入,但目前还没有见到蜂王与工蜂形态和生理生化指标差异系统比较报道。本研究提出系统比较蜂王与工蜂形态和生理生化指标差异,将有助于更全面理解蜜蜂级型分化机理。【拟解决的关键问题】本研究拟通过测定西方蜜蜂蜂王与工蜂常规的翅膀、后足、背板、腹板等形态指标,以及蜂王与工蜂血淋巴中蛋白、氨基酸代谢、糖代谢、脂代谢等生理生化指标,进一步系统分析西方蜜蜂蜂王与工蜂两者的差异。
1 材料与方法
1.1 试验材料
试验蜂群使用西方蜜蜂(Apis mellifera)中的意大利蜜蜂(Apis mellifera ligustica),采用标准饲养方法饲养[3]。在蜂群育王季节,随机选取3 群势为9~10 框的蜂群作为试验蜂群,分别用隔王栅控制蜂王在意蜂免移虫巢脾上产卵6 h。将意蜂免移虫巢脾上带有0 日龄卵的托虫器取下与产浆条组装起来,放入继箱中培育蜂王;免移虫巢脾上余下的卵放入蜂群中哺育。然后分别取3群试验蜂群培育的刚羽化出房处女蜂王和刚羽化出房工蜂,数量分别在100~150只。
1.2 主要试剂与仪器
昆虫卵黄原蛋白(vitellogenin,VTG)和保幼激素(juvenile hormone 3,JH 3)ELISA 试剂盒(96T,上海臻科生物科技有限公司),昆虫ELISA 试剂盒(96T,上海臻科生物科技有限公司),总蛋白(total bilirubin,TP)、球蛋白(globulin,GLO)、谷丙转氨酶(alanine transaminase,ALT)、谷草转氨酶(aspartate transaminase,AST)、葡萄糖(glucose,GLU)、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TGL)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL)、低密度脂蛋白胆固醇(low density lipoprotein cholesterin,LDL)、肌酐(creatinine,CRE)、尿酸(uric acid,UA)、乳酸脱氢酶(lactic dehydrogenase,LDH)、肌酸激酶(creatine kinase,CK)、肌酸激酶同工酶(creatine kinase isoenzyme MB,CK-MB)等生化试剂(迈瑞医疗国际有限公司),实验室纯水系统(Master-S15,上海和泰仪器有限公司),意蜂免移虫巢脾及产浆条(江西农业大学蜜蜂研究所研制),0.5 mL 离心管(BS-05-M,biosharp),毛细管(0.3 mm×100 mm,华西医科大学仪器厂),恒温恒湿箱(DHK150S,上海埃开仪器设备有限公司),酶标仪(Synergy HTX,BioTek),离心机(Centrifuge 5430R,Eppendorf),微小物体测量与数据分析系统(中国农业科学院农业环境与可持续发展研究所开发),全自动生化仪(BS-860,迈瑞医疗国际有限公司),体式显微镜(SZ810,重庆奥特光学仪器有限责任公司),镊子(BS-ZER-S-160,biosharp),载玻片(10127105P-G,江苏世泰实验器材有限公司),盖玻片(10101818,江苏世泰实验器材有限公司),解剖针(18-7306,深圳华阳生物技术有限公司)。
1.3 试验方法
1.3.1 蜜蜂形态测定 参照Ruttner[26]提出的形态测定标准,结合第三次全国畜禽遗传资源普查工作办公室下发的《第三次全国畜禽遗传资源普查操作手册(第二册)》蜜蜂形态特征描述部分,本研究选取前翅指标中:前翅长(forewing length,FL)、前翅宽(forewing width,FB)、肘脉a(cubital vein a,a)、肘脉b(cubital vein b,b)、肘脉指数(cubital index,Ci)、前翅翅脉角A4(forewing vein angle A4,A4)、前翅翅脉角B4(forewing vein angle B4,B4)、前翅翅脉角D7(forewing vein angle D7,D7)、前翅翅脉角E9(forewing vein angle E9,E9)、前翅翅脉角J10(forewing vein angle J10,J10)、前翅翅脉角L13(forewing vein angle L13,L13)、前翅翅脉角J16(forewing vein angle J16,J16)、前翅翅脉角G18(forewing vein angle G18,G18)、前翅翅脉角K19(forewing vein angle K19,K19)、前翅翅脉角N23(forewing vein angle N23,N23)、前翅翅脉角O26(forewing vein angle O26,O26)、后翅勾数(number of hindwing hook,HWH);后足指标中:后足胫节长(length of hind leg tibia,Ti)、后足股节长(length of hind leg fermur,Fe)、后足基跗节长(length of hind leg metatarsus,ML)、后足基跗节宽(width of hind leg metatarsus,MT);背板指标中:第3 背板长(length of tergite 3,T3)、第4 背板长(length of tergite 4,T4)、第5 背板绒毛长(length of tergite 5 hair,5 h);腹板指标中:第6 腹板长(length of sternite 6,L6)、第6 腹板宽(width of sternite 6,T6)等26 项形态指标对西方蜜蜂蜂王和工蜂外部形态指标进行测量分析。从体积分数为75%乙醇溶液中分别取出15 只蜂王和工蜂,依次将每只蜂王与工蜂的前翅、后翅、后腿、第3 背板、第4 背板、第5 背板和第6 腹板解剖下来,将第6 腹板用伊红溶液进行染色,再将各个部位分别放在载玻片上,盖上盖玻片,用微小物体形态测量与数据分析系统软件进行图像拍摄及测量[27]。具体翅膀形态指标见图1,后足指标、背板指标、腹板指标等形态指标见图2。

图1 西方蜜蜂羽化出房蜂王与工蜂17个翅膀形态指标Fig.1 Examples of 17 wing morphological parameters comparison between newly emerged queen and worker of Apis mellifera

图2 西方蜜蜂羽化出房蜂王与工蜂后足、背板、腹板等9个形态指标Fig.2 Examples of nine hind leg,tergite,and sternite morphological indicators between newly emerged queen and worker of Apis mellifera
1.3.2 蜜蜂血淋巴提取 用毛细管直接插进刚羽化出房的处女蜂王和刚羽化出房的工蜂背血管吸取血淋巴样品,操作时手指可轻轻触碰腹部促进血淋巴流出[28]。再放入-80 ℃冰箱中保存备用。注意所取得的液体应为透明或淡黄色,若液体中有白色沉淀则表明血淋巴已被污染,则不可取用。
1.3.3 蜜蜂血淋巴中Vg 和JH3 含量测定 Vg 含量与JH3 含量是蜂王与工蜂重要指标,与蜜蜂的级型分化密切相关[29]。Vg 含量与JH3 含量分别采用昆虫卵黄原蛋白(VTG)ELISA 试剂盒、昆虫保幼激素(JH)ELISA 试剂盒测定。测定方法如下:分别设标准样品孔、空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、待测样品孔。在酶标包被板上标准样品孔各加不同浓度的标准品50 µL,在待测样品孔中先加样品稀释液40 µL,然后再加待测样品10 µL(样品最终稀释度为5 倍)。加样将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀。每孔加入酶标试剂100 µL,空白孔除外再用封板膜封板后置37 ℃温育60 min。小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30 s 后弃去,如此重复5 次,拍干。随后每孔先加入显色剂A 50 µL,再加入显色剂B 50 µL,轻轻震荡混匀,37 ℃避光显色15 min 后每孔加终止液50 µL,终止反应(此时蓝色立转黄色)。以空白孔调零,450 nm 波长依序测量各孔的吸光度(OD值)。再用标准物的浓度与OD值计算出标准曲线的直线回归方程式(y=ax+b),将样品的OD值代入方程式,计算出样品浓度,再乘以稀释倍数,即为样品的实际浓度。
1.3.4 蜜蜂血淋巴生化指标测定 生化指标可反应生物体状态,与昆虫的生长、代谢密切相关[30-31],蜂王与工蜂血淋巴中各生化指标的测定可进一步表明蜂王与工蜂之间的差异。蜜蜂血淋巴中生化指标采用全自动生化分析仪及其配套生化试剂盒进行测定。用毛细管从刚羽化出房的处女蜂王和刚羽化出房的工蜂腹部腹节间处吸取新鲜血淋巴样品,每个样品0.4 mL(共6 个重复),将待测样本转移至全自动生化仪的样本架中。在仪器的操作界面上选择总蛋白(TP)、球蛋白(GLO)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、葡萄糖(GLU)、总胆固醇(TC)、甘油三酯(TGL)、高密度脂蛋白胆固醇(HDL)、低密度脂蛋白胆固醇(LDL)、肌酐(CRE)、尿酸(UA)、乳酸脱氢酶(LDH)、肌酸激酶(CK)、肌酸激酶同工酶(CK-MB)等14项生化指标。再根据全自动生化仪的要求,通过测定不同浓度标准品(100%、80%、60%、40%、20%)进行仪器的校准步骤,以确保测定结果的准确性和可靠性,仪器将根据所选择的测试项目,自动进行样本的处理、试剂的加入、反应的发生和测定结果的读取。
1.4 数据分析与统计
利用Graphpad 8 进行分析形态指标、生理生化指标等数据。数值用平均值±标准差(Mean±SD)表示,并通过t检验进行分析,组间差异有显著意义的概率水平是P<0.05。
2 结果
2.1 西方蜜蜂羽化出房蜂王与工蜂形态指标比较
从表1、2可知:蜂王前翅长、前翅宽、肘脉a、肘脉b、肘脉指数、后翅勾数、前翅翅脉角A4、前翅翅脉角G18、后足胫节长、后足股节长、后足基跗节长、第3 背板长、第4 背板长、第5 背板绒毛长、第6 腹板长、第6腹板宽等16项形态指标都显著高于工蜂(P<0.05);工蜂前翅翅脉角B4、前翅翅脉角D7、前翅翅脉角E9等3 项翅膀形态指标都显著高于蜂王(P<0.05);但两者的翅脉角J10、L13、J16、K19、N23、O26,以及后足跗节宽等7项形态指标差异不显著(P>0.05)。

表1 西方蜜蜂羽化出房蜂王与工蜂17个翅膀形态指标比较Tab.1 Comparative analysis of 17 wing morphological indicators between newly emerged queen and worker of Apis mellifera

表2 西方蜜蜂羽化出房蜂王与工蜂9个后足、背板、腹板指标比较Tab.2 Comparative analysis of nine hind leg,tergite,sternite morphological indicators between newly emerged queen and worker of Apis mellifera
2.2 西方蜜蜂羽化出房蜂王与工蜂血淋巴中Vg和JH3含量比较
由图3 可知,蜂王和工蜂血淋巴中Vg 含量分别为387.1 ng∕mL 和343.6 ng∕mL,蜂王血淋巴中Vg 含量显著高于工蜂(P<0.05);蜂王与工蜂血淋巴中JH3含量分别195.9 ng∕mL和207.2 ng∕mL,但两者之间无显著差异(P>0.05)。
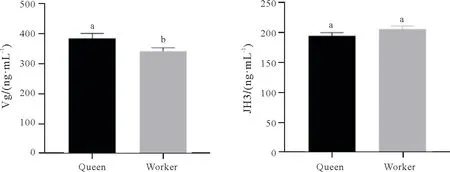
图3 西方蜜蜂羽化出房蜂王与工蜂血淋巴卵黄原蛋白、保幼激素3含量比较Fig.3 Comparison of Vg and JH3 in the haemolymph between newly emerged queen and worker of Apis mellifera
2.3 西方蜜蜂羽化出房蜂王与工蜂血淋巴中蛋白、氨基酸代谢、能量代谢、血脂等生化指标比较
从表3可知:蜂王血淋巴中总蛋白、谷草转氨酶、高密度脂蛋白胆固醇、肌酐、尿酸、乳酸脱氢酶、肌酸激酶、肌酸激酶同工酶等8 项指标含量显著高于工蜂(P<0.05);工蜂血淋巴中葡萄糖、总胆固醇、甘油三酯、低密度脂蛋白胆固醇等4项指标含量显著高于蜂王(P<0.05);蜂王血淋巴球蛋白、谷丙转氨酶与工蜂之间无显著性差异(P>0.05)。

表3 西方蜜蜂羽化出房蜂王与工蜂14个生化指标比较Tab.3 Comparative analysis of 14 biochemical indicators between newly emerged queen and worker of Apis mellifera
3 结论与讨论
蜜蜂是一种高度社会化昆虫,群体中不同级型的蜂各司其职,共同维护蜂群,确保种群的繁衍。蜂王主要负责产卵,繁殖后代;雄蜂主要任务是与处女王交尾,为蜂群的繁衍提供精子,也有研究表明:雄蜂可以刺激工蜂采集积极性[30];工蜂是群体中的劳动力,负责采粉采蜜,饲养幼虫,维护蜂巢等任务[18]。
蜂王与工蜂形态差异主要表现在,蜂王比工蜂体质量体长都要大,腹部也更长。蜂王是繁殖蜜蜂的雌性个体,具有发育完全的卵巢,负责产卵和维持蜂群的繁衍,工蜂的卵巢则是不完全发育。蜂王腺体和身体构造与工蜂也有不同,蜂王无臭腺,蜡腺、花粉刷和花粉栉均已退化,而工蜂臭腺、蜡腺和上颚腺发达[18]。本研究结果表明蜂王形态指标显著大于工蜂。蜂王第3背板、第4背板、第6腹板指标显著大于工蜂,可能由于蜂王需要有更大的腹部空间来容纳更大的卵巢、储精囊及发育中的卵等。另外,蜂王需要大量的营养和能量来支持繁殖活动。较大的腹部空间也提供了更多的储存空间,以满足其营养需求。蜂王前翅相较工蜂更长更宽,且有更多翅勾数,这有利于婚飞[18]。
本研究发现蜂王血淋巴中卵黄原蛋白含量显著高于工蜂,高水平卵黄原蛋白是蜂王维持高产卵力前提。蜂王血淋巴中JH3 含量虽然与工蜂无显著差异,但工蜂有高于蜂王的趋势。高水平卵黄原蛋白和低水平保幼激素与长寿相关[32]。本研究发现蜂王血淋巴中含有更高的总蛋白(TP)、谷草转氨酶(AST)、高密度脂蛋白胆固醇(HDL)、肌酐(CRE)、尿酸(UA)、乳酸脱氢酶(LDH)、肌酸激酶(CK)、肌酸激酶同工酶(CK-MB)等,而工蜂血淋巴中则含有更高的葡萄糖(GLU)、总胆固醇(TC)、甘油三酯(TGL)、低密度脂蛋白(LDL)等。有研究表明:饲料蛋白水平也会影响血淋巴中蛋白含量[33],显然蜂王血淋巴蛋白含量高可能是由于蜂王所食蜂王浆中蛋白丰富所致,也正顺应了蜂王高繁殖力与长寿对高蛋白含量的要求。尿酸是核酸代谢产物,也是一种非酶抗氧化剂,蜂王抗氧化能力比工蜂更强可能与蜂王尿酸含量高有关[34-35]。谷草转氨酶是非必需氨基酸形成、氮废物代谢、糖异生和蛋白质合成代谢和分解代谢的关键酶[36],乳酸脱氢酶、肌酸激酶同工酶与能量代谢相关[37-38],这些酶可能与适应蜂王高繁殖力有关。多项研究表明高密度脂蛋白是长寿有效预测因子,它可以有效清除自由基与低密度脂蛋白,从而减少机体的氧化损伤,增加寿命[39-40]。高密度脂蛋白与脂质和固醇的转运有关[41],可能在昆虫卵发生过程中为卵巢提供蛋白质和脂质。甘油三酯可以影响低密度脂蛋白运输,并影响脂肪储存[42]。因此蜂王高水平高密度脂蛋白、低水平低密度脂蛋白与甘油三酯可能与蜂王长寿相关。
目前还不清楚蜂王与工蜂形态和生理生化指标差异的调控具体分子机理,以及生理生化指标与形态指标之间存在潜在联系。深入研究以上科学问题,研究结果有望为优质蜂王培育和蜜蜂资源保护提供全新思路。

