基于CT影像学指标和临床病理特征构建预测胆囊癌病人预后的列线图模型
杜森,鲍志国,周青
作者单位:河南大学第一附属医院影像科,河南 开封475000
胆囊癌是胆管系统中常见的肿瘤,早期缺乏特异性临床症状,侵袭性强、恶性程度高[1]。胆囊癌病人有效延长生存期的方法是根治性手术,但晚期病人不适合行根治性切除术[2]。目前,第8版美国癌症联合委员会(AJCC)TNM分期系统广泛应用于评估胆囊癌病人的临床结果,但临床研究发现相同TNM分期病人预后可能不同[3]。CT检查可通过分析胆囊癌临床病理及影像特征,获得病人术前全面的状态信息[4]。列线图(Nomogram)统计预测模型具有操作简单、可读性强的特点[5]。目前,已有基于CT的Nomogram预测胆囊癌病人根治性切除后的生存率研究,但在临床应用上具有一定局限性[6]。本研究旨在通过分析行切除术的胆囊癌病人CT影像特征,构建基于CT影像学指标和临床病理特征的Nomogram模型预测胆囊癌病人预后,为临床及早期预测病人预后提供指导。
1 资料与方法
1.1 一般资料 选取2011年1月至2019年4月河南大学第一附属医院接收的胆囊癌病人284例为研究对象,将胆囊癌病人按1∶1分组,分为建模组及验证组,各142例,对入组胆囊癌病人在术后进行为期3年随访,根据术后病人生存状态(随访截止时间2022年4月)分为生存组(建模组45例,验证组47例)和死亡组(建模组97例,验证组95例)。纳入标准:(1)术后经病理证实为胆囊癌;(2)术前接受CT增强扫描,超声图像资料完整;(3)行胆囊癌外科手术。排除标准:(1)合并心、肾功能严重异常、其他恶性肿瘤者;(2)术前进行放化疗、内分泌治疗;(3)经术前检查证实发生远处转移或腹腔广泛转移等无法接受手术者;(4)围术期死亡病人。本研究经病人签署知情同意书,经河南大学第一附属医院伦理委员会审查后批准同意(批号2010-11098)。
1.2 方法
1.2.1 设备与方法 采用德国西门子螺旋CT,扫描参数:管电压120 kV,管电流为自动,FOV为450 mm×450 mm,旋转时间0.5 s/r,螺距0.984。增强扫描使用高压注射器经肘静脉注射碘佛醇,注射流率3.0 mL/s,剂量1.5 mL/kg,随后注射生理盐水。于注入对比剂后35 s、70 s、180 s进行动脉期、门静脉期及延迟期扫描。将图像传输到GE ADW4.7工作站,采用多平面重建进行图像后处理。
1.2.2 观察指标 收集胆囊癌病人相关资料。由两名放射科医师进行CT影像特征评估。①形态学肿瘤类型;②有无伴发胆囊结石;③侵犯邻近器官,如肝脏侵犯(平扫CT为不明确的低密度病变,门脉期边缘强化)、肝侧受累(肿瘤位于肝脏侧,与肝脏间脂肪间隙尚清晰)、胆管侵犯、十二指肠侵犯、结肠侵犯和其他器官;④观察胆囊病变范围、病变形态、黏膜线、胆道梗阻状况;⑤根据第8版美国癌症联合会与国际抗癌联盟标准对胆囊癌进行TNM分期[3]。临床资料包括胆囊癌病人年龄、性别、糖类抗原125(CA125)、糖类抗原19-9(CA19-9)、癌胚抗原(CEA)、天门冬酸氨基转移酶(AST)、乳酸脱氢酶(LDH)及病人手术等方式。
1.3 统计学方法 SPSS 21.0处理数据。计量资料符合正态分布,以描述,两组间比较采用t检验;计数资料以n描述,两组间比较采用χ2检验。R软件构建预测胆囊癌病人3年内死亡风险的Nomogram模型。P<0.05为差异有统计学意义。
2 结果
2.1 建模组和验证组临床资料及CT影像特征比较 建模组和验证组临床资料及CT影像特征比较,差异无统计学意义(P>0.05),见表1。
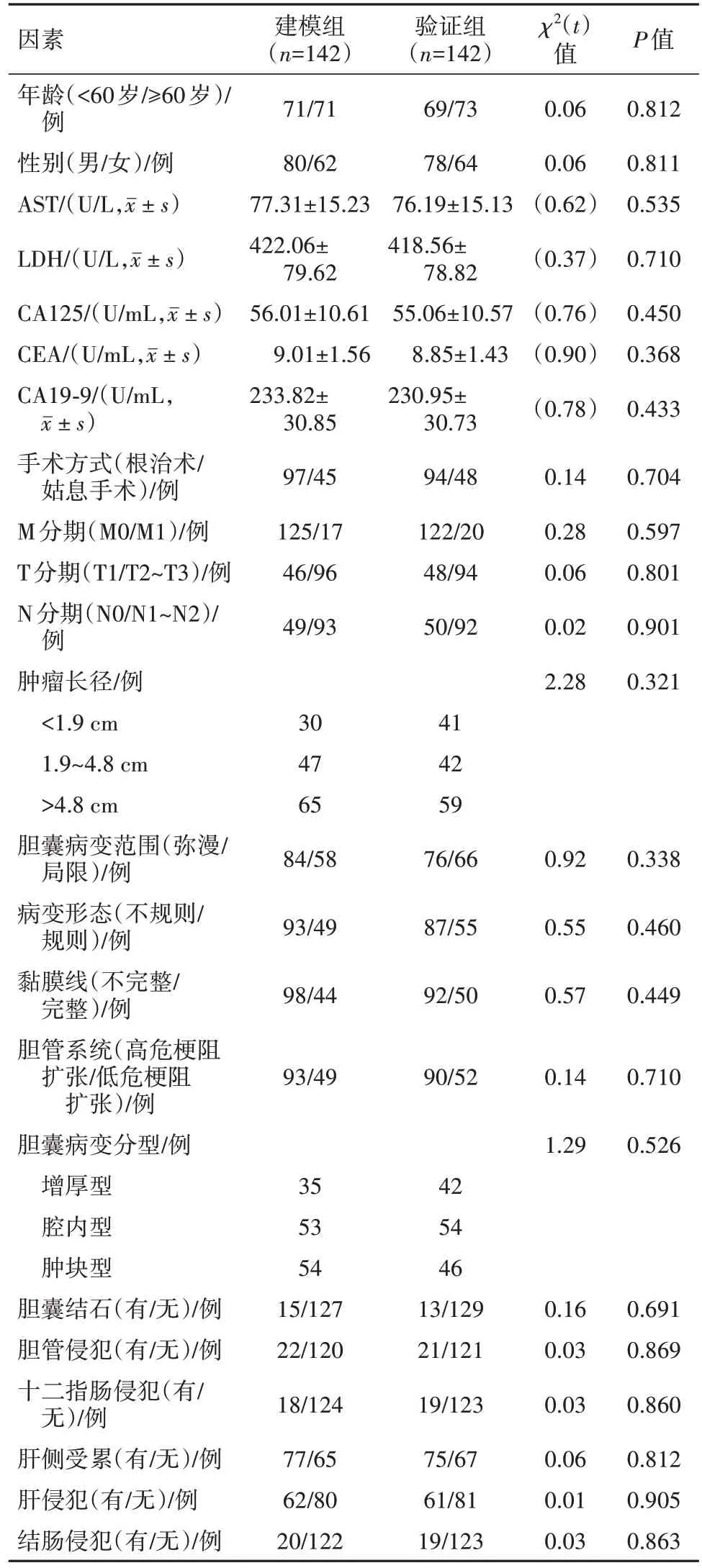
表1 胆囊癌284例中建模组和验证组临床资料及CT影像特征比较
2.2 建模组中生存组和死亡组病人临床资料及CT影像特征比较 生存组年龄≥60岁比例、T分期为T2~T3比例、N分期为N1~N2比例、胆管侵犯比例、十二指肠侵犯比例、肝侧受累比例、肝侵犯比例、结肠侵犯比例低于死亡组(P<0.05)。见表2。

表2 建模组胆囊癌142例中死亡组和生存组临床资料及CT影像特征比较
2.3 建模组胆囊癌病人3年内死亡风险的多因素Cox回归分析 将胆囊癌病人3年内是否发生死亡作为因变量(生存=0,死亡=1),将年龄、T分期、N分期、胆管侵犯、十二指肠侵犯、肝侧受累、肝侵犯、结肠侵犯作为自变量进行分析。Cox回归分析显示,年龄为≥60岁、T分期为T2~T3、N分期为N1~N2、肝侵犯是影响胆囊癌病人3年内死亡的危险因素(P<0.05),见表3。
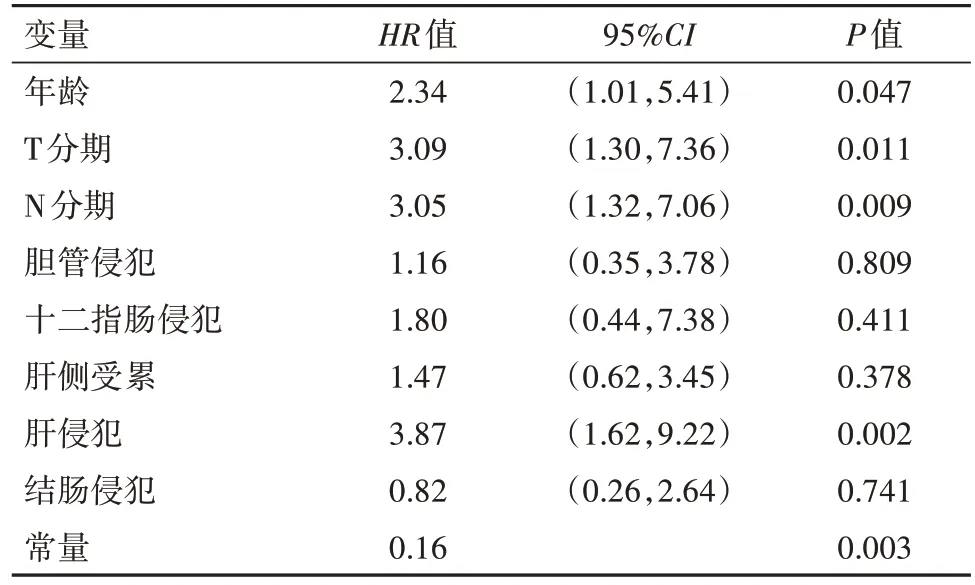
表3 胆囊癌142例3年内死亡风险多因素Cox回归分析
2.4 预测胆囊癌病人3年内死亡风险的Nomogram模型建立 将上述确定的危险因素,建立Nomogram模型。结果显示,年龄≥60岁,Nomogram评分为63分;T分期为T2~T3,Nomogram评分为83.5分;N分期为N1~N2,Nomogram评分为82.5分;肝侵犯,Nomogram评分为100分。见图1。

图1 预测胆囊癌142例3年内死亡风险的Nomogram模型
2.5 预测胆囊癌病人3年内死亡风险的Nomogram模型的验证 建模组受试者操作特征(ROC)曲线下面积为0.79;验证组ROC曲线下面积为0.81。Hosmer-Lemeshow拟合优度检验显示,建模组χ2=6.29,P=0.614(图2);验证组χ2=7.59,P=0.474(图3)。

图2 建模组胆囊癌142例校准曲线

图3 验证组胆囊癌142例校准曲线
3 讨论
2018年报道,全球胆囊癌新增死亡病人约有16.5万例[7]。胆囊癌常规的相关因素是病人预后不良的预测因子,但这些肿瘤相关因素未能完全显示肿瘤病人预后的异质性[8]。手术切除是治愈胆囊癌的主要方法,但仅有10%~30%病人可行根治性手术切除,晚期胆囊癌病人5年生存率低于5%[9]。胆囊癌术后康复状况严重影响病人生活质量。因此,需要寻找快捷地识别接受胆囊癌切除术的病人发生预后不良的方法。
本研究收集了胆囊癌病人临床病理特征资料,经分析显示,年龄为≥60岁、T分期为T2~T3、N分期为N1~N2是影响胆囊癌病人3年内死亡的危险因素,与车小双等[10]研究结果类似。T分期是胆囊癌的重要预后因素[11]。Choi等[6]基于CT建立预测胆囊癌R0切除病人预后的Nomogram,研究结果发现胆囊癌病人预后与广泛浸润基底的肿块型有关,与本研究结果不同,可能与纳入的胆囊癌病人手术方式不同、研究对象有关。研究报道,胆囊癌进展中关键的预后因素是肿瘤分期、侵袭周围组织、远处转移和淋巴结受累[12]。胆囊癌在早期有淋巴结转移倾向,《胆囊癌诊断和治疗指南(2015版)》主张TNM分期T1b至T3期病人进行肝、十二指肠、淋巴结清扫,另外指南认为胆囊癌肝转移途径是通过直接浸润或浸润肝内门静脉,因此淋巴结转移及胆囊癌浸润深度影响病人预后[13]。AJCC标准中N分期评估依据肿瘤是否发生淋巴结转移,T分期评估依据肿瘤浸润深度,本研究与其结果一致[14]。在《胆囊癌规范化诊治疗专家共识(2016版)》中,提到TNM分期及病理组织学可指导临床医生预估肿瘤病人预后,TNM分期也是胆囊癌手术方案选择的重要依据,TNM分期为Tis、T1a期胆囊癌仅需要行胆囊癌切除术,无须二次手术治疗,病人5年生存率约为100%,T1b期以上胆囊癌需要结合病理组织学,精准行胆囊癌根治术或扩大根治术[15]。Li、SONG[16]研究显示,T分期、M分期是胆囊腺癌切除术病人预后预测因子,本研究与其结果一致,但其研究结果侧重于病人临床病理特征,只能对采集的标本判断病理因素,本研究结果CT影像学特征结合病人临床病理特征,具有更广阔的视野判断整个腹腔,在病人术前更容易预测病人预后。在直肠癌神经周围侵犯的研究中,杨彦松等[17]研究显示,高T分期、高N分期增加了肿瘤细胞侵犯周围直肠癌组织灶附近的神经结构的机会。本研究显示Cox分析显示,肝侵犯是影响胆囊癌病人3年内死亡的危险因素。相关研究报道,胆囊颈部肿瘤邻近肝脏,易发生早期肝侵犯,存在肝侵犯的胆囊癌需要扩大淋巴结清扫,且肝三段及右半肝也有可能需要在术中切除,降低胆囊癌根治率,病人易发生预后不良[18]。
Nomogram是数学模型的一种方便的图形表示,它结合了各种重要因素来预测结果事件,总分可映射相应的生存概率[19]。Nomogram为胆囊腺癌病人提供了更准确的预后评估。有研究报道Nomogram已被用于术前预测乙型肝炎病毒相关性肝细胞肝癌微血管浸润[20]。为避免过度拟合,本研究对模型进行内外部验证,显示,建模组的曲线下面积为0.79,验证组的曲线下面积为0.81,表明模型预测区分度良好。建模组、验证组校正曲线预测值与实际值均贴近,表明模型预测准确性良好。本研究验证组:建模组为1∶1,增加了验证组例数,增加了验证组影像学指标和临床数据的收集,提高了验证结果的可信度。本研究的Nomogram模型结合了胆囊癌病人临床病理特征,资料易于收集。
综上所述,本研究基于年龄、T分期、N分期、肝侵犯,4项危险因素建立预测胆囊癌病人3年内死亡风险的Nomogram模型,经验证该模型具有良好的预测准确性,有助于辅助临床医师在术前更好地制定病人治疗方案,改善病人预后。

