Hypocrellin A通过ROS/JNK通路促进瘢痕疙瘩成纤维细胞凋亡的作用及机制
陈雷刚 任慧敏 吴远慧 安国芝 景晓蕾 赵同心
1河北北方学院附属第一医院,河北省张家口市,075000;2河北北方学院,河北省张家口市,075051
瘢痕疙瘩成纤维细胞(keloid fibroblasts,KFs)增殖过度、凋亡异常,进而导致细胞外基质大量沉积在瘢痕疙瘩形成中发挥关键作用,相关研究认为抑制KFs增殖、诱导KFs凋亡对预防或延缓瘢痕疙瘩的形成具有一定临床意义[1-3]。氧化应激和内质网应激是在多种疾病的病理生理条件下异常激活的两种生物学环节,两者之间存在相互影响,氧化应激激活过程中活性氧簇(ROS)大量生成,ROS通过下游信号转导激活内质网应激中的c-Jun氨基末端激酶(JNK)通路,最终引起细胞凋亡。竹红素A(Hypocrellin A,HA)是一种从中草药竹红素中提取得到的光敏剂,用于癌细胞干预显著抑制细胞增殖、促进细胞凋亡并增加ROS生成[4,5],与红光联合使用显著抑制瘢痕疙瘩的生长[6]。但HA本身是否直接影响KFs的凋亡及ROS/JNK通路在HA调控KFs凋亡中的作用尚不明确。本研究设计细胞实验,对HA通过ROS/JNK通路促进KFs凋亡展开探索。
1 材料与方法
1.1 组织标本 瘢痕疙瘩组织标本取自6例因瘢痕疙瘩在我院接受手术切除的患者,其中男2例、女4例,年龄23~34岁、平均(27.14±5.86)岁。本研究获得医院医学伦理委员会批准,与患者签署知情同意书。
1.2 主要试剂及仪器 HA购自南通飞宇生物科技公司,ROS清除剂乙酰半胱氨酸(NAC )购自美国Sigma公司,CCK8细胞增殖检测试剂盒购自上海翌圣生物科技公司,I型胶原(Col-I)、α-平滑肌肌动蛋白(α-SMA)、纤维连接蛋白(FN)的检测试剂盒购自上海酶联生物科技公司,TUNEL细胞凋亡检测试剂盒、ROS检测试剂盒购自上海碧云天生物科技公司,丙二醛(MDA)、超氧化物歧化酶(SOD)、总抗氧化力(T-AOC)检测试剂盒购自南京建成生物工程研究所,GRP78、IRE-1、p-IRE-1、JNK、p-JNK、cleaved caspase-3、β-actin的一抗购自美国Abcam公司。细胞培养箱购自美国Thermo公司,凝胶成像系统购自上海勤翔仪器公司。
1.3 方法
1.3.1 原代KFs的分离培养 取瘢痕疙瘩组织,用磷酸盐缓冲液洗涤3次,用手术刀去除表皮、将剩余的真皮放入0.25%胰蛋白酶中、4℃消化10 h,再次用磷酸盐缓冲液洗涤3次,而后将组织切成1 mm 3小块,加入30倍量0.2% IV型胶原酶并移入50 mL离心管,37℃持续消化至组织变为絮状,用200目筛网过滤后得到单细胞悬液,1000 r/min离心10 min、收集细胞沉淀,用含有10%胎牛血清的培养基重悬并调节细胞密度至2×106个/mL,接种在培养瓶中,定期换液并消化传代,取第3代KFs进行分组处理。
1.3.2 第3代KFs的分组及处理 第3代KFs接种在培养板中进行分组处理,方法如下:对照组用不含药物的培养基处理;不同剂量HA组分布给予含有0.125、0.25、0.5、1.0 μmol/L HA的培养基处理;HA+NAC组用含有1.0 μmol/L HA和1.0 mmol NAC的培养基处理。
1.3.3 细胞增殖的检测 第3代KFs按照6×103个/孔接种在96孔培养板中,培养20 h后按照1.3.2的方法进行分组处理,24 h后每孔加入10 μL CCK8检测液,继续培养2 h,使用酶标仪检测450 nm波长的吸光度(OD)。
1.3.4 细胞凋亡的检测 第3代KFs按照1×104个/孔接种在24孔培养板中,培养20 h后按照1.3.2的方法进行分组处理,24 h后采用TUNEL试剂盒检测细胞凋亡率,按照试剂盒说明书进行操作并在显微镜下观察TUNEL阳性细胞数、即凋亡细胞数以及DAP阳性细胞数、即总细胞数,计算细胞凋亡率=凋亡细胞数/总细胞数×100%。
1.3.5 细胞中Col-I、α-SMA、FN、ROS、MDA、SOD、T-AOC含量的检测 第3代KFs按照1×105个/孔接种在12孔培养板中,培养20 h后按照1.3.2的方法进行分组处理,24 h后加入裂解液提取细胞蛋白,采用试剂盒检测Col-I、α-SMA、FN、ROS、MDA、SOD、T-AOC的含量,Col-I、α-SMA、FN的检测方法为酶联免疫吸附法,ROS检测方法为荧光探针DCFH-DA法,MDA检测方法为硫代巴比妥酸法,SOD检测方法为羟胺法,T-AOC检测方法为二铵盐法,均由同一名人员按照试剂盒说明书进行检测操作。
1.3.6 细胞中蛋白表达的western blot检测 第3代KFs按照1×105个/孔接种在12孔培养板中,培养20 h后按照1.3.2的方法进行分组处理,24 h后加入裂解液提取细胞蛋白,采用BCA法检测浓度后取30 μg蛋白加入聚丙烯酰胺凝胶进行电泳,而后电转至硝酸纤维素膜,5%脱脂牛奶室温孵育1 h,用GRP78一抗(1∶400)、IRE-1一抗(1∶1000)、p-IRE-1一抗(1∶1000)、JNK一抗(1∶800)、p-JNK一抗(1∶800)、cleaved caspase-3一抗(1∶1000)或β-actin一抗(1∶5000) 4℃孵育过夜,次日室温孵育二抗(1∶1000)1 h。最后将硝酸纤维素膜放入凝胶成像系统进行电化学发光,得到蛋白条带,以β-actin的条带灰度值为内参、计算GRP78、p-IRE-1、p-JNK、cleaved caspase-3的蛋白表达水平。
1.4 统计学方法 采用SPSS 22.0软件进行统计学处理,实验数据为计量资料,以均数±标准差表示,组间比较采用单因素方差分析及LSD-t两两比较,P<0.05为差异有统计学意义。
2 结果
2.1 不同剂量HA及ROS清除剂对KFs增殖水平及凋亡率的影响 不同剂量HA组KFs的OD450水平低于对照组,凋亡率高于对照组(P<0.05),且HA剂量越高,KFs的OD450水平越低、凋亡率越高;HA+NAC组KFs的OD450水平高于1.0 μmol/L HA组,凋亡率低于1.0 μmol/L HA组(P<0.05)。见表1、图1。

表1 各组KFs增殖水平及凋亡率的比较
2.2 不同剂量HA及ROS清除剂对KFs中胶原合成的影响 不同剂量HA组KFs中Col-I、α-SMA、FN的含量均低于对照组(P<0.05)且HA剂量越高,KFs中Col-I、α-SMA、FN的含量越低;HA+NAC组KFs中Col-I、α-SMA、FN的含量高于1.0 μmol/L HA组(P<0.05)。见表2。

表2 各组KFs胶原合成的比较
2.3 不同剂量HA及ROS清除剂对KFs中氧化应激水平的影响 不同剂量HA组KFs中MDA的含量均高于对照组,SOD、T-AOC的含量低于对照组(P<0.05),且HA剂量越高,KFs中MDA的含量越高,SOD、T-AOC的含量越低;HA+NAC组KFs中MDA的含量低于1.0 μmol/L HA组,SOD、T-AOC的含量高于1.0 μmol/L HA组(P<0.05)。见表3。

表3 各组KFs氧化应激水平的比较
2.4 不同剂量HA及ROS清除剂对KFs中内质网应激水平的影响 不同剂量HA组KFs中GRP78、p-IRE-1的表达水平均高于对照(P<0.05),且HA剂量越高,KFs中GRP78、p-IRE-1的表达水平越高;HA+NAC组KFs中GRP78、p-IRE-1的表达水平低于1.0 μmol/L HA组(P<0.05)。见表4、图2。

图2 各组KFs中GRP78、p-IRE-1的表达 图3 各组KFs中p-JNK、cleaved caspase-3的表达
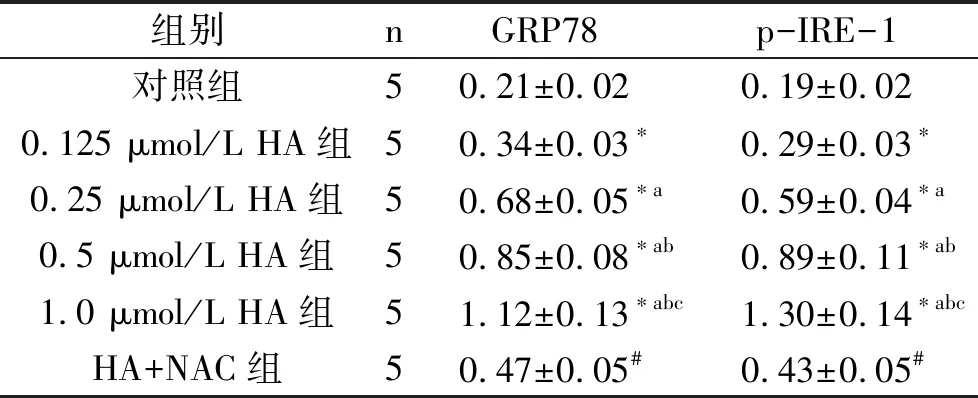
表4 各组KFs中GRP78、p-IRE-1表达水平的比较
2.5 不同剂量HA及ROS清除剂对KFs中ROS/JNK通路的影响 不同剂量HA组KFs中ROS含量及p-JNK、cleaved caspase-3的表达水平均高于对照(P<0.05),且HA剂量越高,KFs中ROS含量及p-JNK、cleaved caspase-3表达水平越高;HA+NAC组KFs中ROS的含量及p-JNK、cleaved caspase-3的表达水平低于1.0 μmol/L HA组(P<0.05)。见表5、图3。

表5 各组KFs中ROS含量及p-JNK、cleaved caspase-3表达水平的比较
3 讨论
KFs增殖和凋亡的异常是导致瘢痕疙瘩形成的关键生物学因素,越来越多的学者开始关注抑制KFs增殖、促进KFs凋亡在瘢痕疙瘩防治中的价值[7、8]。HA是从真菌竹红菌中提取得到的天然光敏化合物,瘢痕疙瘩相关的研究证实HA与光动力疗法联合显著抑制KFs增殖[6],肺癌相关的研究证实单独使用HA能够抑制癌细胞增殖、促进癌细胞凋亡[4],提示HA可以在不与光动力疗法联用的条件下单独发挥调控细胞增殖及凋亡的作用。但HA单独使用在瘢痕疙瘩中的治疗价值尚不清楚。基于此,本研究在原代培养的KFs中初步探索了HA用于瘢痕疙瘩治疗的价值。
瘢痕疙瘩形成过程中成纤维细胞的异常增殖和凋亡会引起细胞外基质异常沉积,出现间质样改变和纤维化表现。相关研究报道,Col-I、α-SMA、FN是瘢痕疙瘩中异常沉积的细胞外基质成分,多种瘢痕疙瘩的治疗手段抑制KFs增殖及Col-I、α-SMA、FN的合成[9-11]。本研究中,不同剂量HA处理KFs后细胞增殖明显减弱、凋亡率明显增加,细胞中Col-I、α-SMA、FN的含量明显降低,表明HA单独使用显著抑制KFs增殖及胶原合成、促进KFs凋亡,进而提示HA可能可以在不与红光等光动力疗法联用的条件下发挥瘢痕疙瘩的治疗价值。
细胞凋亡的调控机制复杂且与氧化应激、内质网应激等多个生物学环节存在相互作用。ROS在生理条件下生成量极低,在不同疾病的病理条件下以及不同药物的刺激下ROS大量生成并造成组织损伤[12,13]。Cheng等[14]的研究显示:瘢痕疙瘩组织中ROS的含量降低,麻艺群等的研究显示:增加ROS生成对KFs增殖具有抑制作用。以上结果提示ROS生成减少与瘢痕疙瘩的形成有关,增加ROS生成有助于抑制瘢痕疙瘩。HA在人表皮癌细胞中的抑制增殖作用与增加ROS生成有关[5]。本研究中,不同剂量HA处理KFs后细胞中ROS含量增加,表明HA促进KFs中ROS生成,进而提示HA可能通过增加ROS生成的方式抑制KFs增殖、促进KFs凋亡。
ROS引起组织损伤、导致细胞凋亡的生物学作用与氧化应激、内质网应激的激活及下游相关信号通路的活化有关。ROS引起氧化应激的过程中,脂质发生过氧化并生成MDA,同时不断消耗抗氧化物SOD、表现为T-AOC降低。ROS刺激内质网、导致错误折叠蛋白聚集、GRP78增加并激活下游内质网应激的多条途径,其中IRE-1途径的激活能够引起JNK磷酸化为p-JNK,后者能够增加cleaved caspase-3生成并介导细胞凋亡[15,16]。在瘢痕疙瘩中,刺激氧化应激和内质网应激、JNK途径的激活对KFs增殖具有抑制作用[17,18]。本研究中,不同剂量HA处理KFs后细胞中MDA含量及GRP78、p-IRE1、p-JNK、cleaved caspase-3的表达,SOD和T-AOC含量降低,表明HA在增加ROS生成的基础上促进KFs中氧化应激、内质网应激及下游JNK/cleaved caspase-3途径发生激活。
为进一步认识增加ROS生成在HA抑制KFs增殖、促进KFs凋亡中的作用,初步揭示HA发挥治疗价值的分子机制,本研究设计了ROS清除剂NAC处理细胞的回复实验。在1.0 μmol/L HA处理的基础上联用NAC后,KFs增殖增强,凋亡及氧化应激、内质网应激减弱,相应ROS/JNK/cleaved caspase-3途径的激活也受到抑制。以上回复实验结果表明ROS清除剂NAC削弱HA对KFs增殖的抑制作用以及凋亡、氧化应激、内质网应激、ROS/JNK通路的激活作用。
综上所述,HA通过抑制KFs增殖、促进KFs凋亡,同时激活ROS/JNK通路介导的氧化应激和内质网应激;结合回复实验,HA对KFs增殖和凋亡的调控作用与激活ROS/JNK通路介导的氧化应激和内质网应激有关。

