6900例泌尿感染科患者HPV感染型别分布研究
王 猛 李文超 孙远航 张 雍 李紫阁 程艳如 于功奇 王 川 田洪青 暴芳芳
山东第一医科大学附属皮肤病医院(山东省皮肤病医院),山东省皮肤病性病防治研究所,山东济南,250022
人乳头瘤病毒(HPV)是一种小分子双链DNA病毒,主要通过性接触传播。HPV根据致癌潜力分为高危型(HR)和低危型(LR)。HR-HPV亚型感染人类上皮细胞,被认为是侵袭性宫颈癌和阴茎癌的病因,LR-HPV亚型与增生性病变相关,包括外生殖器疣和尖锐湿疣,并且具有较低的致癌风险[1]。HPV对人皮肤、黏膜有高度亲嗜性。目前已发现该病毒有200余种亚型,根据不同基因型与癌发生危险性的高低可分为高危型和低危型,其中高危型HPV包括16、18、31、33、35、39、45、51、52、53、56、58、59、66、68、73、82型等,其持续性感染与子宫颈癌的发病及男性阴茎及肛周癌变密切相关;低危型HPV包括6、11、42、43、81、83型等,其感染与外生殖器尖锐湿疣等良性病变有关[2,3]。
为了更好地了解近年来山东地区HPV感染情况,本研究采用PCR-反向点杂交法,选择2021年4月至2023年4月就诊于山东第一医科大学附属皮肤病医院泌尿感染科门诊的6900例患者进行HPV分型检测。
1 资料与方法
1.1 标本来源 选取2021年4月至2023年4月就诊于山东第一医科大学附属皮肤病医院泌尿感染科门诊,且进行HPV分型检测项目的6900例患者。
1.2 标本采集 男性无菌棉拭子插入尿道2~3 cm,轻轻捻动拭子采集分泌物后,立即取出并置于采集管中,密闭送检(采集分泌物前2小时禁小便);女性用无菌生理盐水棉球洗去宫颈外分泌物,再用无菌棉拭子插入宫颈内,停5 s后,旋动棉拭子采集宫颈分泌物,将棉拭子置入无菌管中,密闭送检。尖锐湿疣患者标本的采集用无菌棉拭子刮取包皮、尿道口、大小阴唇、阴道口和肛周赘生物组织液,密闭送检。
1.3 仪器与试剂 使用基因扩增仪(Heam9600)、恒温杂交仪(YN-H48);人乳头瘤病毒基因分型(23型)检测试剂盒,试剂盒与质控品均为亚能生物股份有限公司产品。
1.4 DNA提取及检测 向无菌管中加入1 mL灭菌生理盐水,涡旋震荡,挤干棉拭子。将全部液体转移至1.5 mL离心管中,12000 rpm离心5 min,弃去上清液,保留管底的细胞沉淀,沉淀中加入50 μL DNA 提取液充分混匀,100℃恒温10 min,12000 rpm离心5 min。根据试剂盒操作说明,吸取5 μL上清液作为模板加入反应管中进行PCR反应。扩增参数及结果判定严格按照试剂盒说明书进行。
1.5 统计学方法 采用SPSS 27.0 统计学软件进行数据分析,率的比较采用χ2检验,P<0.05 即为存在统计学差异。
2 结果
2.1 HPV感染情况 本次调查显示,6900例次中 HPV感染例数为4377例,阳性率为63.43%(4377/6900)。针对型别进行亚组分析,HPV(11)型阳性1011例,阳性率为14.65%,其中女性患者251例(11.97%),男性患者760例(15.82%),性别之间存在统计学差异(P<0.01);HPV(16)型阳性586例,阳性率为 8.49%,其中女性患者203例(9.68%),男性患者383例(7.97%),性别之间存在统计学差异(P<0.05);HPV(33)型阳性216例,阳性率为3.13%,其中女性患者86例(4.10%),男性患者130例(2.71%),两者差异有统计学意义(P<0.05);HPV(51)型阳性433例,阳性率为6.28%。其中女性患者153例(7.30%),男性患者280例(5.83%),两者差异有统计学意义(P<0.05);HPV(52)型阳性582例,阳性率为8.43%。其中女性患者221例(10.54%),男性患者361例(7.52%),两者差异有统计学意义(P<0.05);HPV(53)型阳性412例,阳性率为5.97%。其中女性患者148例(7.06%),男性患者264例(5.50%),两者差异有统计学意义(P<0.05);HPV(58)型阳性354例,阳性率为5.13%。其中女性患者147例(7.01%),男性患者207例(4.31%),两者差异有统计学意义(P<0.01);HPV(59)型阳性373例,阳性率为5.41%。其中女性患者132例(6.29%),男性患者241例(5.02%),两者差异有统计学意义(P<0.05)。见表1。
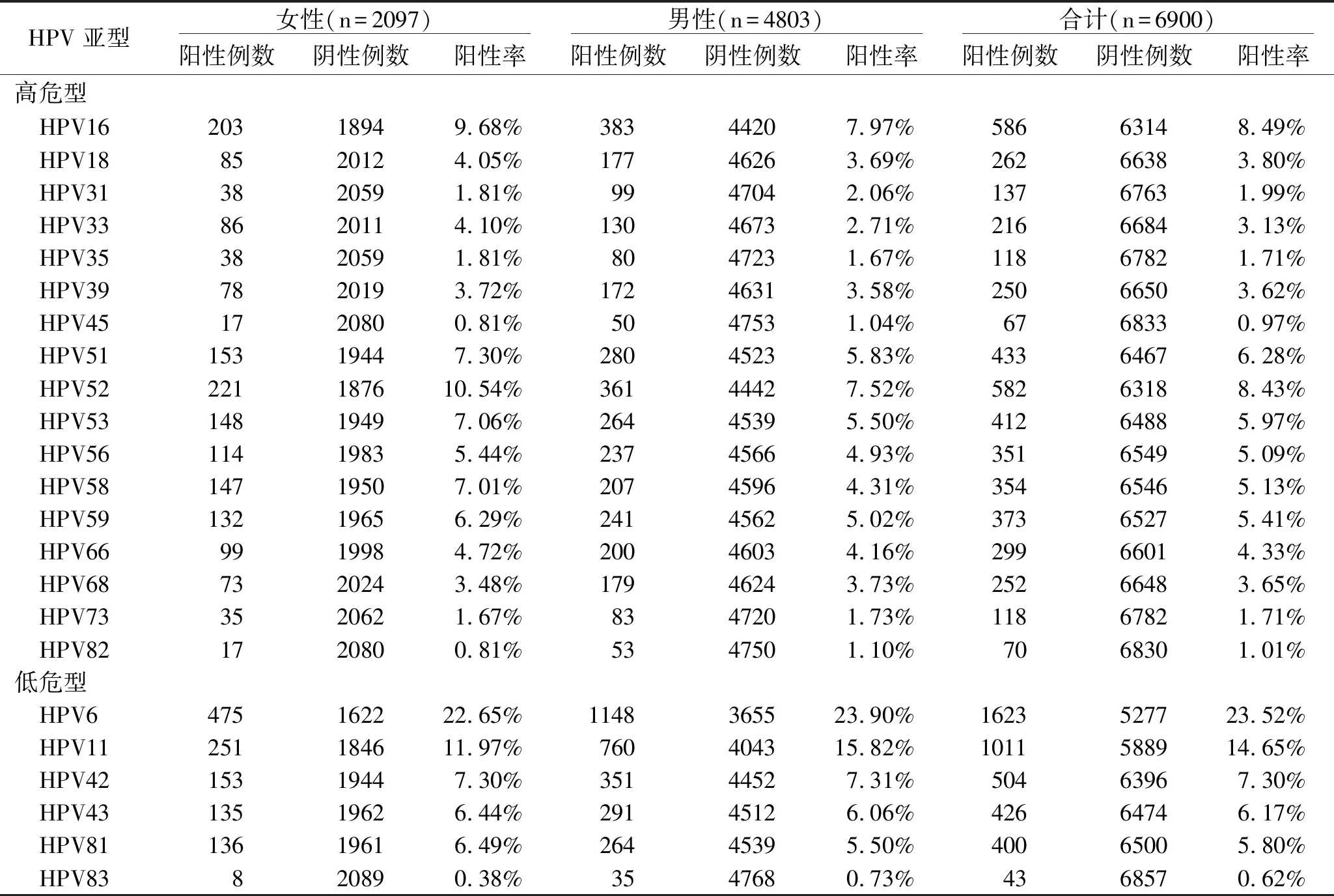
表1 HPV分型检测结果
2.2 单一感染与多重感染 在4377例HPV感染者中,仅感染一种HPV病毒的例数为2154例,占总阳性例数的49.21%;二重感染1081例,占24.70%;三重感染550例,占12.57%;四重感染295例,占6.74%;五重感染165例,占3.77%;六重及以上感染132例,占3.02%。其中单一感染的例数最多,六重及以上感染者最少,由此可见,感染HPV的例数随着感染亚型数量的增加而减少,呈现负相关关系,见图1。
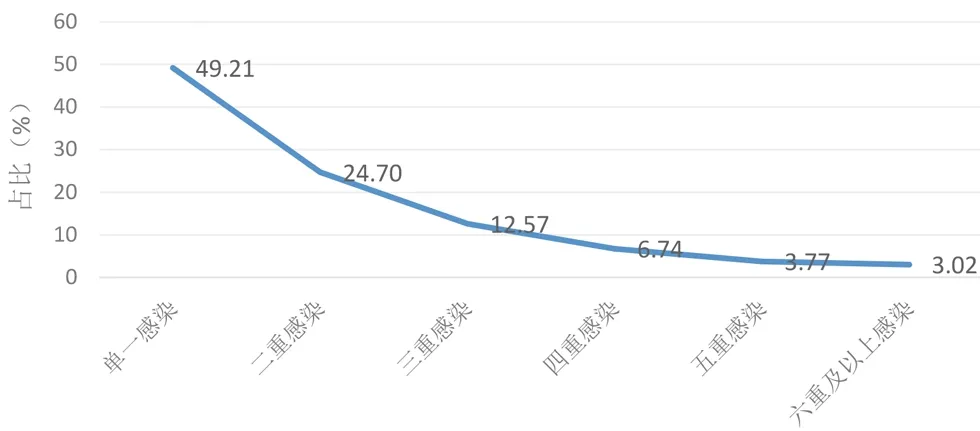
图1 单一感染与多重感染对比图
2.3 不同年龄段HPV感染情况 <20、20~30、31~40、41~50、>50岁不同年龄段的HPV感染率分别为71.78%、64.84%、60.11%、61.51%、68.30%,见表2、表3。<20岁的感染率最高,其中<10岁的儿童HPV感染率为35.48%。男性HPV感染高峰出现在20岁以下及50岁以上,女性则出现在30岁以下及50岁以上,山东地区女性HPV高危型感染率明显高于男性,而女性HPV低危型的感染率低于男性;山东地区男女性HPV感染率随着年龄的变化均呈“U”型分布,不同年龄段的HPV感染率男女性均有显著差异(P<0.05),见图2。
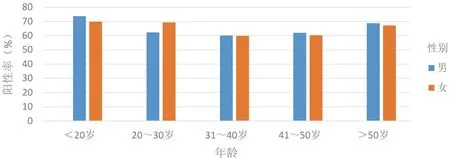
图2 各年龄段HPV感染情况对比图
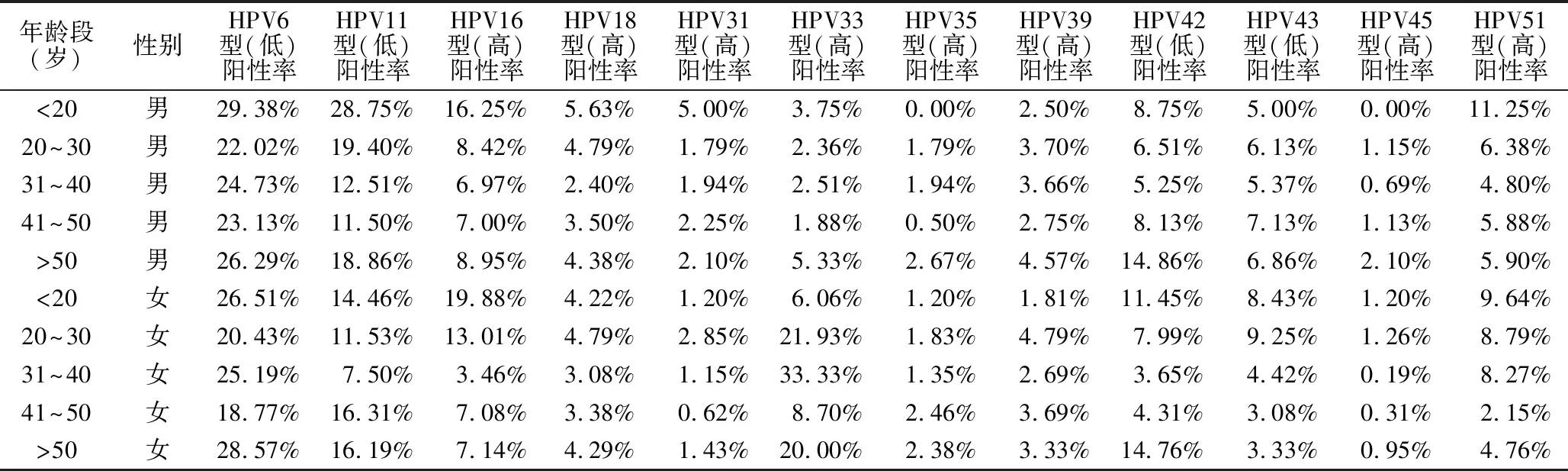
表2 HPV6型-HPV51型感染患者年龄分布表
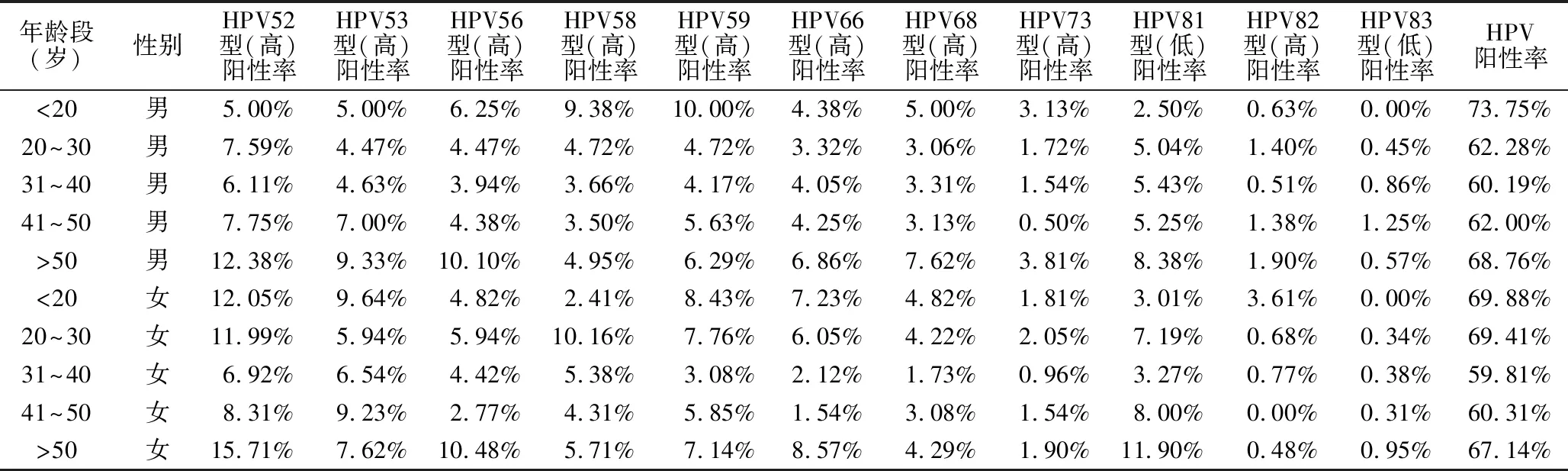
表3 HPV52型-HPV83型感染患者年龄分布表
3 讨论
本研究对6900例患者进行HPV分型检测,其中男4803例,女2097例。年龄1~84岁。结果显示,HPV感染型别居于前六位分别为HPV6(23.52%),HPV11(14.65%),HPV16(8.49%),HPV52(8.43%),HPV42(7.30%),HPV51(6.28%)。与徐州地区HPV感染人群以HPV16、HPV52、HPV53型最多不符[4],也不同于黑龙江地区HPV感染率排在前3位的为HPV16、HPV52、HPV58型[5],该结果的差异可能与复杂地理环境、生活习惯以及研究人群的不同有关。
本文结果发现,在HPV阳性患者中,一重感染最多,在多重感染中,二重感染者最多,且随着感染型数的增加,感染人数逐渐减少,因此临床仍是以少数HPV亚型感染为主。HPV的多重感染,可能与机体免疫低下,清除病毒能力不足,导致HPV持续阳性有关。其中,六重及以上HPV感染的132例患者,其年龄段主要分布在20~30岁,可见HPV的多重感染更多见于年轻人,可能与性生活活跃有关。有研究显示,高危HPV的多重感染会增加宫颈上皮内瘤变的发生风险[6],因此更要引起高度重视,临床发现HPV多重感染病例,必须尽快治疗。
在本文中发现,HPV感染人群年龄以<20、>50岁为主,HPV感染率最低为31~40岁,总体趋势呈“U”型分布,高危型HPV持续性感染与子宫颈癌的发病及男性阴茎及肛周癌变密切相关[7],随着社会发展,人们性意识发生很大变化,初次性生活低龄化及多个性伴侣等不洁性行为的增加,加大了HPV的感染风险,直接性接触为HPV主要传播途径[8]。HPV疫苗能够阻断高危型HPV的持续感染从而有效降低宫颈癌及其癌前病变的发生率,在适龄人群中推广HPV疫苗接种是宫颈癌一级预防的有效措施[9]。>50岁的女性由于更年期后激素水平紊乱,阴道内环境改变,导致HPV感染率较高,以及该年龄段女性机体免疫功能较低下,HPV感染后难以自我转阴,导致持续感染阳性,因此该年龄段女性要重视HPV的定期复查,以防HPV的持续感染,导致宫颈病变。<20岁的女性则是由于该年龄段女性抵抗力较低,初次性生活年龄较小,宫颈发育还未完全成熟,或者性生活频繁,未注意个人卫生,导致HPV感染发生,因此更应该对处于青春期的女性进行正确的性知识宣教。
综上所述,HPV分型检测对于宫颈癌的早期诊断有重要参考意义,可靠简便,可降低漏诊率,早发现,早干预,早治疗,为今后临床对HPV的预防监控及治疗提供了科学依据。另外不同地区、不同年龄人群的HPV感染数量、亚型分布各有不同,可根据其特点开展本地区宫颈癌筛查宣教,扎实推进适龄女生HPV疫苗接种,加强服务保障,确保接种工作高效推进,普及正确科学的医学健康知识,降低HPV感染风险。

