生物质甘油催化氨化制备有机胺的反应过程分析
左志帅, 郑广宗, 安华良, 王桂荣, 赵新强, 王延吉
生物质甘油催化氨化制备有机胺的反应过程分析
左志帅, 郑广宗, 安华良, 王桂荣, 赵新强, 王延吉
(河北工业大学 绿色化工与高效节能河北省重点实验室, 天津 300130)
针对生物柴油产业中副产甘油过剩的问题,提出基于甘油直接制备高附加值有机胺的方法。采用-Al2O3为载体,以Co为主金属组分制备负载型双金属催化剂,对甘油催化氨化反应进行了探索性研究。结果表明,甘油氨化反应体系复杂,其中Co-Ni/-Al2O3更有利于催化甘油氨化生成伯胺,伯胺的选择性之和为54.2%。采用气相色谱-质谱联用技术对甘油氨化反应体系进行定性分析,建立了反应网络,明晰了直链胺类以及哌嗪类衍生物的合成路径,得出生成乙二胺和1,2-丙二胺反应分别有2条可能路径。利用Aspen Plus对甘油催化氨化合成二元胺—乙二胺和1,2-丙二胺的反应路径进行了热力学分析,根据结果确定甘油氨化合成乙二胺很可能按照以3-氨基-1,2-丙二醇为中间产物的路径进行;对于甘油氨化合成1,2-丙二胺反应,在较低温度下,2-氨基丙醇路径和1-氨基-2-丙醇路径2种反应路径并存,而随着反应温度的升高变为以1-氨基-2-丙醇路径为主。
甘油;催化氨化;有机胺;反应路径;热力学分析
1 前 言
由于原油价格的不稳定、石油储量的不断减少以及使用化石燃料导致的环境问题,全球生物燃料生产快速增长。生物柴油是化石燃料的重要替代品,然而,生物柴油生产过程中会副产大量甘油(约占生物柴油产量的10%)[1-5]。近年来,生物柴油产业呈快速增长趋势,预计到2023年生物柴油产量将会达到4.0×103万吨,副产物甘油的量也将随之增加。因此,近年来如何有效利用甘油已成为国内外研究的热点[6-8]。其中,甘油催化氨化制备有机胺是甘油高附加值利用的方案之一。胺类化合物是化学工业中的关键中间体,在农用化学品、药品、洗涤剂、织物柔软剂、润滑剂、聚合物和食品添加剂的制造中具有广泛的应用[9-10]。醇类化合物催化氨化制备有机胺是一个有吸引力的工艺方法,理论上副产物只有水,具有绿色、环境友好、原子利用率高等优点[11-12]。因此,对生物质甘油催化氨化制备有机胺进行研究具有重要的理论意义和现实价值。
目前,关于以甘油为原料制备有机胺类化合物研究的文献很少。Du等[13]对Ru/C作为催化剂的甘油氨化反应进行研究,甘油转化率可达96.2%,但主要生成甲胺、乙胺、丙胺等小分子一元胺类化合物。对于二元胺,反应产物中仅提及乙二胺且其选择性较低(2.8%)。从原子利用率角度出发,甘油催化氨化制备二元有机胺或高碳数(两个碳或三个碳)有机胺更符合绿色化学提倡的发展方向。因此,本研究拟对甘油直接氨化制备二元有机胺的反应过程进行重点分析。
本课题组对乙二醇催化氨化反应开展了部分研究,可以为甘油催化氨化的研究提供借鉴。Xie等[14-15]研究了非负载非贵金属对乙二醇氨化反应的催化性能。与一元醇氨化常用金属组分Ni不同,Co对二元醇催化氨化反应的催化效果更好。利用密度泛函理论(DFT)模拟计算分析原因,在金属Co的作用下,乙二醇催化氨化的控速步骤—乙二醇脱氢的化学键断裂能垒更低。在此基础上,An等[16]和Xie等[17]以-Al2O3为载体制备了负载型金属催化剂用于乙二醇催化氨化反应,明晰了载体酸碱性对其催化性能的影响,其中Co为主金属活性组分、Cu为第二金属组分时,催化剂活性较好,乙二醇的转化率为41.5%,乙二胺和乙醇胺的选择性分别达到45.7% 和23.7%。此外,Zhao等[18]在研究1,2-丁二醇氨化和Yue等[19]在研究1,2-丙二醇氨化时,同样得出Co基催化剂具有较好的催化效果。基于此,本研究拟以-Al2O3为载体、Co为主金属组分,制备负载型双金属催化剂,对甘油催化氨化反应过程进行探索研究,评价其对甘油催化氨化制备有机胺反应的催化性能;采用气相色谱-质谱联用(GC-MS)技术对该反应体系进行定性分析,建立甘油氨化的反应网络;结合Aspen Plus热力学计算结果分析确定甘油氨化合成二元胺—乙二胺和1,2-丙二胺可能的反应路径,为甘油催化氨化合成二元胺的后续研究提供参考和指导。
2 实验部分
2.1 原料与试剂
主要原材料硝酸钴、硝酸铜、硝酸镍、硝酸铁、氯化钌、氯化钯、氯铂酸、甘油、氨水(氨的质量分数为25%~28%)等均为分析纯,去离子水为实验室自制。
2.2 催化剂制备
采用共浸渍法制备-Al2O3负载Co-X(X=Cu、Ni、Fe、Ru、Pd、Pt)双金属催化剂,控制金属总负载量(质量分数)为20%,其中金属Co与X的质量比为4:1。以负载Co-Cu为例,制备过程如下:取2.371 g的Co(NO3)26H2O和0.354 g的Cu(NO3)2分别溶于15 mL的去离子水中配制成水溶液;将配好的溶液加入250 mL的圆底烧瓶后加入3 g-Al2O3,浸渍并老化12 h后,先在旋转蒸发仪上除水,再于120 ℃下干燥12 h;将干燥后的样品于500 ℃下焙烧4 h,再于H2、N2体积比为40:60的气氛下,于450 ℃处理4 h,从而制得Co-Cu/-Al2O3。其他负载型双金属催化剂的制备过程与Co-Cu/-Al2O3类似。
2.3 反应操作过程
甘油催化氨化反应在100 mL高压反应釜中进行,具体操作如下:向反应釜中依次加入玻璃磁子、1.33 g Co-Cu/-Al2O3催化剂、4.6 g甘油和17 g氨水,在确保反应釜气密性良好的前提下,用氢气置换反应釜中的空气3~5次,向釜中充入4 MPa氢气后开启搅拌与加热,待反应升至200 ℃后开始计时,反应持续12 h后停止加热,待反应釜温度降至室温,放残气开釜。使用离心机对得到的固液混合物进行分离,收集分离后的反应液,用气相色谱仪对其进行定量分析。
2.4 产物分析
采用日本岛津QP-2010型气相色谱-质谱联用仪对甘油催化氨化反应产物进行定性分析。氦气作为载气,使用Rtx-Wax(30 m´0.25 mm´0.25 µm)毛细管色谱柱对反应液中的组分进行分离,采用程序升温方式控制色谱柱温度:初温100 ℃,保持2 min;以15 ℃×min-1升温至220 ℃,保持10 min。汽化室和质谱EI源温度均控制在250 ℃。
采用日本岛津公司生产的GC-2030型气相色谱仪对甘油催化氨化反应产物进行定量分析。采用内标法进行定量,以异丙醇为内标物。使用Rtx-Wax(30 m´0.25 mm´0.25 µm)毛细管色谱柱,采用程序升温控制色谱柱温度:初温100 ℃,保持2 min;以15 ℃×min-1升温至220 ℃,保持10 min。汽化室和氢火焰检测器温度均为250 ℃;氮气作为载气。
3 实验结果与讨论
3.1 负载型双金属催化剂对甘油氨化反应的催化性能
以-Al2O3为载体,同时负载Co与第二金属组分制备了一系列催化剂,在甘油氨化反应中对所制备的催化剂进行活性评价,结果如表1所示,表下为质量。Wang等[20]用简化的DFT计算了甲氧基的C─H裂解成甲醛基团的活化能,发现总体趋势是贵金属催化剂上的C─H键裂解的活化能明显低于非贵金属。醇氨化过程中C─H键的断裂是反应速率决定步骤[14],所以当第二金属组分为贵金属时,甘油的转化率G较高;第二金属组分为非贵金属时,甘油的转化率明显要低得多。当第二金属组分为贵金属Ru时,甘油转化率最高,达到了55.3%。在金属位存在条件下,醇的氨化过程一般遵循还原氨化机理[14]。Bodis等[21]在研究丁醛还原氨化过程中发现Ru更容易形成伯胺,而Pd和Pt更容易形成仲胺,因为贵金属Pd和Pt的氢化能力更高。Ibáñez等[22]在研究脂肪醇与氨的气相氨化反应中发现具有同样的结果。表1中当第二金属组分为贵金属时,Ru具有最高的伯胺选择性Primary amine,具体包括乙二胺选择性EDA、1,2-丙二胺选择性1,2-PDA、3-氨基-1,2-丙二醇选择性3-A-1,2-PDO、2-氨基-1,3-丙二醇选择性2-A-1,3-PDO和2-氨基丙醇选择性2-APO之和,这与文献结果一致。当第二金属组分为非贵金属Cu时,产物中哌嗪类衍生物(2,6-二甲基哌嗪和2-甲基哌嗪)的选择性Piperazines最高,为26.5%。Zhang等[23]在研究乙醇氨化为乙腈时也发现Cu基催化剂更容易发生缩合-环化反应。由于金属Ni具有优异的脱氢和加氢活性,其在醇氨化制备伯胺的反应中表现出良好的效果[24-25],所以当第二金属组分为Ni时,伯胺(乙二胺、1,2-丙二胺、2-氨基丙醇、3-氨基-1,2-丙二醇和2-氨基-1,3-丙二醇)的总选择性最高,为54.2%。通过对比2-氨基-1,3-丙二醇与3-氨基-1,2-丙二醇的选择性可见,所有的催化体系都显现出对2-氨基-1,3-丙二醇较高的选择性,这说明甘油中间羟基比端羟基更容易被氨化;观察产物中二元胺的选择性,可以发现所有催化体系中,1,2-丙二胺的选择性均比乙二胺的选择性高,可以推测甘油更容易发生C─O键的断裂,而较难进行C─C键断裂。所有的催化体系中,2-氨基丙醇的选择性高于2-氨基-1,3-丙二醇的选择性,也从侧面说明C─O键易断裂。在现有反应条件下,反应体系中未定性组分的选择性比较高,已知产物的选择性之和最高只有72.9%。Du等[13]对Ru/C催化甘油氨化反应的研究也存在同样的问题。因此,有必要对甘油氨化反应体系进行定性分析,确定反应液的主要组成,并深入讨论反应路径,为后续有针对性地设计催化剂及反应条件奠定基础。

表1 不同双金属催化剂对甘油氨化反应的催化性能
Reaction conditions: temperature=200 ℃, time=2 h. hydrogen pressure=4 MPa, a weight percentage of catalyst=15%,G=4.6 g,NH3·H2O=17 g G: glycerol; EDA: ethylenediamine; 1,2-PDA: 1,2-propanediamine; 3-A-1,2-PDO: 3-amino-1,2-propanediol; 2-A-1,3-PDO: 2-amino-1,3-propanediol; 2-APO:2-aminopropanol primary amine: EDA+1,2-PDA+3-A-1,2-PDO+2-A-1,3-PDO+2-APO; piperazines: 2,6-dimethylpiperazine+2-methylpiperazine
3.2 甘油催化氨化反应体系分析
3.2.1 反应体系定性分析
通过GC-MS分析甘油氨化反应产液,发现反应液中除了反应物甘油之外,主要包括甲醇、乙二胺、1,2-丙二胺、1-氨基-2-丙醇、2,6-二甲基哌嗪、2-甲基哌嗪、2,5-二甲基哌嗪、2-氨基丙醇、1,2-丙二醇、乙二醇、3-氨基-1,2-丙二醇、2-氨基-1,3-丙二醇等组分。
3.2.2 反应网络建立
文献中醇催化氨化机理研究表明,脱氢、氨化和加氢是多元醇催化氨化反应的关键反应步骤[12,26-27],结合反应产物与相关文献推测了甘油催化氨化合成直链烷基胺类化合物的反应路径,如图1所示。甘油中间羟基发生脱氢反应生成1,3-二羟基丙酮,1,3-二羟基丙酮再与NH3发生反应生成2-氨基-1,3-丙二醇[28]。2-氨基丙醇、1-氨基-2-丙醇、3-氨基-1,2-丙二醇可解释为甘油合成二元胺类化合物(乙二胺和1,2-丙二胺)的中间产物。
对于甘油催化氨化合成乙二胺推测有两种可能的反应路径(图1)。第1种反应路径:甘油先脱氢后形成甘油醛,再进一步发生逆羟醛缩合反应生成2-羟基乙醛和甲醛,这是典型的甘油催化氢解合成乙二醇的中间步骤[29-30],2-羟基乙醛加氢生成乙二醇。在乙二醇还原氨化反应过程中,乙二醇要先脱氢生成2-羟基乙醛,2-羟基乙醛再经过氨化、加氢等步骤生成乙二胺[28,31]。因此,推测在甘油氨化直接生成乙二胺的过程中可能无需经过乙二醇,而是2-羟基乙醛与氨发生反应形成乙醇胺,乙醇胺再进一步氨化合成乙二胺。在这条路径中可以归结为甘油先发生C─C键的断裂,后发生氨化反应生成乙二胺。第2种反应路径:甘油脱氢生成甘油醛后直接发生醛胺缩合反应生成3-氨基-1,2-丙二醇;3-氨基-1,2-丙二醇再脱氢生成2-羟基-3-氨基丙醛,2-羟基-3-氨基丙醛发生逆羟醛缩合反应得到2-氨基乙醛和甲醛,2-氨基乙醛再与NH3反应得到乙二胺。这条反应路径可以归结为甘油先氨化后发生C─C键的断裂,再进一步氨化生成乙二胺。为了便于区别及后续分析讨论,以两种路径中独有的中间产物对反应路径进行命名:第1种路径称为乙醇胺路径,第2种路径称为3-氨基-1,2-丙二醇路径。
对于甘油催化氨化合成1,2-丙二胺同样推测有2种可能的反应路径(如图1所示)。第1种反应路径:甘油伯碳上C─O键的断裂脱水得到丙酮醇,此过程是甘油在L酸的催化作用下氢解合成1,2-丙二醇的中间步骤[32-33]。丙酮醇除了加氢得到1,2-丙二醇以外,可以直接与氨反应得到2-氨基丙醇,2-氨基丙醇再经脱氢、氨化等步骤得到1,2-丙二胺,此反应过程是典型的1,2-丙二醇的氨化反应过程[19,26]。该反应路径可以归结为先脱水发生C─O键断裂再发生氨化反应生成1,2-丙二胺。第2种反应路径:甘油脱氢得到甘油醛,甘油醛脱水得到2-羟基丙烯醛,此反应步骤为碱催化甘油氢解合成1,2-丙二醇的中间步骤[34-35],2-羟基丙烯醛完全加氢也可以得到1,2-丙二醇。此外,2-羟基丙烯醛进行C═C键加氢和C═O键氨化、加氢反应可以生成1-氨基-2-丙醇,得到的1-氨基-2-丙醇再经脱氢、氨化和加氢即可得到1,2-丙二胺,该反应路径可以归结为甘油先脱氢再发生氨化反应生成1,2-丙二胺。将生成1,2-丙二胺的两种路径分别命名为2-氨基丙醇路径和1-氨基-2-丙醇路径。
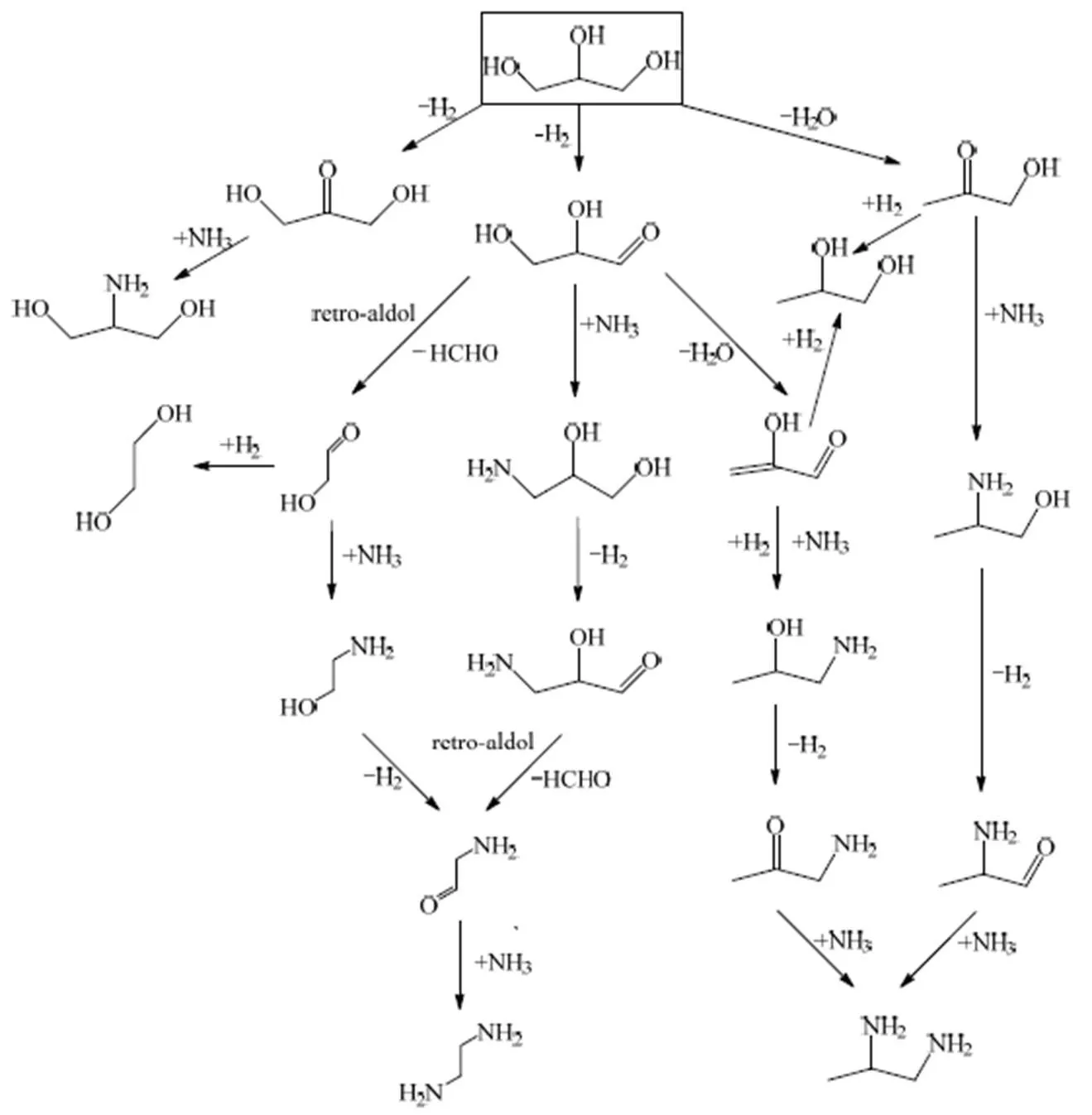
图1 甘油合成有机胺类化合物的反应路径

图2 甘油氨化体系中哌嗪类化合物的合成路径
除了上述有机胺类化合物以外,反应体系中还有一部分哌嗪类衍生物生成(主要包括2,6-二甲基哌嗪、2-甲基哌嗪和2,5-二甲基哌嗪)。褚永良[36]在研究乙醇胺环化合成哌嗪反应中,推测哌嗪的合成机理是两分子2-氨基乙醛发生反应形成烯胺式结构再加氢生成哌嗪。据此,推测了哌嗪类衍生物的合成过程,结果如图2所示。甘油催化氨化过程中生成的两分子2-氨基乙醛自身发生反应合成哌嗪;2-氨基乙醛与1-氨基-2-丙酮通过醛胺反应生成2-甲基哌嗪;2-氨基丙醛与1-氨基-2-丙酮反应生成2,6-二甲基哌嗪;两分子2-氨基丙醛自身发生反应生成2,5-二甲基哌嗪。
3.3 甘油催化氨化合成二元有机胺的反应过程分析
甘油催化氨化反应体系复杂,组分种类较多,本研究重点对甘油氨化合成二元有机胺—乙二胺和1,2-丙二胺的反应过程进行热力学计算与分析,以期为甘油催化氨化直接合成二元有机胺的后续研究提供参考。
3.3.1 甘油氨化合成乙二胺的反应过程分析
在氨化反应过程中,脱氢是关键步骤[37],甘油脱氢生成甘油醛是2种路径都经历的中间步骤,故不讨论它在2种路径中的影响。从甘油氨化为有机胺的反应路径可以看出,氨化与加氢步骤往往是同时进行的。基于此,为了便于进行反应过程分析和讨论,对甘油氨化合成乙二胺的反应路径进行了简化,将反应路径中部分反应步骤进行了合并。在乙醇胺路径中,将甘油脱氢合成甘油醛及其再发生C─C键断裂合成2-羟基乙醛合并为一步反应,2-羟基乙醛氨化后再加氢合成乙醇胺合并为一步反应,乙醇胺脱氢后再发生氨化和加氢反应合成乙二胺归于一步反应。在3-氨基-1,2-丙二醇路径中,将甘油脱氢合成甘油醛及其再发生氨化和加氢反应合成3-氨基-1,2-丙二醇合并为一步反应,3-氨基-1,2-丙二醇脱氢及后续发生C─C键断裂合成2-氨基乙醛归于一步反应,2-氨基乙醛经氨化和加氢反应合成乙二胺归为一步反应。具体如下所示。
乙醇胺反应路径:

3-氨基-1,2-丙二醇反应路径:
采用软件Aspen Plus V10对甘油氨化制乙二胺总反应及2种反应路径所涉及的分步反应进行了不同温度下的热力学参数计算。甘油氨化合成乙二胺总反应式如式(1);乙醇胺路径的分步反应如式(2)~(4);3-氨基-1,2-丙二醇路径的分步反应如式(5)~(7)。
C3H8O3+2NH3→C2H8N2+CH2O+2H2O (1)
C3H8O3→C2H4O2+CH2O+H2(2)
C2H4O2+NH3+H2→C2H7NO+H2O (3)
C2H7NO+NH3→C2H8N2+H2O (4)
C3H8O3+NH3→C3H9NO2+H2O (5)
C3H9NO2→C2H5NO+CH2O+H2(6)
C2H5NO+NH3+H2→C2H8N2+H2O (7)
(1) 总反应的热力学分析
通过计算得出反应在373.15、473.15和573.15这3个典型温度下的相关数据。其中在3个典型温度下反应式(1)的焓变Δr分别为60.59、60.69和60.41 kJ×mol-1,所以总反应为吸热反应,升高温度有利于甘油氨化合成乙二胺反应的进行。总反应吉布斯自由能变Δr以及反应平衡常数随温度变化情况如图3所示。从图中可以看出,Δr随着温度的升高而减小,当反应温度低于473.15 K时,Δr>0,此时反应难以自发进行;当反应温度高于473.15 K时,Δr<0,反应能够自发进行。随着温度的升高而不断增大,是化学反应可逆性的定量表征,越大则反应越完全[38],表明总反应的平衡转化率随温度升高而提高。

图3 总反应的ΔrG、K随温度变化规律
(2) 乙醇胺路径的热力学分析
乙醇胺路径中,各步反应的Δr与随温度变化情况如图4所示。由图(a)和(a¢)可见,反应式(2)的Δr随温度升高而减小,在298.15~623.15 K温度范围内Δr>0,反应难以自发进行。随温度升高而增大,但温度达到623.15 K时,仍很小,表明第1步反应的平衡转化率很低,在热力学上不容易进行。由图(b)和(b¢)可见,反应式(3)的Δr随温度升高而增大但始终为负值,表明反应可以自发进行。随温度升高而减小,但温度达到623.15 K时,为1 632仍较大,表明第2步反应的平衡转化率会很高,在热力学上具有竞争优势。由(c)和(c¢)可见,反应式(4)的Δr随着温度不断增大,在298.15~623.15 K温度范围内Δr<0,反应能够自发进行。较小且随温度升高不断减少,表明第3步反应的平衡转化率不会很高且升高温度不利于该步反应的进行,但在热力学上也属较为容易发生的反应。
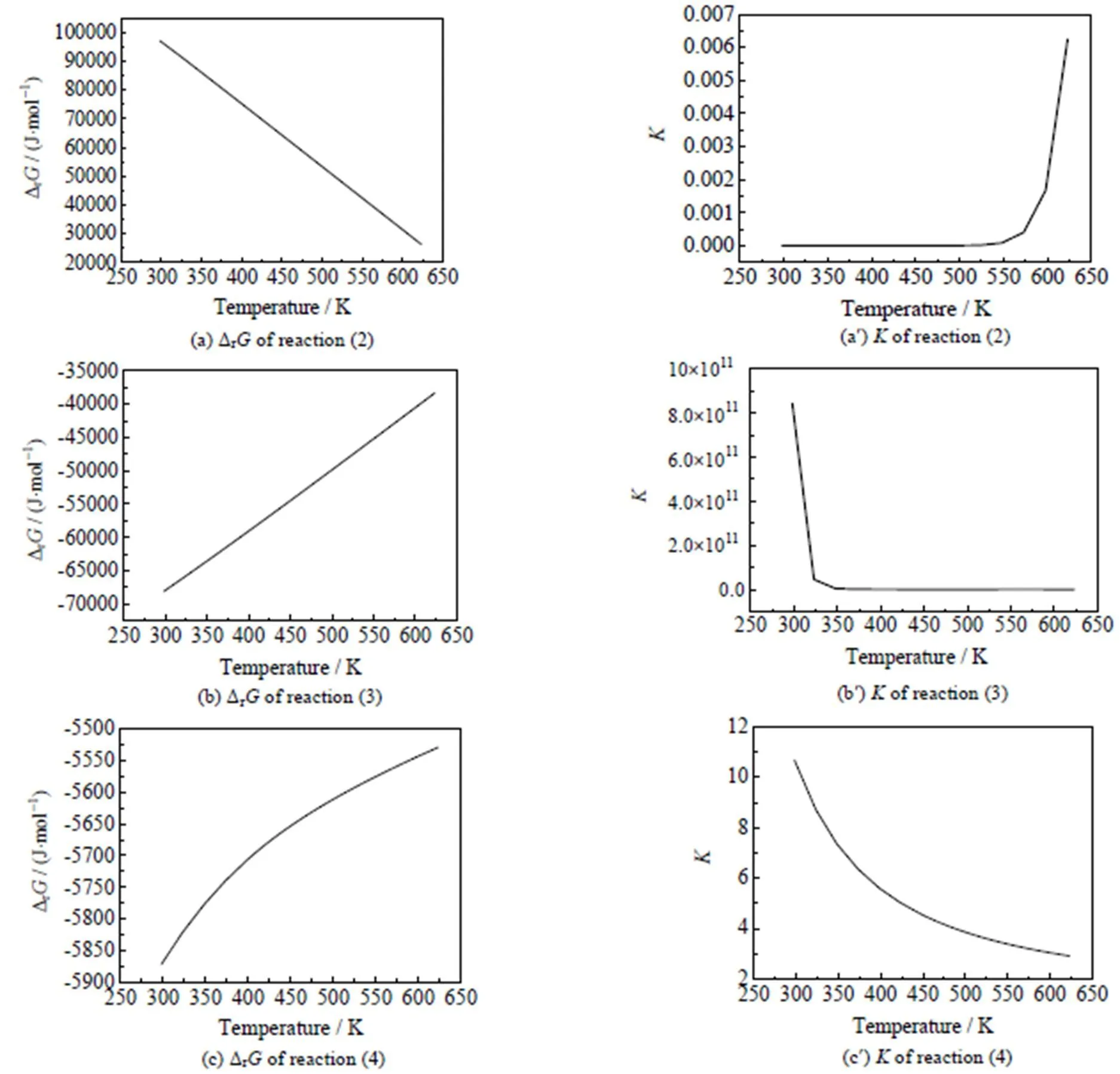
图4 乙醇胺路径中各步反应的ΔrG、K随温度变化情况
(3) 3-氨基-1,2-丙二醇路径的热力学分析
3-氨基-1,2-丙二醇路径中,各步反应的吉布斯自由能变Δr与反应平衡常数随温度变化情况如图5所示。由图(a)和(a¢)可见,反应式(5)的Δr随着温度升高逐渐增大,在298.15~323.15 K温度范围内,Δr由负值变为正值,反应在较高反应温度下难以自发进行。值较小且随温度升高而逐渐降低,表明第1步反应的平衡转化率会极低,第1步反应受热力学控制不容易进行。由图(b)和(b¢)可见,反应式(6)的Δr随温度升高而降低,当反应温度低于523.15 K时,Δr>0,反应难以自发进行;当反应温度大于523.15 K时,Δr<0,此时反应能自发进行。随温度升高而升高,表明升高温度第2步反应的平衡转化率逐渐升高,第2步反应在高温下容易发生反应。由图(c)和(c¢)可见,反应式(7)的Δr随着温度升高而逐渐增大,但在298.15~623.15 K始终小于0,即反应能够自发进行。在低温下值较大,但随温度升高而迅速降低,表明低温下第3步反应的平衡转化率会很高,高温下第3步反应的平衡转化率相对较低(473.15 K时为21.02),第3步反应在热力学上较容易进行。
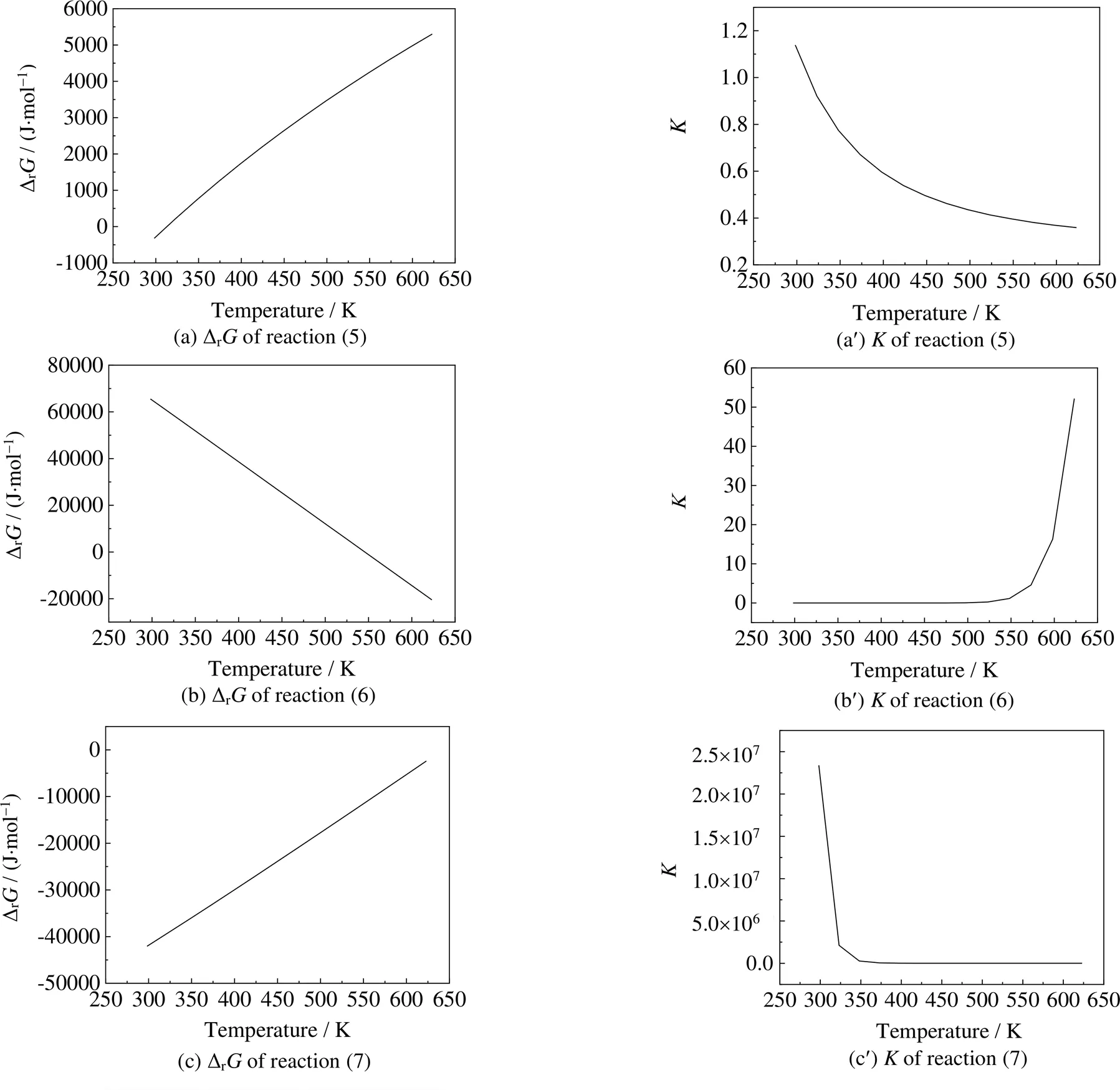
图5 3-氨基-1,2-丙二醇路径反应的ΔrG、K随温度变化情况
选择373.15、473.15和573.15 K 3个典型温度,对比反应式(1)~(7)的Δr和,结果如表2所示。对于总反应(反应式(1)),当反应温度在373.15~473.15 K,甘油氨化合成乙二胺反应的Δr>0,反应很难进行。逐渐增大,但473.15 K时仍很小,所以反应平衡转化率会很小,这与表1中甘油在473.15 K下进行氨化反应得到选择性极低的乙二胺相一致。当反应温度达到573.15 K时,甘油氨化合成乙二胺反应的Δr<0,反应可以自发进行;也逐渐增大。因此,可以推测提高反应温度可以促进甘油氨化合成乙二胺反应的进行。

表2 不同温度下各个反应的ΔrG与K
从甘油氨化合成乙二胺的2种可能路径进行分析,在373.15和473.15 K下,乙醇胺路径中,反应式(2)的Δr>0,且非常小,即甘油发生C─C键断裂合成2-羟基乙醛的反应很难进行;3-氨基-1,2-丙二醇路径中,反应式(6)的Δr>0,且值也较小,同样3-氨基-1,2-丙二醇发生C─C键断裂合成2-氨基乙醛反应也较难进行。结合上述总反应在较低温度下的平衡常数较小,可推测甘油氨化合成乙二胺反应中C─C键断裂为反应中的关键步骤,在较低温度下,2条反应路径均不易进行。
在573.15 K下对比2种乙二胺合成路径,乙醇胺路径中,关键反应步骤甘油发生C─C键断裂合成2-羟基乙醛的Δr>0,值虽然有提高但依然非常小;3-氨基-1,2-丙二醇路径中,关键反应步骤3-氨基-1,2-丙二醇发生C─C键断裂合成2-氨基乙醛的Δr<0,此时有所增大,573.15 K时为4.597。这说明3-氨基-1,2-丙二醇路径在热力学中更有竞争优势。结合对反应产物的定性分析,反应体系中并没有出现特征中间产物乙醇胺,有特征中间产物3-氨基-1,2-丙二醇,也在一定程度上说明甘油氨化合成乙二胺可能是按照3-氨基-1,2-丙二醇路径进行。
3.3.2 甘油催化氨化合成1,2-丙二胺的反应过程分析
与甘油氨化合成乙二胺反应过程类似,对甘油氨化合成1,2-丙二胺的反应路径进行了简化,将反应中部分反应步骤进行了合并。对于2-氨基丙醇路径,将甘油脱水生成丙酮醇视为一步,丙酮醇发生氨化和加氢反应生成2-氨基丙醇合并为一步,2-氨基丙醇脱氢、氨化和加氢合成1,2-丙二胺合并为一步;在1-氨基-2-丙醇路径中,将甘油先脱氢再发生C─O键断裂合成2-羟基丙烯醛合并为第1步反应,2-羟基丙烯醛发生氨化和加氢反应生成1-氨基-2-丙醇合并为第2步反应,1-氨基-2-丙醇脱氢、氨化和加氢合成1,2-丙二胺看作是第3步反应。具体如下所示。
2-氨基丙醇反应路径:
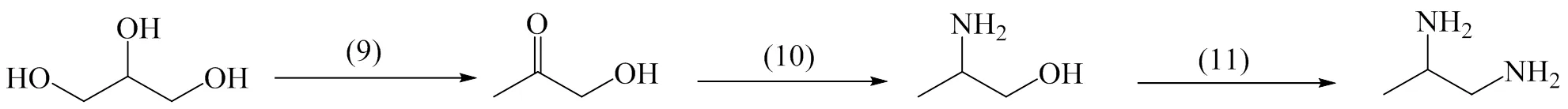
1-氨基-2-丙醇反应路径:
采用软件Aspen Plus V10对甘油氨化制1,2-丙二胺总反应及2种反应路径所涉及的分步反应进行了不同温度下的热力学参数计算。甘油氨化合成1,2-丙二胺总反应式如式(8);2-氨基丙醇路径的分步反应式如式(9)~(11);1-氨基-2-丙醇路径的分步反应式如式(12)~(14)。
C3H8O3+2NH3+H2→C3H10N2+3H2O (8)
C3H8O3→C3H6O2+H2O (9)
C3H6O2+H2+NH3→C3H9NO+H2O (10)
C3H9NO+NH3→C3H10N2+H2O (11)
C3H8O3→C3H4O2+H2+H2O (12)
C3H4O2+2H2+NH3→C3H9NO+H2O (13)
C3H9NO+NH3→C3H10N2+H2O (14)
表3列出了373.15、473.15和573.15 K 3个典型温度下的计算结果。从计算结果可知,总反应(反应式(8))的Δr分别为-109.434、-109.619和-110.037 kJ×mol-1,这说明甘油合成1,2-丙二胺为放热反应,升高温度不利于甘油合成1,2-丙二胺反应的进行;Δr<0,非常大,表明该反应为自发反应且非常容易进行。这与表1中1,2-丙二胺的选择性明显高于乙二胺相符合,同时也证明了甘油的C─O键比C─C键更容易断裂。在373.15和473.15 K下,2种反应路径各步反应步骤的Δr均小于0,且值较大。表明甘油合成1,2-丙二胺的2种路径涉及的分步反应都比较容易进行,所以实际情况很可能是两种路径并存。在573.15 K下,2-氨基丙醇路径中,反应式(10)的Δr>0且非常小,说明该步反应难以自发进行。所以,丙酮醇先氨化再加氢合成2-氨基丙醇反应是2-氨基丙醇路径中的关键步骤。在较高温度下,2-氨基丙醇路径不容易进行。而1-氨基-2-丙醇路径中,各分步反应在较高温度下的Δr<0且值均较大。因此,1-氨基-2-丙醇路径在较高温度下更有优势。
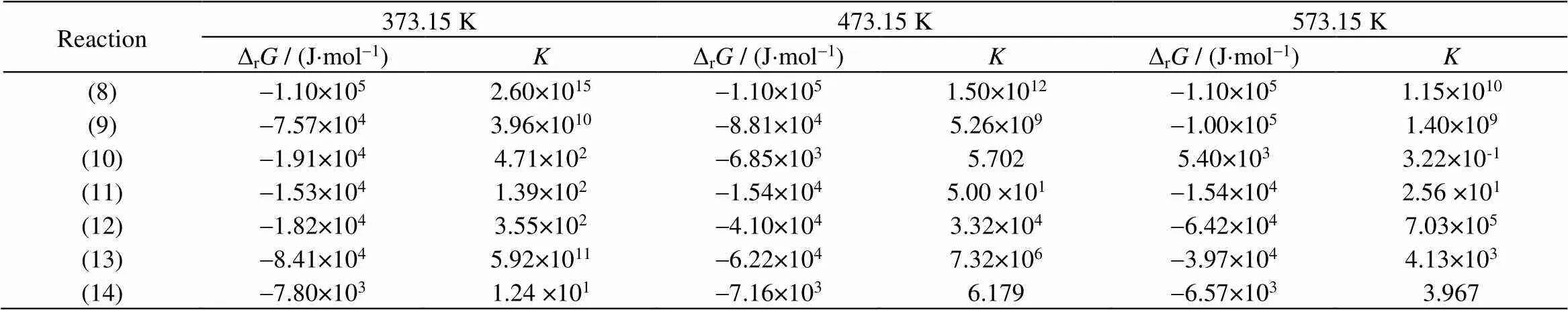
表3 不同温度下各个反应的ΔrG与K
对比甘油合成乙二胺与甘油合成1,2-丙二胺的热力学计算结果,甘油氨化合成乙二胺反应为吸热反应,Δr随温度升高而降低,在473.15至573.15 K,Δr由正值转为负值;随温度升高而不断升高,这些都可以说明当反应温度足够高时有利于甘油合成乙二胺。甘油氨化合成1,2-丙二胺的反应为放热反应,在373.15~573.15 K,Δr随温度升高而升高,始终小于0;随温度升高而不断降低,始终保持较大值,说明甘油合成1,2-丙二胺反应比较容易进行且在较低反应温度下更加有利。这解释了以负载型双金属催化甘油氨化反应,在473.15 K时出现乙二胺选择性较低,且1,2-丙二胺选择性远高于乙二胺选择性的现象。
4 结 论
(1) 采用-Al2O3为载体、Co为主金属组分的负载型双金属催化剂催化甘油氨化反应进行。第二金属组分为贵金属时,有利于甘油的转化;当第二金属组分为Ni时,更有利于催化甘油氨化生成伯胺,伯胺的选择性之和为54.2%。
(2) 根据GC-MS对甘油氨化反应体系的分析结果,确定了反应体系的组成,建立了反应网络,明晰了烷基胺以及哌嗪类化合物的合成路径,甘油氨化合成二元有机胺—乙二胺和1,2-丙二胺分别有两种可能的反应路径;哌嗪类化合物主要通过醛胺缩合反应生成。
(3) 采用Aspen Plus对甘油氨化合成乙二胺和1,2-丙二胺的反应路径进行热力学计算与分析。结果表明,甘油氨化合成乙二胺反应为吸热反应,较高反应温度有利于乙二胺的生成;甘油催化氨化合成乙二胺很可能沿着以3-氨基-1,2-丙二醇路径进行。而甘油氨化合成1,2-丙二胺反应为放热反应,升高反应温度不利于该反应的进行;甘油催化氨化合成1,2-丙二胺低温时为2-氨基丙醇路径和1-氨基-2-丙醇路径并存,高温时变为1-氨基-2-丙醇路径为主。
[1] KUNTHAKUDEE N, KHEMTHONG P, LUADTHONG C,. CuAl2O4-CuO-Al2O3catalysts prepared by flame-spray pyrolysis for glycerol hydrogenolysis [J]. Molecular Catalysis, 2022, 523: 111426.
[2] KWAK B K, PARK D S, YUN Y S,. Preparation and characterization of nanocrystalline CuAl2O4spinel catalysts by sol-gel method for the hydrogenolysis of glycerol [J]. Catalysis Communications, 2012, 24: 90-95.
[3] MISHRA N K, KUMAR P, SRIVASTAVA V C,. Synthesis of Cu-based catalysts for hydrogenolysis of glycerol to 1,2-propanediol with in-situ generated hydrogen [J]. Journal of Environmental Chemical Engineering, 2021, 9(4): 105263.
[4] YUAN Z L, WANG J H, WANG L N,. Biodiesel derived glycerol hydrogenolysis to 1,2-propanediol on Cu/MgO catalysts [J]. Bioresource Technology, 2010, 101(18): 7088-7092.
[5] MONDAL S, MALVIYA H, BISWAS P. Kinetic modelling for the hydrogenolysis of bio-glycerol in presence of a highly selective Cu-Ni-Al2O3catalyst in a slurry reactor [J]. Reaction Chemistry & Engineering, 2019, 4(3): 595-609.
[6] PAMPHILE-ADRIÁN A J, FLOREZ-RODRIGUEZ P P, PIRES M H M,. Selective hydrogenolysis of glycerol over Ir-Ni bimetallic catalysts [J]. Catalysis Today, 2017, 289: 302-308.
[7] MENCHAVEZ R N, MORRA M J, HE B B. Glycerol hydrogenolysis using a Ni/Ce-Mg catalyst for improved ethanol and 1,2-propanediol selectivities [J]. Canadian Journal of Chemical Engineering, 2017, 95(7): 1332-1339.
[8] SUN D L, YAMADA Y, SATO S,. Glycerol hydrogenolysis into useful C3 chemicals [J]. Applied Catalysis B: Environmental, 2016, 193: 75-92.
[9] LAWRENCE S A. Amines: synthesis, properties and applications [M]. Cambridge: Cambridge University Press, 2004.
[10] 王熙庭, 陈曼华. 醇类脱氢胺化合成有机胺[J]. 湖南化工, 1999, 29(5): 9-11.
WANG X T, CHEN M H. The synthesis of amines by dehydro amination of alcohols [J]. Hunan Chemical Industry, 1999, 29(5): 9-11.
[11] 俞杰, 龙奕华, 李汪涛. 伯胺类化合物合成研究进展[J]. 高校化学工程学报, 2021, 35(6): 955-965.
YU J, LONG Y H, LI W T. Progress in synthesis of primary amine compounds [J]. Journal of Chemical Engineering of Chinese Universities, 2021, 35(6): 955-965.
[12] PERA-TITUS M, SHI F. Catalytic amination of biomass-based alcohols [J]. ChemSusChem, 2014, 7(3): 720-722.
[13] DU F, JIN X, YAN W J,. Catalytic H2auto transfer amination of polyols to alkyl amines in one pot using supported Ru catalysts [J]. Catalysis Today, 2018, 302: 227-232.
[14] XIE Z Y, AN H L, ZHAO X Q,. Catalytic activity of nickel and cobalt for amination of ethylene glycol: Which is better? [J]. Molecular Catalysis, 2022, 522: 112243.
[15] XIE Z Y, AN H L, ZHAO X Q,. Influence of different microstructures of cobalt on the catalytic activity for amination of ethylene glycol: Comparison of HCP cobalt and FCC cobalt [J]. Catalysis Science & Technology, 2022, 12(10): 3148-3157.
[16] AN H L, LI J P, ZHENG G Z,. Amination of ethylene glycol to ethylenediamine catalyzed by Co-Cu/-Al2O3[J]. Chemistry Select, 2022, 7(31): e202201303.
[17] XIE Z Y, AN H L, ZHAO X Q,Insight into highly catalytic performance of Co/-Al2O3for ethylene glycol amination: Promotion of catalytic activity of Co by acid sites and base sites [J]. Molecular Catalysis, 2022, 528: 112492.
[18] ZHAO G L, YU L A, YAN X L,The role of iron in the selective amination of 1,2-butanediol to 2-amino-1-butanol over Co–Ba–Fe/-Al2O3[J]. Reaction Kinetics, Mechanisms and Catalysis, 2010, 100(2): 449-457.
[19] YUE C J, DI K, GU L P,Selective amination of 1,2-propanediol over Co/La3O4catalyst prepared by liquid-phase reduction [J]. Molecular Catalysis, 2019, 477: 110539.
[20] WANG Y Z, FURUKAWA S, FU X P,. Organonitrogen chemicals from oxygen-containing feedstock over heterogeneous catalysts [J]. ACS Catalysis, 2020, 10(1): 311-335.
[21] BODIS J, LEFFERTS L, MULLER T E,. Activity and selectivity control in reductive amination of butyraldehyde over noble metal catalysts [J]. Catalysis Letters, 2005, 104(1/2): 23-28.
[22] IBANEZ J, KUSEMA B T, PAUL S,. Ru and Ag promoted Co/Al2O3catalysts for the gas-phase amination of aliphatic alcohols with ammonia [J]. CatalysisScience & Technology, 2018, 8(22): 5858-5874.
[23] ZHANG Y N, ZHANG Y C, FENG C,Amination of ethanol to acetonitrile over Ni-doped Co/-Al2O3catalyst [J]. Catalysis Communications, 2009, 10(10): 1454-1458.
[24] HO C R, DEFALQUE V, ZHENG S,. Propanol amination over supported nickel catalysts: Reaction mechanism and role of the support [J]. ACS Catalysis, 2019, 9(4): 2931-2939.
[25] SHIMIZU K, KON K, ONODERA W,Heterogeneous Ni catalyst for direct synthesis of primary amines from alcohols and ammonia [J]. ACS Catalysis, 2013, 3(1): 112-117.
[26] FISCHER A, MALLAT T, BAIKER A. Continuous amination of propanediols in supercritical ammonia [J]. Angewandte Chemie International Edition, 1999, 38(3): 351-354.
[27] FISCHER A, MACIEJEWSKI M, BÜRGI T,. Cobalt-catalyzed amination of 1,3-propanediol: Effects of catalyst promotion and use of supercritical ammonia as solvent and reactant [J]. Journal of Catalysis, 1999, 183(2): 373-383.
[28] FISCHER A, MALLAT T, BAIKER A. Amination of diols and polyols to acyclic amines [J]. Catalysis Today, 1997, 37(2): 167-189.
[29] 黄瑜. 甘油氢解联产乙二醇和甲醇的探索性研究[D]. 上海: 华东理工大学, 2011.
HUANG Y. Exploratory research on glycerol hydrogenation for EG and methanol [D].Shanghai: East China University of Science and Technology, 2011.
[30] 陈诗诗. 甘油氢解制乙二醇的探索性研究[D]. 上海: 华东理工大学, 2013.
CHEN S S.Exploratory research on glycerol hydrogenation for EG production [D]. Shanghai: East China University of Science and Technology, 2013.
[31] CAUWENBERGE G V, MELDER J P, HOFFER B W,Method for producing ethylene amines ethanol amines from monoethylene glycol: US, 7 700 806[P]. 2010-04-20.
[32] DING J F, CUI M Y, MA T L,. Catalytic amination of glycerol with dimethylamine over different type of heteropolyacid/Zr-MCM-41 catalysts [J]. Molecular Catalysis, 2018, 457: 51-58.
[33] WAN X Y, ZHANG Q, ZHU M M,. Interface synergy between IrOand H-ZSM-5 in selective C─O hydrogenolysis of glycerol toward 1,3-propanediol [J]. Journal of Catalysis, 2019, 375: 339-350.
[34] YUAN Z L, WANG L N, WANG J H,Hydrogenolysis of glycerol over homogenously dispersed copper on solid base catalysts [J]. Applied Catalysis B: Environmental, 2011, 101(3/4): 431-440.
[35] BALARAJU M, REKHA V, PRASAD P S S,Influence of solid acids as co-catalysts on glycerol hydrogenolysis to propylene glycol over Ru/C catalysts [J]. Applied Catalysis A: General, 2009, 354(1/2): 82-87.
[36] 褚永良. 乙醇胺环化合成哌嗪的研究[D]. 上海: 华东理工大学, 2014.
CHU Y L. Study on the cyclization of ethanolamine piperazine [D]. Shanghai: East China University of Science and Technology, 2014.
[37] JIN X, DANG L N, LOHRMAN J,. Lattice-matched bimetallic CuPd-graphene nanocatalysts for facile conversion of biomass-derived polyols to chemicals [J]. ACS Nano, 2013, 7(2): 1309-1316.
[38] 付丽丽, 蒋登高. 棕榈酸异丙酯合成反应的热力学分析[J]. 高校化学工程学报, 2016, 30(2): 398-403.
FU L L, JIANG D G. Thermodynamic analysis of isopropyl palmitate synthesis [J]. Journal of Chemical Engineering of Chinese Universities, 2016, 30(2): 398-403.
Reaction process analysis on catalytic amination of biomass-based glycerol to organic amine
ZUO Zhishuai, ZHENG Guangzong, AN Hualiang, WANG Guirong, ZHAO Xinqiang, WANG Yanji
(Hebei Provincial Key Lab of Green Chemical Technology and Efficient Energy Saving,Hebei University of Technology, Tianjin 300130, China)
In order to solve the problem of excessive glycerol in biodiesel production, a method of directly preparing high value-added organic amines based on glycerol was proposed. A series of supported bimetallic catalysts were prepared using-Al2O3as the support and Co as the main metal component. Their catalytic performance for the amination of glycerol was investigated. The results show that the amination of glycerol is a complex reaction system and Co-Ni/-Al2O3is more conducive for catalyzing glycerol to primary amines with a primary amine selectivity of 54.2%. The reaction system was qualitatively analyzed by gas chromatography-mass spectrometry(GC-MS), and a reaction network was established with the synthesis pathways to straight-chain amines and piperazines clarified. Based on the GC-MS results, two possible reaction pathways to ethylenediamine and 1,2-propanediamine were proposed, respectively. To determine the most possible pathway, a thermodynamic analysis for the amination of glycerol to diamine—ethylenediamine and 1,2-propanediamine was performed using Aspen Plus. The synthesis of ethylenediamine from glycerol used 3-amino-1,2-propanediol as the intermediate. For the 1,2-propanediamine synthesis from glycerol, the pathways of 2-aminopropanol and 1-amino-2-propanol as intermediates happened simultaneously at a lower temperature. With the increase of reaction temperature, the latter becomes the main pathway.
glycerol; catalytic amination; organic amine; reaction pathway; thermodynamic analysis
TQ032.4
A
10.3969/j.issn.1003-9015.2023.05.010
1003-9015(2023)05-0776-11
2022-08-17;
2022-11-29。
国家自然科学基金(21978066,U21A20306);河北省自然科学基金重点项目(B2020202048)。
左志帅(1998-),女,河北沧州人,河北工业大学硕士生。
赵新强,E-mail:zhaoxq@hebut.edu.cn
左志帅, 郑广宗, 安华良, 王桂荣, 赵新强, 王延吉. 生物质甘油催化氨化制备有机胺的反应过程分析 [J]. 高校化学工程学报, 2023, 37(5): 776-786.
:ZUO Zhishuai, ZHENG Guangzong, AN Hualiang, WANG Guirong, ZHAO Xinqiang, WANG Yanji. Reaction process analysis on catalytic amination of biomass-based glycerol to organic amine [J]. Journal of Chemical Engineering of Chinese Universities, 2023, 37(5): 776-786.

